修回日期: 2007-02-10
接受日期: 2007-03-26
在线出版日期: 2007-04-28
目的: 观察氧化苦参碱(OM)对人结肠癌细胞P21, P27, Cyclin E1及CDK2表达的影响, 研究其抑制细胞增殖的其他途径, 探讨OM抗肿瘤的作用机制.
方法: 培养人结肠癌细胞株SW1116, 以2, 3, 4 g/L OM作用24和48 h, 以流式细胞仪测定OM对SW1116细胞的周期阻断作用; 并采用RT-PCR、Western blot法测定细胞周期相关蛋白P21、P27、Cyclin E1和CDK2的表达水平.
结果: 与对照组相比, 不同浓度(2, 3, 4 g/L)OM可使细胞阻滞于G1/G0期(24 h: 67.5%±0.1%, 69.5%±1.4%, 71.0%±1.0% vs 58.6%±0.4%, P<0.05; 48 h: 68.5%±0.3%, 71.9%±0.9%, 78.0%±0.4% vs 58.8% ±0.1%, P<0.05), 下调Cyclin E1的mRNA和蛋白表达水平(P<0.05), 上调细胞周期负调控因子P21、P27的mRNA及蛋白表达水平(P<0.05), 降低CDK2的mRNA水平而对其蛋白表达无影响.
结论: OM可能通过阻滞细胞周期, 降低Cyclin E1蛋白, 上调P21、P27的基因表达, 来发挥其抗肿瘤作用.
引文著录: 陆丽华, 冉志华. 氧化苦参碱对人结肠癌细胞P21, P27, Cyclin E1及CDK2表达的影响. 世界华人消化杂志 2007; 15(12): 1353-1357
Revised: February 10, 2007
Accepted: March 26, 2007
Published online: April 28, 2007
AIM: To observe the effect of oxymatrine (OM) on the expression of P21, P27, Cyclin E1 and CDK2 in human colon cancer cell line SW1116, investigate the pathways of OM in inhibiting tumor cell proliferation, and explore its anti-tumor mechanism.
METHODS: Human colon cancer cell line SW1116 was cultured and then treated with different concentrations (2, 3, 4 g/L) of OM, respectively, for 24 and 48 hours. Flow cytometry was used to detect the cycle changes of SW1116 cells. Reverse transcription polymerase chain reaction and Western blot were performed to measure the expression of P21, P27, Cyclin E1 and CDK2 at mRNA and protein level.
RESULTS: In comparison with those in control group, the percentages of G1/G0-phase cells were significantly increased after treatment with 2, 3, 4 g/L OM (24 h: 67.5% ± 0.1%, 69.5% ± 1.4%, 71.0% ± 1.0% vs 58.6% ± 0.4%, P < 0.05; 48 h: 68.5% ± 0.3%, 71.9% ± 0.9%, 78.0% ± 0.4% vs 58.8% ± 0.1%, P < 0.05); the mRNA and protein expression of Cyclin E1 was down-regulated while those of P21 and P27 were up-regulated (P < 0.05); the mRNA expression of CDK2 was lowered, but the protein expression of CDK2 had no significant changes (P > 0.05).
CONCLUSION: OM may inhibit the proliferation of SW1116 cells by blocking cell cycle, down-regulating the expression of Cyclin E1 and up-regulating the expression of P21 and P27.
- Citation: Lu LH, Ran ZH. Effects of oxymatrine on the expression of P21, P27, Cyclin E1 and CDK2 in human colon cancer cell line SW1116. Shijie Huaren Xiaohua Zazhi 2007; 15(12): 1353-1357
- URL: https://www.wjgnet.com/1009-3079/full/v15/i12/1353.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i12.1353
氧化苦参碱(oxymatrine, OM), 分子式C15H24N2O2, 是中药苦参的主要有效成分, 具有抗炎、抗心率失常、防止肝纤维化[1]等多种作用. 临床上, 它常用于治疗慢性乙型肝炎、肿瘤放化疗引起的白细胞低下等[2]. 近年来, OM的抗肿瘤作用被发现[3]. OM对一些肿瘤细胞株具有很强的杀伤作用, 如人肝癌细胞株HepG2[3]、人红白血病细胞株K-562[3]等. 动物实验提示, OM对鼠肝癌有一定的治疗作用[4]. 我们先前的研究已经证实OM对人结肠癌细胞株SW1116具有剂量依赖性的杀伤作用, 可能通过影响hTERT及其上游基因的表达来抑制端粒酶活性, 发挥其抗肿瘤作用[5]. 我们主要研究OM对人结肠癌细胞株SW1116细胞周期的阻断作用及其可能的分子机制.
人结肠癌细胞株SW1116来自消化所实验室, OM为天晴复欣苦参素注射液, BRL RPMI1640完全培养液、TRIzol试剂均购自美国Gibcol公司, 胰蛋白酶、HEPES、二甲亚砜均购自美国Sigma公司, 左旋谷氨酰胺(德国Merk公司), 四唑蓝(MTT)(北京鼎国生物技术有限公司). 氯仿、异丙醇、750 mL/L乙醇(均为分析纯试剂)均购于上海长城华美仪器化剂有限公司; MMLV逆转录酶、逆转录缓冲液均为美国Promega公司产品; 引物合成、oligodT18均来自上海生工生物工程有限公司; dNTP、RNA酶抑制剂均购自华美生物工程公司. 细胞总蛋白抽提试剂盒由上海睿星基因公司提供. BCA蛋白质定量试剂盒、ECL发光检测试剂盒均为Pierce Chemical公司的产品. 一抗: 鼠抗人P27 mAb(610241)、鼠抗人P21 mAb(556430)均为BD公司产品, 鼠抗人Cyclin E1 mAb(CC05)购自Calbiochem, CDK2为上海睿星基因公司产品.
用含100 mL/L胎牛血清的RPMI1640完全培养液, 于含50 mL/L CO2、950 mL/L空气的CO2孵箱中, 在37 ℃、95%湿度条件下培养人结肠癌细胞株SW1116. 不同浓度的OM作用于结肠癌细胞株SW1116细胞24 h和48 h, 以流式细胞仪测定OM对SW1116细胞的周期阻断作用; 并采用RT-PCR、Western blot法测定细胞周期相关蛋白P21, P27, Cyclin E1和CDK2的表达水平.
1.2.1 流式细胞术分析: 取对数生长期的SW1116细胞, 按1×107细胞/L、每瓶5 mL接种于25 cm2培养瓶, 培养24 h后, 加入终浓度为2, 3, 4 g/L的OM, 对照组加入等量的RPMI1640培养液, 继续培养不同时间. 2.5 g/L胰酶消化收集各组细胞, 用冷的PBS洗2次, 每次4 ℃ 1000 g离心5 min. 去上清后加入4 ℃ PBS 0.5 mL, 充分混匀悬浮细胞, 计数制成1×109细胞/L×1 mL单细胞悬液. 在震荡器上缓慢加入预冷的950 mL/L乙醇2 mL, 充分混匀. 用PBS洗2次固定细胞, 加入RNA酶A (上海生工生物工程公司)100 kU/L, 37 ℃水浴摇床振荡30 min, 10 g/L含Triton X-100的碘化丙啶(Sigma)染色, 4 ℃避光30 min. 尼龙网过滤, 流式细胞仪(COULTER EPICS XL)上样检测.
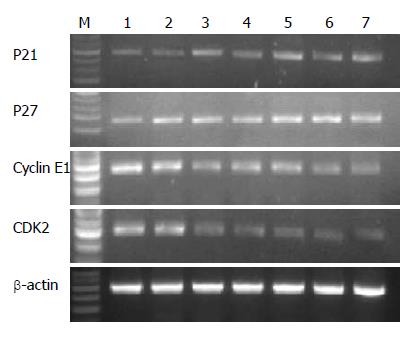
1.2.2 RT-PCR检测: (1)细胞总RNA的抽提、质检: SW1116细胞接种于25 cm2培养瓶, 24 h后分别加入终浓度为2, 3和4 g/L的OM, 对照组加入等量的RPMI1640培养液, 在不同时间点收取细胞, 吸去上清液, PBS洗3次. 细胞总RNA的抽提采用TRIzol试剂(Gibco BRL), 根据说明书操作. RNA产物置-70 ℃冰箱保存备用. 提取的RNA经分光光度计检测的A260/A280值为1.8-2.0, 从电泳结果来看, 其18S和28S条带都很清晰, 亮度比约为2:1, 说明总RNA纯度基本达到实验要求且无明显降解; (2)引物序列: 根据基因库中的基因序列, 采用Primer 5.0引物设计软件, 由计算机辅助设计, 并由上海生工生物工程公司公司分别合成针对P21, P27, Cyclin E1, CDK2, β-actin的PCR扩增引物(表1); (3)RT-PCR: 按二步法进行RT-PCR反应, 先将mRNA反转录为cDNA, 然后再以cDNA为模板进行PCR扩增反应: 取10 μg总RNA样品+2 μL Oligo(dT)18(0.5 g/L), 加入DEPC水至24 μL, 70 ℃水浴5 min, 迅速转移至冰浴5 min, 快速离心后加入5×逆转录缓冲液10 μL+2 μL 10 mmol/L dNTPMix(上海生工)+1 μL RNA酶抑制剂(4×107 U/L)(华美生物公司)+M-MLV逆转录酶2 μL(华美生物公司, 4×108 U/L), 加入DEPC水至终体系50 μL, 混匀, 置42 ℃水浴1 h, 95 ℃ 5 min终止反应. 产物置于-20 ℃冰箱保存备用. 取5 μL PCR扩增产物加1 μL 6×上样缓冲液上样于含0.5 mg/L溴化乙锭的15 g/L琼脂糖凝胶中电泳,在紫外线下生物电泳图像分析系统(FR-200型, 上海复日生物公司)上观察结果并照相.
| 基因 | 引物序列 | PCR扩增片段(bp) | 反应条件 |
| β-actin | 5'-GGA CTT CGA GCA AGA GAT GG-3' | 404 | 94 ℃变性5 min; 94 ℃ 30 s, 60 ℃ 1 min, |
| 5'-ACA TCT GCT GGA AGG TGG AC-3' | 72 ℃ 1min, 循环30次; 72 ℃延伸10 min | ||
| P21 | 5'-TTG ATT AGC AGC GGA ACA-3' | 270 | 94 ℃变性5 min; 94 ℃ 60 s, 55 ℃ 1 min, |
| 5'-TAC AGT CTA GGT GGA GAA ACG-3' | 72 ℃ 1 min, 循环28次; 72 ℃延伸5 min | ||
| P27 | 5'-CAA GTA CGA GTG GCA AGA-3' | 492 | 94 ℃变性5 min; 94 ℃ 60 s, 54 ℃ 1 min, |
| 5'-TCC ATG AAG TCA GCG ATA-3' | 72 ℃ 1 min, 循环29次; 72 ℃延伸5 min | ||
| Cyclin E1 | 5'-CTG GAT GTT GAC TGC CTT GA-3' | 359 | 94 ℃变性5 min; 94 ℃ 30 s, 52 ℃ 1 min, |
| 5'-CCG CTG CTC TGC TTC TTA C-3' | 72 ℃ 1 min, 循环30次; 72 ℃延伸5 min | ||
| CDK2 | 5'-CCT TGT TTG TCC CTT CTA C-3' | 395 | 94 ℃变性3 min; 94 ℃ 30 s, 55 ℃ 1 min, |
| 5'-CAA ATC CAC CCA CTA TGA-3' | 72 ℃ 1 min, 循环30次; 72 ℃延伸5 min |
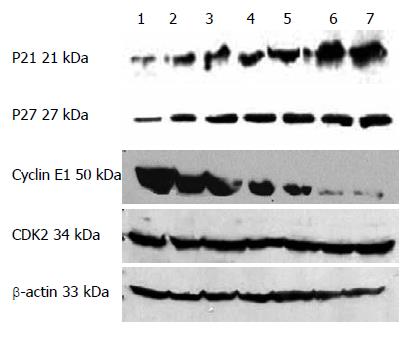
1.2.3 Western印迹试验: 7个75 cm2瓶子收细胞, 分别计数, 按1×107细胞加200 μL低盐细胞裂解液计算, 分别加入细胞裂解液4 ℃裂解1 h,14 000 r/min 20 min, 收集上清. BCA蛋白质定量试剂测定蛋白质浓度. -70 ℃冰箱保存备用. 适量的总蛋白质在120 g/L SDS-PAGE胶电泳分离后, 80 V电压电泳, 湿转1 h. 牛奶封闭2.5 h, 分别用鼠源性单克隆抗体P21、P27、Cyclin E1及CDK2一抗与膜4 ℃孵育过夜. 1×TBST洗涤30 min, 羊抗鼠的二抗与膜孵育30 min后洗涤30 min. 用同样方法标记鼠单克隆抗体β-actin作点样对照. Pierce Chemical检测试剂与膜作用后暗室曝光, X线片显影、定影.
统计学处理 所有实验均重复3次. 数据用均数±标准差表示, 采用SPSS10.0统计软件包, P<0.05时认为差异有统计学意义.
OM作用于SW1116细胞24 h时, G0/G1期细胞比例增加, S期细胞比例减少(P<0.05). 此种细胞周期改变也存在于OM作用于SW1116细胞48 h后(P<0.05,表2).
β-actin作为内参以保证在相等的mRNA含量下进行比较. 与对照组相比, P21的表达量均有所升高(P<0.05). P27在OM 2 g/L 24 h组表达无明显变化, 在2 g/L 48 h组表达升高(P<0.05), 更高浓度组表达也升高(P<0.05). p27 mRNA的改变呈现明显的时间依赖性. Cyclin E1基因表达逐渐降低(P<0.05). CDK2基因表达逐渐降低(OM 2 g/L 24 h组与对照组相比差异无统计学意义, 其余各组P<0.05)(图1).
应不同浓度的OM干预人结肠癌细胞株SW1116, 运用Western blot法分别检测干预后24、48 h的蛋白表达情况, P21、P27的蛋白表达水平相比对照组明显增强(P<0.05), 呈时间、剂量依赖性. Cyclin E1的蛋白表达水平相比对照组明显呈时间、剂量依赖性减弱(P<0.05). 与对照组相比, CDK2的蛋白表达无明显变化(P>0.05)(图2).
结直肠癌的发病率占美国常见恶性肿瘤的第3位[6]. 结肠癌早期症状不明显, 只有部分患者有手术完全切除的机会, 化疗的疗效不高, 5 a生存率低[7], 急需有效的新化疗药物应用于临床. OM可抑制部分肿瘤的增殖和转移, 在诱导肿瘤细胞分化、促进肿瘤细胞凋亡以及对分化和凋亡基因的调控上, 亦表现出一定的作用[3]. 他还能抑制肿瘤诱导血管内皮细胞增殖的作用, 同时其兼有升高白细胞、使免疫活性T细胞增多、提高机体免疫力的作用, 这是众多化疗药所不能比拟的[8-9]. 本实验旨在研究传统中药OM在抗肿瘤方面的独特效用, 为临床治疗结肠癌提供新的思路.
我们用流式细胞仪检测细胞周期来分析OM抑制结肠癌细胞增殖的原因. OM引起结肠癌SW1116细胞G0/G1期细胞比例增加, S期细胞比例减少(P<0.05). 这提示, OM作用于SW1116细胞后引起G1/S期阻滞, 从而抑制其增殖. 细胞周期分为4期(G1、S、G2、M期), 其中关键的两期为DNA合成(S)期和细胞分裂(M)期. 细胞周期停滞(cell cycle arrest)是指正常细胞受到不当因素影响时, 主动停止在细胞周期的某一阶段, 以消除所受到的不利影响[10]. 近年来, 阻滞恶性肿瘤的细胞周期成了肿瘤治疗的一种新尝试[11]. 在高等真核细胞中, 细胞周期是由一组称为细胞周期蛋白(cyclin)与一组依赖于cyclin的细胞周期蛋白依赖性激酶(CDK)来调控的. 另有对CDK活性起负调控作用的蛋白质称为CDK抑制蛋白(CKI), 包括CIP/KIP与INK4两大家族[12], 可抑制CDK/Cyclins复合物的活性, 负性调节细胞进程. p21、p27属于CIP/KIP家族.
我们对OM导致细胞周期阻断于G1/S期的分子机制作了进一步的研究. 正常细胞中, Cyclin D1和CDK4先结合形成复合体, CDK4发挥激酶活性, 其先磷酸化pRb[13]. 之后, 进入S期必需的转录因子E2F从Rb-E2F复合体中解离[14]. 这促进G1/S-Cyclin(即Cyclin E)的积累而刺激CDK2的活性, 从而激活另一些转录因子, 使与DNA合成有关的基因表达, 细胞即由G1期进入S期[15]. 在结肠癌细胞株SW1116中, OM的药物干预可下调Cyclin E1的mRNA水平和蛋白表达, CDK2的蛋白表达无明显变化. 我们认为OM影响了CDK2的基因转录而未参与其翻译过程, SW1116中CDK2蛋白的量未改变. 这提示表达于G1期晚期的Cyclin E1下调, 随之CDK2的活性下降, 导致细胞阻滞于G1-S检测点. 这与漆树黄酮(fisetin)干预人结肠癌细胞株HT-29, 引起G1期阻滞, Cyclin E蛋白下调, CDK2蛋白水平无明显变化相符[16]. 除了周期蛋白和磷酸化对CDK活性进行调节外, CKI(如P21、P27)对CDK活性起负调控作用. P27和P21能抑制包括Cyclin E-CDK2在内的多种G1期Cyclin-CDK激酶活性[17], 使细胞不能通过G1期[18], 从而防止细胞过度增生形成肿瘤. P21的过表达可抑制哺乳动物的细胞增生. 人结肠癌细胞株HT-29中, P21的过表达引起明显的细胞生长抑制[19]. OM作为抗癌药物作用于SW1116细胞株后, P21的mRNA和蛋白表达明显增加. Galizia et al[20]报道结直肠癌患者中P27表达下调, Claudio et al[21]研究认为, P27的表达水平是Ⅰ-Ⅲ期结直肠癌患者根治术后无瘤生存期和总生存期的独立预后因素. 此研究认为, OM可使SW1116细胞中P27 mRNA和蛋白表达明显增加.
关于OM的临床应用已有少量的报道. 一组临床试验用吗特灵(苦参总碱注射液)治疗晚期恶性肿瘤79例, 完全缓解2例, 部分缓解19例, 有效率为26.58%. 吗特灵的毒副反应轻微(Ⅰ度), 79例患者均能耐受, 不需特殊处理[22]. 我国贵州的一组临床试验用复方苦参注射液(岩舒)治疗56例晚期癌症无放化疗指征的患者(其中11例肠癌), 完全缓解0例, 部分缓解19例, 近期总有效率34%(19/56), 毒副反应较轻[23].
总之, OM干预结肠癌SW1116细胞株后, 细胞周期阻滞于G1期, 其降低Cyclin E1蛋白的表达水平, 上调P21、P27蛋白的表达. 本研究的结果提示OM的抗癌作用与其阻滞细胞周期、调节细胞周期相关蛋白的表达有关.
氧化苦参碱(OM)是中药苦参的主要有效成分, 具有抗炎、抗心率失常、抗肿瘤、防止肝纤维化等作用. OM的临床前实验的研究将为OM正式进入临床应用做好铺垫, 深入的分子机制研究有利于明确其抗肿瘤的机制.
建议阅读《氧化苦参碱对人结肠癌细胞株SW1116杀伤作用的实验研究》. 他证实OM对人结肠癌细胞株SW1116具有剂量依赖性的杀伤作用, 可能通过影响hTERT及其上游基因的表达来抑制端粒酶活性, 发挥其抗肿瘤作用. 另外, 正文中提到了两篇OM的临床应用的报道.
关于OM对肿瘤的细胞周期的影响的报道罕见. 本文探讨了OM对SW1116细胞的细胞周期的影响并深入到分子机制, 发现OM可能通过阻滞细胞周期, 降低Cyclin E1蛋白, 上调P21、P27的基因表达, 来发挥其抗肿瘤作用.
此文为OM抗肿瘤的临床应用做好了铺垫, 有助于阐明OM抗肿瘤的机制.
本文提出了比较有价值的研究发现, 在氧化苦参碱对人结肠癌细胞作用方面有重要贡献. 文章具有一定的科学性和可读性, 进一步充实了该领域的研究内容.
电编: 郭海丽 编辑:王晓瑜
| 1. | Zhang MJ, Huang J. Recent research progress of anti-tumor mechnism matrine. Zhongguo Zhong Yao Za Zhi. 2004;29:115-118. [PubMed] |
| 2. | Chen XS, Wang GJ, Cai X, Yu HY, Hu YP. Inhibition of hepatitis B virus by oxymatrine in vivo. World J Gastroenterol. 2001;7:49-52. [PubMed] [DOI] |
| 4. | Zhou AL, Zhu YJ, Hu YE, Mao JH, Jiang DR. Effect of acupoint-injection of oxymatrine on experimental hepatic carcinoma and study on the mechanism. Zhongguo Zhen Jiu. 2007;27:48-52. [PubMed] |
| 6. | Ananthakrishnan AN, Schellhase KG, Sparapani RA, Laud PW, Neuner JM. Disparities in colon cancer screening in the Medicare population. Arch Intern Med. 2007;167:258-264. [PubMed] [DOI] |
| 7. | Van Cutsem E, Costa F. Progress in the adjuvant treatment of colon cancer: has it influenced clinical practice? JAMA. 2005;294:2758-2760. [PubMed] [DOI] |
| 10. | Freire R, van Vugt MA, Mamely I, Medema RH. Claspin: timing the cell cycle arrest when the genome is damaged. Cell Cycle. 2006;5:2831-2834. [PubMed] [DOI] |
| 11. | Owa T, Yoshino H, Yoshimatsu K, Nagasu T. Cell cycle regulation in the G1 phase: a promising target for the development of new chemotherapeutic anticancer agents. Curr Med Chem. 2001;8:1487-503. [PubMed] [DOI] |
| 12. | Harper JW. Cyclin dependent kinase inhibitors. Cancer Surv. 1997;29:91-107. [PubMed] |
| 13. | Deshpande A, Sicinski P, Hinds PW. Cyclins and cdks in development and cancer: a perspective. Oncogene. 2005;24:2909-2915. [PubMed] [DOI] |
| 14. | Harbour JW, Dean DC. The Rb/E2F pathway: expanding roles and emerging paradigms. Genes Dev. 2000;14:2393-2409. [PubMed] [DOI] |
| 16. | Lu X, Jung J, Cho HJ, Lim DY, Lee HS, Chun HS, Kwon DY, Park JH. Fisetin inhibits the activities of cyclin-dependent kinases leading to cell cycle arrest in HT-29 human colon cancer cells. J Nutr. 2005;135:2884-2890. [PubMed] |
| 17. | Campanini F, Santucci MA, Brusa G, Pattacini L, Arpinati M, Rondelli D, Gamberi B, Barbieri E, Babini L, Tura S. Expression of P21(WAF1/CIP1/SID1) cyclin-dependent kinase inhibitor in hematopoietic progenitor cells. Gene. 2001;273:173-180. [PubMed] [DOI] |
| 18. | Owa T, Yoshino H, Yoshimatsu K, Nagasu T. Cell cycle regulation in the G1 phase: a promising target for the development of new chemotherapeutic anticancer agents. Curr Med Chem. 2001;8:1487-1503. [PubMed] [DOI] |
| 19. | Izawa H, Yamamoto H, Damdinsuren B, Ikeda K, Tsujie M, Suzuki R, Kitani K, Seki Y, Hayashi T, Takemasa I. Effects of p21cip1/waf1 overexpression on growth, apoptosis and differentiation in human colon carcinoma cells. Int J Oncol. 2005;27:69-76. [PubMed] [DOI] |
| 20. | Galizia G, Lieto E, Ferraraccio F, Orditura M, De Vita F, Castellano P, Imperatore V, Romano C, Ciardiello F, Agostini B. Determination of molecular marker expression can predict clinical outcome in colon carcinomas. Clin Cancer Res. 2004;10:3490-3499. [PubMed] [DOI] |
| 21. | Claudio PP, Russo G, Kumar CA, Minimo C, Farina A, Tutton S, Nuzzo G, Giuliante F, Angeloni G, Maria V. pRb2/p130, vascular endothelial growth factor, p27(KIP1), and proliferating cell nuclear antigen expression in hepatocellular carcinoma: their clinical significance. Clin Cancer Res. 2004;10:3509-3517. [PubMed] [DOI] |