修回日期: 2007-01-10
接受日期: 2007-01-20
在线出版日期: 2007-04-28
目的: 观察β-榄香烯对四氯化碳肝纤维化大鼠TGF-β1、α-SMA、Col-Ⅰ表达的影响.
方法: 采用CCl4皮下注射诱导Wistar♂大鼠肝纤维化模型, 用β-榄香烯0.1 mL/100 g剂量每天腹腔注射8 wk后, 用苏木精-伊红染色(HE)和胶原纤维(Masson)染色观察大鼠肝脏病理变化, 酶动力法检测肝功能, SP免疫组化法检测肝组织中a-肌动蛋白(α-SMA)、转化生长因子β1(TGF-β1)、Ⅰ型胶原(Col-Ⅰ)表达的变化, 样本碱水解法检测肝组织中羟脯氨酸(HYP)的含量.
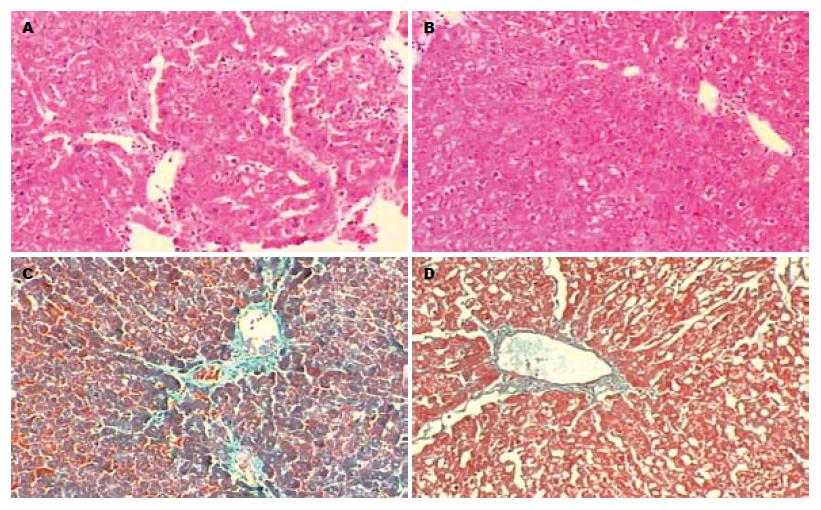
结果: 8 wk后, 正常组、模型组、对照组及治疗组肝组织胶原纤维面积百分比分别为1.22%±0.24%, 7.47%±0.81%, 5.57%±0.78%, 4.33%±0.48%, 治疗组与模型组、对照组相比均有显著差异(P<0.01), 并且治疗组肝组织纤维化程度分级较模型组逐渐好转, 胶原纤维所占面积显著缩小; 在肝组织中测得的Col-Ⅰ阳性面积比分别为3.022%±0.553%, 9.998%±1.431%, 7.554%±0.914%, 4.587%±1.008%, 治疗组与模型组、对照组相比均有显著差异(P<0.01). α-SMA和TGF-β1在治疗组和模型组肝组织中的表达也有显著差异(3.172%±0.542% vs 5.605%±1.315%, P<0.01; 2.868%±0.554% vs 5.653%±0.9%, P<0.01).
结论: β-榄香烯对四氯化碳肝纤维化大鼠具有拮抗作用, 主要是通过抑制肝星状细胞激活, 降低TGF-β1, α-SMA在肝组织中的表达, 减少细胞外基质在肝脏中的沉积, 从而延缓肝纤维化的进程.
引文著录: 胡胜军, 杨玲, 朱清静, 彭汉光. β-榄香烯对实验性肝纤维化大鼠TGF-β1、α-SMA、Col-Ⅰ表达的影响. 世界华人消化杂志 2007; 15(12): 1324-1330
Revised: January 10, 2007
Accepted: January 20, 2007
Published online: April 28, 2007
AIM: To study the effect of zedoary rhizome extract (β-elemene) on the expression of transforming growth factor-β1 (TGF-β1), α-smooth muscle actin (α-SMA) and type Ⅰ collagen-Ⅰ (Col-Ⅰ) in rats with hepatic fibrosis.
METHODS: The experimental model of hepatic fibrosis was induced by hypodermical injection of carbon tetrachloride (CCl4) in Wistar male rats. β-elemene was intraperitonealy administered into the rats for 8 weeks (0.1 mL/100 g body weight per day). The samples were stained with hematoxylin and eosin for histopathological examination. Masson staining was used to observe the liver fibrosis of rats. Liver functions were measured by enzymatic kinetic analysis. The levels of α-SMA, TGF-β1 and Col-Ⅰ expression in liver tissues were measured by SP immunohistochemistry method. The content of hydroxyproline in liver tissues was tested by specimen alkaline hydrolysis.
RESULTS: After eight weeks of treatment, the area percentages of collagen fiber in normal, model, control and treatment groups were 1.22% ± 0.24%, 7.47% ± 0.81%, 5.57% ± 0.78% and 4.33% ± 0.48%, respectively. The percentage was significantly lower in treatment group than that in model and control group (both P < 0.01), and the histological remission and collagen fiber diminishment were also better in treatment group. The expression of Col-Ⅰ in normal, model, control and treatment groups were 3.022% ± 0.553%, 9.998% ± 1.431%, 7.554% ± 0.914% and 4.587% ± 1.008%, respectively, and it was also significantly lower in treatment group than that in model and control group (P < 0.01). The levels of α-SMA and TGF-β1 expression were significantly different between treatment group and model group (3.172% ± 0.542% vs 5.605% ± 1.315%, P < 0.01; 2.868% ± 0.554% vs 5.653% ± 0.9%, P < 0.01).
CONCLUSION: β-elemene can reverse the pathologic progression of CCl4 induced liver fibrosis by inhibiting the activation of hepatic stellate cells, down-regulating the expression of α-SMA, TGF-β1 and decreasing the sediment of extracellular matrix in the liver tissues.
- Citation: Hu SJ, Yang L, Zhu QJ, Peng HG. Effect of β-elemene on the expression of transforming growth factor-β1, a-smooth muscle actin and collagen-Ⅰ in rats with hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2007; 15(12): 1324-1330
- URL: https://www.wjgnet.com/1009-3079/full/v15/i12/1324.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i12.1324
肝纤维化(hepatic fibrosis, HF)是多种原因引起的慢性肝损伤的共同病理改变, 其特征是纤维增生和降解不平衡, 纤维组织在肝脏过度沉积的结果[1]. 研究证实, 肝星状细胞(hepatic stellate cells, HSC)活化和转型在肝纤维化中发挥关键作用, HSC的激活在HF发生、发展中处于中心地位[2-3]. 静息状态的HSC激活为肌成纤维细胞并产生大量的细胞外基质(ECM), 而ECM合成、沉积增多, 降解相对减少甚至抑制, 其结果是肝细胞功能进一步受损、肝脏结构破坏而最终导致肝硬化. 因此, 抑制HSC激活以及ECM的沉积与否则是一个非常重要的靶点, 是促进肝纤维化逆转的重要因素[4].
中药莪术具有活血化瘀、消积软坚作用, 体外可抑制成纤维细胞生长[5], 对单侧输尿管梗阻诱发的肾硬化大鼠, 可通过多个环节促进细胞外基质(ECM)的降解[6]; 并具有抗大鼠免疫性和化学性肝纤维化作用[7-8], 临床广泛应用于肝纤维化的治疗. 但其抗纤维化的有效成分尚不明确. β-榄香烯是从中药莪术中提取的一种倍半萜衍生物, 为非细胞毒性的抗癌药物, 除对多种肿瘤细胞具有抑制作用外, 尚有抗氧化、调节免疫、抗血栓和扩血管等作用[9-14]. 那么β-榄香烯是否为莪术抗肝纤维化的有效成分呢? 我们前期在体外实验中发现该提取物能呈剂量依赖性和时间依赖性抑制肝星状细胞增殖和诱导凋亡[15]. 本文在此基础上进一步从体内模型探讨β-榄香烯是否具有抗肝纤维化作用, 并报道如下.
♂健康6周龄Wistar大鼠40只, 体质量200-220 g, 购于华中科技大学同济医学院实验动物中心. 随机分为4组: 空白对照组(N)10只, 模型组(M)10只, 溶酶对照组(C)10只, β-榄香烯治疗组(T)10只. 四氯化碳, 市售食用色拉油, β-榄香烯单体95%纯度(体积分数)购于温州市工业科学研究院生物工程研究所, 99%(体积分数)1-甲基-2-吡咯烷酮(1-Methyl-2-pyrrolidinone)购于AIDRICH公司, 40 g/L中性福尔马林缓冲液, 羟脯氨酸(hydroxyproline, HYP)检测试剂盒(南京建成生物工程研究所);Ⅰ型胶原、转化生长因子β1(TGF-β1)多克隆抗体、a-平滑肌肌动蛋白(α-SMA)及兔抗鼠SP试剂盒(武汉博士德生物工程有限公司). RNA提取试剂盒为美国罗氏公司产品, RNA酶抑制剂、M-MLV逆转录酶及聚合酶链反应(PCR)扩增试剂均购自美国Promega公司.
将四氯化碳溶于食用色拉油中, 配成40%浓度(体积分数)以备用. 95% β-榄香烯单体溶解于等体积的99% 1-甲基-2-吡咯烷酮(1-methyl-2-pyrrolidinone)配成50 g/L溶液备用.
1.2.1 动物模型制备及给药方法: 所有组动物饲养1 wk后, 除正常组以外的大鼠轮替背部皮下及四肢内侧注射40% CCl4植物油混悬液3 mL/kg体质量, 每周两次; 正常组大鼠单纯采用同体积的植物油注射. 在造模的同时, 治疗组和对照组2 wk后分别加用β-榄香烯溶酶混合溶液1 mL/kg体质量和等体积溶酶腹腔注射. 4 wk后取模型组大鼠肝脏做HE染色切片, 动态观测肝脏病理过程. 治疗给药8 wk后, 全部动物麻醉解剖, 下腔静脉取血, 备用于生化指标测定, 后取大鼠肝脏, 剪成小块, 用Tris-HCL缓冲液洗涤6次, 用吸水纸吸干肝组织表面水份后备用, 用于HYP的测定, 再取右叶中间的部分以40 g/L中性甲醛固定, 用于免疫组化切片, 余下肝脏于液氮中速冻、-80 ℃冰箱内保存, 备用于肝组织匀浆测组织生化、抽提组织总RNA用于RT-PCR指标的测定等.
1.2.2 检测指标和方法: 大鼠血清丙氨酸基转移酶(ALT)、天冬氨酸转氨酶(AST)、血清蛋白(Alb)测定生化全自动分析仪测定. α-肌动蛋白(α-SMA)、TGF-β1、Ⅰ型胶原的检测, 采用免疫组织化学法按说明书操作. 镜下观察组织切片, 每张切片选取四周及中央区域, 于200倍光镜下测阳性着色面积百分比 = 阳性着色面积/肝组织面积×100%, 取平均值. 大鼠肝脏HYP的测定采用羟脯氨酸测试盒, 精确称取肝组织湿质量30-100 mg放入试管中, 准确加水解液1 mL, 加盖后沸水浴水解20 min, 冷却后加指示剂并加入调pH液, 直至pH值在6.0-6.8左右, 然后加入蒸馏水至10 mL, 取3-4 mL稀释的水解液加适量活性炭混匀离心后取上清1 mL作比色. 羟脯氨酸含量(mg/g湿质量) = (测定管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度)×标准管含量(5 mg/L)×水解液总体积(10 mL)/组织湿质量(mg). 石蜡切片常规HE染色后, 按文献方法采用肝纤维化病理学分期[16]. 肝组织胶原纤维染色(Masson)法, 结果经图像分析仪分析. 每张切片选取四周和中央区域, 取胶原纤维最多的视野, 每个视野包括汇管区, 200倍镜下测定胶原纤维面积百分比 = 胶原纤维面积/肝组织面积×100%, 取平均值.
统计学处理 计量资料以(mean±SD)表示, 纤维化程度以等级资料表示. 计量资料采用SPSS13.0软件进行单因素方差分析, 计数资料采用SPSS13.0软件进行非参数分析, 以P<0.05为统计学有显著性差异.
正常组HE染色显示肝细胞以中央静脉为中心向周围呈放射状排列, 结构完整, 无变性、坏死及炎性细胞浸润. 模型组HE染色显示肝索排列紊乱, 肝细胞呈弥漫性脂肪变性、空泡形成, 门管区及肝小叶内可见明显的灶性淋巴细胞浸润, 纤维组织增生明显, 部分区域形成纤维间隔, 形成假小叶. Masson染色可见胶原纤维增生明显. 治疗组汇管区见肝小叶结构部分恢复, 炎性细胞浸润少, 纤维细小, 假小叶部分模糊, 细胞水肿及变性坏死情况明显改善, 胶原纤维沉积均明显减少. 而对照组镜下仍见有较多的胶原纤维沉积, 肝细胞变性及炎性细胞浸润也较明显. 汇管区及中央静脉周围胶原纤维组织增生较模型组明显减少, 呈局限性, 假小叶部分消失. 模型组与治疗组、对照组之间肝纤维化分级有明显差异, 胶原纤维面积比比较也有显著意义(总体F = 159.94, 方差齐性, P<0.01, 表1, 图1).
本次实验测得的大鼠肝功能ALT, AST, ALB总体F值分别为14.585, 10.249, 19.128, P值均<0.01, 方差齐性. 两两比较分析, 正常组大鼠肝功能ALT, AST, ALB与模型组比较均有显著性差异(P<0.01), 但模型组与治疗组比较(P值分别为0.195, 0.530, 0.019), 除了ALB外均无显著性差异, 分析肝功能的变化可能除了与肝脏本身的炎症程度有关, 可能还与本身健康状况有关; HYP是胶原蛋白所特有的氨基酸, 测定HYP含量可明确胶原总体水平, 评定纤维化病变程度. 本次实验测得的HYP总体F值为9.786, P<0.01. 模型组大鼠肝组织HYP的含量与正常组和治疗组比较均有显著性差异(P<0.01), 与对照组比较也有显著性差异(P = 0.015).
本次实验测得的大鼠α-SMA, TGF-β1, Ⅰ型胶原免疫组化结果分析, 总体F值分别为46.97, 88.48, 76.45, P值均<0.01, 方差齐性.
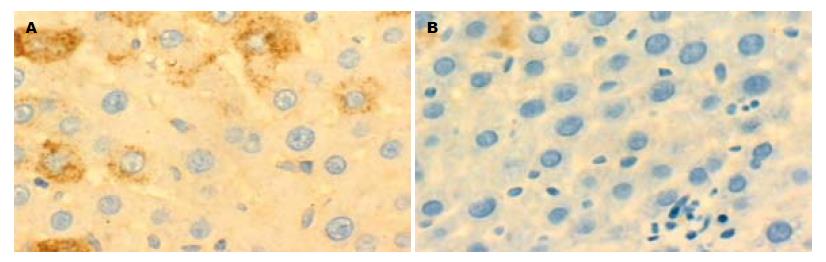
2.3.1 肝组织中Ⅰ型胶原的表达: 正常组大鼠中Ⅰ型胶原主要分布于汇管区的结缔组织、血管壁及胆管壁, 在肝实质内沿肝窦壁形成的丝状着色. 模型组中, Ⅰ型胶原主要分布于中央静脉周围及纤维组织增生的汇管区, 形成宽而粗大的纤维条索, 免疫组化染色呈强阳性. 对照组Ⅰ型胶原的分布部位与M组基本一致, 表达相对减少. 治疗组Ⅰ型胶原仅见于中央静脉周围及汇管区, 着色减少且浅, 呈细丝状(图2). 统计分析, 总体方差齐性F = 76.45, P<0.01; 两两比较分析: 模型组与正常组、对照组、治疗组比较均有显著性差异(P<0.01), 对照组与治疗组比较也有显著性差异(P = 0.002).
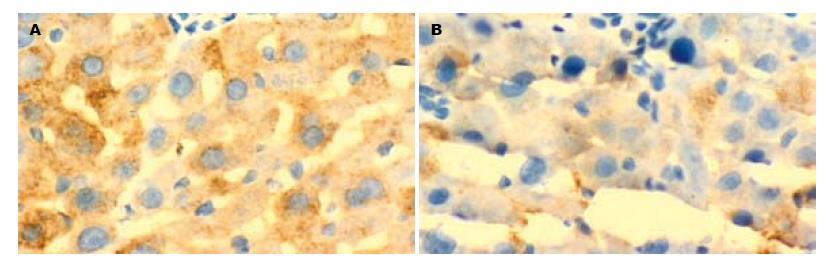
2.3.2 肝组织中TGF-β1的表达: 正常组TGF-β1未见明显表达; 模型组TGF-β1在汇管区和纤维隔中染色明显加深, 主要见于Kupffer细胞、肝星状细胞和炎性细胞质中, 呈染色较深的棕黄色; 治疗组在纤维隔内间质细胞和炎细胞胞质阳性染色程度减轻, 阳性细胞数目减少, 与模型组比较P<0.01; 对照组与模型组相比, TGF-β1表达的显色指数无显著性差异(图3). 统计分析, 总体方差齐性F = 88.48, P<0.01; 两两比较分析: 模型组与正常组、对照组、治疗组比较均有显著性差异(P<0.01), 对照组与治疗组比较也有显著性差异(P = 0.02).
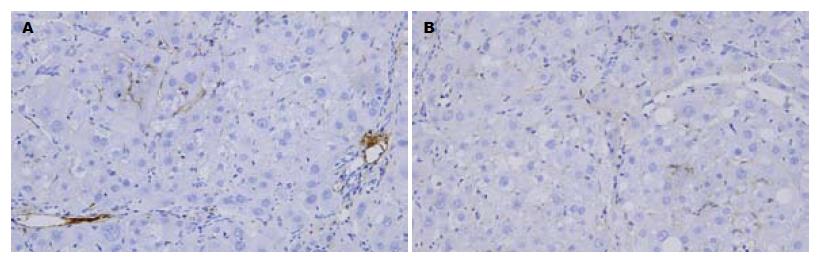
2.3.3 肝组织中α-SMA的表达: 正常组可见血管壁少量α-SMA阳性表达; 模型组α-SMA阳性表达细胞数明显增多, 胞质呈棕黄色, 有的细胞有2-3个较长突起, 主要分布于门静脉、汇管区、纤维间隔和邻近的肝窦, 在炎性细胞浸润区的表达也明显增加, 并且在靠近纤维间隔的肝血窦表现为带有长突起的索形细胞(HSC)也为阳性; 治疗组汇管区、纤维间隔和邻近的肝窦阳性细胞数目显著减少, 胞质阳性染色显著减轻, 与模型组比较差异显著(P<0.01); 对照组与模型组相比, α-SMA表达的显色指数无显著性差异(图4). 统计分析, 总体方差齐性F = 46.97, P<0.01; 两两比较分析: 模型组与正常组、对照组、治疗组比较均有显著性差异(P<0.01), 对照组与治疗组比较无显著性差异(P = 0.124).
榄香烯是由碳、氢两种元素组成的倍半萜烯类化合物, 主要成分为β-榄香烯, 其化学名为1-甲基-1-乙烯基-2, 4-二异丙基环己烷, 分子式为C15H24, 相对分子量为204, 另外还含有少量的δ-榄香烯及γ-榄香烯[17]. 药理学及临床研究证明, 榄香烯是一种疗效确切的非细胞毒性抗肿瘤药物, 其抗瘤谱广泛, 无骨髓抑制作用, 无明显的肝、肾毒性. 对多种肿瘤细胞具有抑制作用[18]. 研究显示β-榄香烯呈浓度和时间依赖性抑制人白血病细胞株K562细胞的生长和凋亡[12], 并下调癌基因Bcl-2的表达[9]; 对脑胶质瘤细胞、肝癌细胞、膀胱癌细胞均有显著抑制作用[9-11,18]. β-榄香烯除具有抗肿瘤作用外, 尚有抗氧化、调节免疫、抗血栓、降低血浆蛋白原浓度、降低全血黏度, 改善血流变学特性和扩血管等作用, 成为目前研究的热点[13-14]. β-榄香烯作为抗肝纤维化常用药物莪术的主要有效成分, 是否能抗肝纤维化一直备受关注. 本实验结果显示经腹腔注射β-榄香烯的大鼠, 由CCl4诱导的肝纤维化进程受到显著抑制, 镜下可见纤维间隔和假小叶结构部分消失, 纤维化程度分级好转, 胶原纤维面积显著缩小, 进展为肝纤维化4期的大鼠数量显著低于模型对照组, 提示β-榄香烯在体内具有抗肝纤维化作用.
肝纤维化是一种可逆性的以细胞外基质沉积为特征的损伤修复反应[1-2]. 在急性肝损伤的修复过程中, 实质细胞再生并取代坏死或凋亡的细胞, 这一过程表现为炎症反应和局部的细胞外基质沉积. 如果肝损伤持续存在, 则肝细胞再生功能丧失, 被大量的ECM取代, 并诱导胶原纤维生成. ECM的过度沉积, 进一步可导致肝内血流阻力的增加及假小叶的形成, 进而发展为门脉高压、肝硬化, 并可能发展成肝癌, 因此抑制ECM的过度沉积是抗肝纤维化的重要途径[3-4]. ECM主要由胶原蛋白构成, 肝脏胶原蛋白有Ⅰ, Ⅲ, Ⅳ, Ⅴ, Ⅵ型, Ⅰ, Ⅲ型胶原占肝内胶原含量的80%左右, 主要分布在汇管区[19-21]. 肝纤维化时, Ⅰ, Ⅲ型胶原增多, 尤以Ⅰ型胶原增多为主, 占肝硬化组织中增加的总胶原含量的70%-80%, 是肝纤维化晚期及肝硬化的重要标志[21]. HYP是胶原中的特征性氨基酸, 是评估胶原蛋白含量和肝纤维化程度的指标, 测定肝组织中HYP含量能客观反应肝纤维化程度[22]. 本实验发现β-榄香烯能显著抑制Ⅰ型胶原在肝脏的沉积, 降低肝组织中HYP的含量, 提示β-榄香烯具有减少ECM在肝脏沉积的作用. 但究竟是通过抑制胶原的合成还是促进胶原的降解达到上述作用的尚有待进一步研究.
研究表明肝星状细胞是ECM的主要来源[1-3]. 肝脏损伤后, HSC则激活成为肌成纤维样细胞(myofibroblast-like cel1)-活化型[2]. 此时HSC大量增生、胞体增生、Vit A脂滴消失、胶原纤维等细胞外基质分泌增多、表达具有收缩功能的α-平滑肌肌动蛋白(a-smooth muscle actin, α-SMA), 其中α-SMA的表达为HSC激活的标志[1-4]. TGF-β1是目前已知的最强的致肝纤维化细胞因子之一[2], 具有启动和调控肝脏ECM代谢的重要作用, 研究表明TFG-b1主要通过自分泌机制调节ECM的沉积, 在肝脏其靶细胞主要为肝星状细胞, HSC本身可自分泌TGF-β1. 肝纤维化时, TGF-β1一方面促进ECM合成, 抑制ECM降解; 另一方面激活HSC转化为肌成纤维细胞(MFB), MFB再通过旁分泌和自分泌作用促进大量以胶原为主的ECM合成[3]. 因此抑制ECM过度沉积的关键是抑制HSC的活化增殖. 前期体外实验结果显示随β-榄香烯作用剂量的增加和作用时间的延长, 肝星状细胞增殖能力显著下降, 而凋亡率明显上升[15]; 本实验进一步显示β-榄香烯可抑制肝纤维化组织中肝星状细胞活化的标记α-SMA的表达和降低TGF-β1的表达, 表明β-榄香烯可通过抑制HSC活化增殖、诱导凋亡, 抑制TGF-β1的分泌合成, 从而减少ECM的来源, 使肝脏中ECM的沉积降低, 发挥抗肝纤维化的作用.
本实验结果尚发现β-榄香烯在改善肝脏酶学方面与模型及对照组比较并没有显著意义, 这可能与腹腔给药途径或大鼠的生活状况有关, 是否也提示β-榄香烯抗肝纤维化的作用与降酶作用无相关性? 尚有待我们进一步研究.
肝纤维化是多种原因引起的慢性肝损伤的共同病理改变, 以细胞外基质(ECM)在肝脏内沉积为特征, 肝星状细胞(HSC)活化和转型在肝纤维化中发挥关键作用. 因此, 抑制HSC激活以及ECM的沉积与否则是一个非常重要的靶点. 中药莪术具有活血化瘀、消积软坚作用, 体外可抑制成纤维细胞生长和促进ECM的降解, β-榄香烯是从中药莪术中提取的一种倍半萜衍生物, 具有非细胞毒性抗肿瘤、抗氧化、调节免疫、抗血栓和扩血管等作用. 前期体外实验发现其能呈剂量和时间依赖性抑制肝星状细胞增殖和诱导凋亡. 为此, 本文从体内模型探讨β-榄香烯是否具有抗肝纤维化作用.
进展性肝纤维化是可逆转的, 药物通过抑制HSC激活、诱导其凋亡及防止ECM沉积的干预性治疗在实验性肝纤维化方面已取的疗效. β-榄香烯作为抗肝纤维化常用药物莪术的主要有效成分, 是否具有抗肝纤维化作用? 本文通过其干预实验性肝纤维化大鼠的体内研究, 探讨其作用机制.
本实验通过提取莪术提取物β-榄香烯单体干预肝纤维化大鼠模型, 检测肝星状细胞活化增殖的标志α-SMA及致肝纤维化细胞因子TGF-β1, 分析了中药莪术主要成分抗纤维化的作用靶点.
本研究证实了β-榄香烯可抑制肝纤维化组织中肝星状细胞活化的标记α-SMA的表达和降低TGF-β1的表达, 表明β-榄香烯可通过抑制HSC活化增殖、诱导凋亡, 抑制TGF-β1的分泌合成, 从而减少ECM的来源, 使肝脏中ECM的沉积降低, 发挥抗肝纤维化的作用, 进一步为临床应用β-榄香烯制剂治疗肝纤维化提供了理论依据.
榄香烯: 是由碳、氢两种元素组成的倍半萜烯类化合物, 主要成分为β-榄香烯, 其化学名为1-甲基-1-乙烯基-2, 4-二异丙基环己烷, 分子式为C15H24, 相对分子量为204, 另外还含有少量的-榄香烯及γ-榄香烯.
本文研究了β-榄香烯对实验性肝纤维化大鼠TGF-β1, α-SMA, Col-Ⅰ表达的影响, 实验设计合理, 结果可信, 有一定实际应用价值.
电编: 张敏 编辑:王晓瑜
| 1. | Friedman SL. Liver fibrosis - from bench to bedside. J Hepatol. 2003;38 Suppl 1:S38-53. [PubMed] [DOI] |
| 2. | Reeves HL, Friedman SL. Activation of hepatic stellate cells-a key issue in liver fibrosis. Front Biosc. 2002;7:d808-826. [PubMed] [DOI] |
| 3. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 4. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 9. | 徐 英辉, 董 斌, 罗 其中, 周 洪语, 贾 宜昌, 杨 友峰, 王 以政. 榄香烯对大鼠胶质瘤C6细胞Bcl-2家族基因及蛋白表达的影响. 中华医学杂志. 2005;85:1700-1703. |
| 13. | 陆 群, 朱 路佳, 谢 梅林, 顾 振纶. β-榄香烯抑制大鼠血栓形成及其机理研究. 中国现代应用药学杂志. 1999;16:13-16. |
| 17. | 国家药典委员会. 中华人民共和国药典(一部). 北京: 化学工业出版社 2000; 230. |
| 19. | Arthur MJ. Fibrogenesis II. Metalloproteinases and their inhibitors in liver fibrosis. Am J Physiol Gastrointest Liver Physiol. 2000;279:G245-249. [PubMed] |
| 20. | Gabele E, Brenner DA, Rippe RA. Liver fibrosis: signals leading to the amplification of the fibrogenic hepatic stellate cell. Front Biosci. 2003;8:d69-77. [PubMed] [DOI] |