修回日期: 2007-01-20
接受日期: 2007-01-27
在线出版日期: 2007-04-08
目的: 研究在同一组织中同时提取线粒体DNA(mtDNA)和核DNA(nDNA)的方法的有效性.
方法: 同一组织中既含有mtDNA又含有nDNA, 利用试剂盒同时提取出mtDNA和nDNA, 用琼脂糖凝胶电泳, 聚合酶链反应(PCR)的方法, 对所提取的mtDNA和nDNA进检测.
结果: 用同一组织从线粒体中得到mtDNA, 从细胞核中得到nDNA. 与用传统方法分别提取mtDNA和nDNA效果一样, 并且两者相关性强, 相比较更有说服力.
结论: 同一组织中能同时提取mtDNA和nDNA, 既节省组织又节省时间和费用, 为DNA的研究提供了较好的实验方法.
引文著录: 刘宗文, 赵秋民, 赵志华, 李晟磊, 庞霞, 高冬玲, 陈奎生, 张云汉. 食管鳞癌组织中线粒体和细胞核DNA的提取和鉴定. 世界华人消化杂志 2007; 15(10): 1146-1149
Revised: January 20, 2007
Accepted: January 27, 2007
Published online: April 8, 2007
AIM: To extract mitochondrial DNA (mtDNA) and nuclear DNA (nDNA) simultaneously from the same tissues and evaluate its efficiency by comparative analysis.
METHODS: Both mtDNA and nDNA were extracted simultaneously from the same tissues using agent kit. Agarose gel electrophoresis and polymerase chain reaction were used to identify the obtained mtDNA and nDNA.
RESULTS: mtDNA and nDNA were successfully extracted from the mitochondria and nucleus of the same tissue, respectively. The efficiency of this method for extracting mtDNA and nDNA simultaneously from the same tissue was similar to that of the traditional method (extracting mtDNA and nDNA from different tissues), and there was a close relationship between these two methods.
CONCLUSION: It is timesaving and economical to extract mtDNA and nDNA simultaneously from the same tissues, which is a better way for DNA study.
- Citation: Liu ZW, Zhao QM, Zhao ZH, Li SL, Pang X, Gao DL, Chen KS, Zhang YH. Extraction and identification of mitochondrial DNA and nuclear DNA from human esophageal squamous cell carcinoma tissues. Shijie Huaren Xiaohua Zazhi 2007; 15(10): 1146-1149
- URL: https://www.wjgnet.com/1009-3079/full/v15/i10/1146.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i10.1146
近年来, 由于mtDNA突变和nDNA突变而引起人类各种疾病的研究日益深入[1], 从组织中提取mtDNA和nDNA已成为必要. 过去常用的方法是先取组织, 从中提取mtDNA, 然后再取组织提取nDNA[2-5]. 这种方法虽然能得到mtNDA和nDNA, 但是比较浪费标本, 时间较长, 该提取方法不仅增加费用, 而且过程相对复杂. 从理论上讲mtDNA存在核外胞质的线粒体内, 用一种细胞裂解工作液, 将细胞壁裂解, 从而得到线粒体和细胞核的混合液. 通过线粒体分离试剂得到线粒体的同时得到剩余的细胞核及部分剩余的完整细胞[6], 这样, 从线粒体中得到mtDNA, 而从细胞核中得到nDNA. 现介绍一种新方法, 从同一组织中同时提取mtDNA和nDNA.
62例食管癌组织取自河南省安阳市肿瘤医院2006-02-16/03-26手术切除标本, 所有病例术前均无化疗、放疗及免疫治疗史. 其中男36例, 女26例; 年龄在38-77岁之间. 62例标本均在离体0.5 h内迅速取材, 分别取无坏死癌灶、癌旁3 cm以内的癌旁组织及远端正常黏膜组织3部分, 并分别放于冻存管置于-80 ℃冰箱中备用. 剩余组织经40 g/L多聚甲醛液固定, 石蜡包埋切片, 用于常规病理诊断及免疫组织化学染色, 并经两位资深病理学专家诊断均为食管鳞状细胞癌. 肿瘤组织学类型依据WHO标准分为3级: 鳞状细胞癌Ⅰ级, 15例; 鳞状细胞癌Ⅱ级, 25例; 鳞状细胞癌Ⅲ级, 22例. 有淋巴结转移20例, 无淋巴结转移42例. 浸润深度: 浸润至浅层7例(肿瘤浸润深度在黏膜层、黏膜下层或浅肌层); 浸润至深层55例(肿瘤浸润深度在深肌层或纤维膜). 线粒体提取试剂盒, mtDNA萃取试剂盒购自上海杰美基因医药科技有限公司. 动物组织基因DNA小量制备试剂盒, 由V-GENE BIOTECHNOLOGY LIMITED提供.
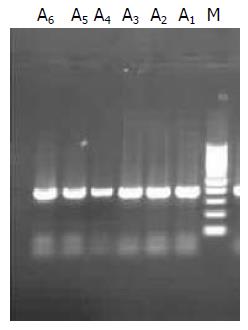
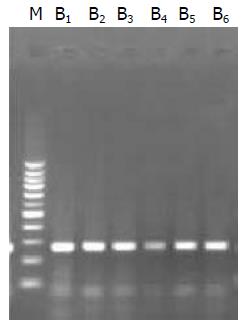
1.2.1 组织中mtDNA及nDNA的常规提取方法: (1)mtDNA的常规提取(命名为A样品). 分别取癌组织、癌旁组织及正常黏膜组织各100 mg, 置于匀浆器中, 加入Regent A清理液, 充分研磨, 后移入1.5 mL离心管内, 8000 r/min离心5 min, 之后弃上清, 具体操作步骤严格按照说明书进行; (2)nDNA的常规提取方法命名为B样品. 分别取癌组织、癌旁组织及正常黏膜组织各100 mg, 置于匀浆器中, 加入BufferG-A及RNase A1, 充分研磨, 后移入1.5 mL离心管内, 具体操作步骤严格按照说明书进行.
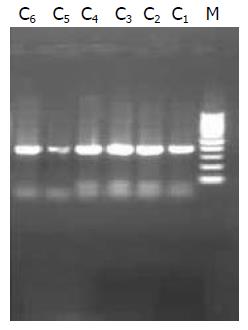
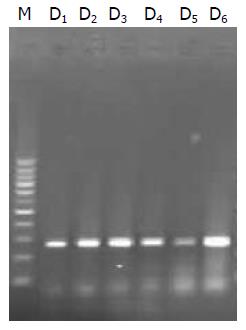
1.2.2 改良的mtDNA及nDNA提取方法: 分别取癌组织、癌旁组织及正常黏膜组织各100 mg, 置于匀浆器中, 充分研磨. 按照线粒体提取试剂盒说明书提取线粒体, 然后从线粒体中按照mtDNA萃取试剂盒提取mtDNA(命名为C样品). 另从提取线粒体后的沉淀物(残存的细胞核和未溶解的细胞)中按照DNA萃取试剂盒说明提取nDNA(命名为D样品).
1.2.3 聚合酶链反应(PCR)检测: mtDNA上游引物: 5' CACCCTAGCCATCATTCTAC 3', 下游引物: 5' GGGGTATGCTGTTCGAATTC 3', 扩增长度为403 bp. 核基因组为P53基因上游引物5' GGGCAACCAGCCCTGTCG 3', 下游引物: 5' GTGCCCTGACTTTCAACTCTG 3', 扩增长度为266 bp. 上述引物均由上海杰美基因医药科技有限公司合成. PCR扩增标准反应体系(25 μL): 反应液Reagent A 15 μL, 上游引物0.5 μL, 下游引物0.5 μL, mtDNA模板0.5 μL, 配平液8.5 μL, 配制成PCR反应体系. 扩增条件: 95 ℃ 2 min; 95 ℃ 30 s, 59 ℃ 1 min, 72 ℃ 30 s, 共40个循环; 72 ℃延伸5 min.
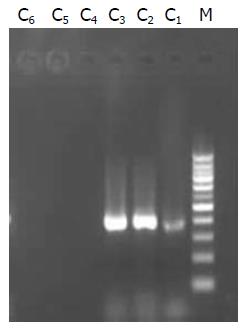
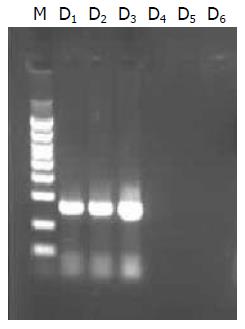
1.2.4 mtDNA和nDNA特异性检测: 进行PCR扩增时按如下分组进行. Ⅰ, Ⅱ组: 分别取A, B样品及其对应的上下游引物加入PCR反应体系中, 扩增出常规提取方法得出的产物; Ⅲ, Ⅳ组: 分别取C, D样品及其对应的上下游引物加入PCR反应体系中, 扩增出改良提取方法得出的产物; Ⅴ组: 取nDNA的引物加入至C样品中进行PCR扩增, 检验C样品的特异性; Ⅵ组: 取mtDNA的引物加入至D样品中进行PCR扩增, 检验D样品的特异性.
组织中分别获得了403 bp及266 bp大小的片段(图1, 图2).
组织中分别获得了403 bp及266 bp大小的片段(图3, 图4).
线粒体是真核细胞内的重要细胞器, 其主要功能是在内部进行生物氧化和能量转换, 除此之外, 线粒体还支持和参与了许多主要的细胞功能, 如介异代谢, 保持离子稳态、脂质、核酸和氨基酸的合成及细胞增殖和启动细胞凋亡等[7]. 而mtDNA存在于线粒体的内膜上, 暴露于由氧化磷酸化过程产生的高浓度的反应性氧簇(reactive oxygen species, ROS)中, 故mtDNA的突变易发生. 在很长一段时间人们把主要精力集中在研究肿瘤和核DNA改变的关系上, 对肿瘤细胞线粒体DNA改变关注很少, 但近年来由于证明了mtDNA特殊的结构特点, mtDNA的突变率比核DNA高10倍以上[8-10], 且与细胞凋亡[11-12]和肿瘤形成[13-15]都有密切的关系.
在一般情况下, mtDNA的衰老或损伤常被胞质中溶酶体内的DNA水解酶彻底降解. 但有时如细胞内外环境中有害因素增加时, 可使mtDNA错配片数产生和降解增加, 或大量mtDNA裂解等造成游离的mtDNA片数增多, 致使mtDNA或其片数有机会游离并可能会具有类似致癌病毒样作用, 穿过细胞核孔, 随机整合到核基因组中, 如果这种整合出现在癌基因或抑癌基因组中, 使癌基因激活或抑癌基因失活, 可诱导细胞发生癌变[13]. 因此, 探讨肿瘤发生、发展过程中mtDNA的改变(拷贝量变化, 突变、微卫星的不稳定性), 以及其对细胞核DNA改变的影响, 必将成为今后肿瘤研究的热点之一[16]. 本实验基于以上观点, 以往有不少学者对mtDNA与nDNA的提取方法, 进行了不断的改进, 但均采用两部分组织, 分别提取mtDNA和nDNA[17], 作者采用改良的方法, 在同一组织中同时提取mtDNA和nDNA, 节省组织, 缩短时间, 减少费用, 操作相对简单, 另外在同一组织中既提取mtDNA又提取nDNA, 对研究疾病的发生、发展及两者的相关性应更有说服力.
线粒体DNA是细胞内唯一的核外遗传物质, 由于其自身特殊的结构特点, 线粒体DNA的突变率比细胞核DNA高10-20倍, 而且与细胞凋亡和肿瘤形成都有密切关系. 近年来有关各类因素所致线粒体DNA数量或质量的改变与细胞癌变、肿瘤发生的相关性研究已成为热点, 随着研究的深入要求, 纯化线粒体DNA已成为必要. 而在同一组织中同时提取线粒体和细胞核DNA的报道国内外未见.
本实验用同一组织先提取细胞内线粒体DNA, 同时将剩余的细胞核中的DNA同时提出, 这样既节省材料, 又减少费用, 同时得到同一细胞中的线粒体和细胞核DNA, 相关性较强.
利用同一种组织, 同时提取线粒体和细胞核DNA, 得到较为纯化的线粒体DNA和细胞核DNA. 在将来的研究中具有很好的应用价值.
线粒体DNA(mtDNA): 存在于线粒体的内膜上, 呈双链闭环结构, 全长16569 bp, 有轻链(L链)和重链(H链)之分, 两条链均具有独立编码功能.
本文使用不同的方法提取食管癌组织内线粒体和细胞核DNA, 并经过PCR扩增后证实纯度高, 方法可靠, 简单易行, 易于推广.
编辑: 王晓瑜 电编:张敏
| 1. | Rossignol R, Faustin B, Rocher C, Malgat M, Mazat JP, Letellier T. Mitochondrial threshold effects. Biochem J. 2003;370:751-762. [PubMed] [DOI] |
| 2. | 李 伟文, 陆 松敏, 刘 建仓, 武 凡, 李 萍, 柏 干荣. 线粒体DNA提取方法的比较. 国外医学·分子生物学分册. 2003;25:191-193. |
| 4. | Zhu W, Qin W, Sauter ER. Large-scale mitochondrial DNA deletion mutations and nuclear genome instability in human breast cancer. Cancer Detect Prev. 2004;28:119-126. [PubMed] [DOI] |
| 6. | 冯 作化. 医学分子生物学. 第1版. 北京: 人民卫生出版社 2005; 157-168. |
| 7. | Singh KK, Russell J, Sigala B, Zhang Y, Williams J, Keshav KF. Mitochondrial DNA determines the cellular response to cancer therapeutic agents. Oncogene. 1999;18:6641-6646. [PubMed] [DOI] |
| 8. | Brown MD, Hosseini S, Steiner I, Wallace DC, Korn-Lubetzki I. Complete mitochondrial DNA sequence analysis in a family with early-onset dystonia and optic atrophy. Mov Disord. 2004;19:235-237. [PubMed] [DOI] |
| 9. | Liu CS, Tsai CS, Kuo CL, Chen HW, Lii CK, Ma YS, Wei YH. Oxidative stress-related alteration of the copy number of mitochondrial DNA in human leukocytes. Free Radic Res. 2003;37:1307-1317. [PubMed] [DOI] |
| 13. | Cavalli LR, Liang BC. Mutagenesis, tumorigenicity, and apoptosis: are the mitochondria involved? Mutat Res. 1998;398:19-26. [PubMed] [DOI] |
| 14. | 谭 端军, 刘 玲玲, 刘 鹏, 文 毅, Chang J, Yeh KT, Wong LJC. 食管癌线粒体DNA体细胞性突变与种系性变异. 世界华人消化杂志. 2004;12:892-896. [DOI] |
| 15. | Vega A, Salas A, Gamborino E, Sobrido MJ, Macaulay V, Carracedo A. mtDNA mutations in tumors of the central nervous system reflect the neutral evolution of mtDNA in populations. Oncogene. 2004;23:1314-1320. [PubMed] [DOI] |
| 16. | Fang DC, Fang L, Wang RQ, Yang SM. Nuclear and mitochondrial DNA microsatellite instability in hepatocellular carcinoma in Chinese. World J Gastroenterol. 2004;10:371-375. [PubMed] |