修回日期: 2007-02-09
接受日期: 2007-02-16
在线出版日期: 2007-04-08
目的: 通过观察TβRⅡ, MMP-7及TIMP-2在HNPCC和散发性大肠癌中的表达, 探讨其在HNPCC侵袭转移的生物学行为中的作用.
方法: 选取1980-05/2005-06空军总医院收治的HNPCC和散发性大肠癌各30例, 应用免疫组化SP染色法检测其肿瘤组织中TβRⅡ, MMP-7, TIMP-2的表达情况. 结合其相应临床病理资料进行分析TβRⅡ, MMP-7, TIMP-2表达在HNPCC侵袭转移中的作用.
结果: TβRⅡ, MMP-7, TIMP-2在HNPCC组的阳性表达率分别为40.0%, 46.7%, 63.3%; 而在散发性大肠癌组的阳性表达率为73.3%, 86.7%, 20.0%. 散发性大肠癌组中MMP-7(+~++)/TIMP-2(-)比例明显高于HNPCC组. 而其MMP-7(-)/TIMP-2(+~++)者则明显少于HNPCC组. TβRⅡ, MMP-7, TIMP-2的阳性表达率与肿瘤的大小和部位无关. 而与肿瘤的侵犯深度和转移与否密切相关. 侵犯浆膜外组织和有转移者的MMP-7的阳性表达率明显增高, 而TβRⅡ, TIMP-2的阳性表达率则明显降低(P<0.05). 在两组大肠癌中TβRⅡ与MMP-7呈正相关(r = 0.735, P = 0.000; r = 0.792, P = 0.000), TIMP-2与TβRⅡ(r = -0.582, P = 0.001; r = -0.394, P = 0.031)和MMP-7 (r = -0.473, P = 0.008; r = -0.388, P = 0.034)的表达均呈负相关.
结论: TβRⅡ, MMP-7, TIMP-2在散发性大肠癌和HNPCC中的表达差异显著. TβRⅡ, MMP-7在散发性大肠癌中的表达率和表达强度明显高于HNPCC, 而TIMP-2的表达结果则相反. 因此, 散发性大肠癌中MMP-7/TIMP-2的比例失衡明显高于HNPCC组.
引文著录: 顾国利, 魏学明, 任力, 王石林, 胡益云, 李德昌. TβRⅡ, MMP-7, TIMP-2表达及在HNPCC侵袭转移中的作用. 世界华人消化杂志 2007; 15(10): 1103-1109
Revised: February 9, 2007
Accepted: February 16, 2007
Published online: April 8, 2007
AIM: To investigate the roles of transforming growth factor β receptor Type Ⅱ (TβRⅡ), matrix metalloproteinase-7 (MMP-7) and tissue inhibitor of metalloproteinase-2 (TIMP-2) expression in the invasion and metastasis of human hereditary nonpolyposis colorectal cancer (HNPCC).
METHODS: Immunohistochemical staining was used to detect the expressions of TβRⅡ, MMP-7 and TIMP-2 protein in 30 cases of sporadic colorectal cancer (sporadic CRC) and 30 cases of HNPCC, and their corresponding clinical data were analyzed retrospectively.
RESULTS: The positive rates of TβRⅡ, MMP-7 and TIMP-2 expression in HNPCC were 40.0%, 46.7% and 63.3% respectively, while in sporadic CRC, the rates were 73.3%, 86.7% and 20.0% respectively. The ratio of MMP-7(+~++) to TIMP-2(-) in sporadic CRC was higher while that of MMP-7(-) to TIMP-2(+~++) was lower significantly than that in HNPCC. TβRⅡ, MMP-7 and TIMP-2 expression were closely related to the depth of invasion and lymph node metastasis, but not to the sex of patients, tumor size and position. The positive rate of MMP-7 expression was significantly increased in tissues with extra-chorion invasion and metastasis, but the expression of TβRⅡ and TIMP-2 were markedly decreased (P < 0.05). In HNPCC and sporadic CRC, positive correlation was found between TβRⅡ and MMP-7 expression (r = 0.735, P = 0.000; r = 0.792, P = 0.000), while negative correlation existed between TIMP-2 and TβRⅡ expression (r = -0.582, P = 0.001; r = -0.394, P = 0.031) as well as between TIMP-2 and MMP-7 expression (r = -0.473, P = 0.008; r = -0.388, P = 0.034).
CONCLUSION: TβRⅡ, MMP-7 and TIMP-2 are differently expressed in HNPCC and sporadic CRC. The expression rates and intensities of TβRⅡ and MMP-7 are obviously higher in sporadic CRC than those in HNPCC, while the positive expression of TIMP-2 was a reverse situation. So the imbalance of MMP-7/TIMP-2 is increased in sporadic CRC. Down-regulated expression of MMP-7, TβRⅡ and up-regulated expression of TIMP-2 may play important roles in the invasion and metastasis of HNPCC.
- Citation: Gu GL, Wei XM, Ren L, Wang SL, Hu YY, Li DC. Expression of transforming growth factor β receptor Type Ⅱ, matrix metalloproteinase-7 and tissue inhibitor of metalloproteinase-2 and their roles in the invasion and metastasis of hereditary nonpolyposis colorectal cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(10): 1103-1109
- URL: https://www.wjgnet.com/1009-3079/full/v15/i10/1103.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i10.1103
作为大肠癌的一个重要的临床亚型, 遗传性非息肉病性大肠癌(HNPCC)因其具有特殊的遗传病因和临床病理特点而受到了人们的广泛关注, 并成为大肠癌研究的一个热点[1-3]. 研究发现HNPCC虽然具有发病年龄早、病理分化类型差、多原发癌多见的特点, 但其预后却明显好于散发性大肠癌[4-5]. 原因[6]: 在获得诊断时HNPCC比散发性大肠癌的侵袭更弱、转移更少. 诸多因素参与大肠癌的侵袭、转移, 其中肿瘤旁分泌和/或自分泌的转化生长因子β1(TGF-β1)和基质金属蛋白酶(MMP)及其组织抑制因子(TIMP)是其中最重要的因素之一. TGF-β1需借助肿瘤细胞膜上的Ⅱ型受体(TβRⅡ)参与诱导肿瘤的生长分化, 继而影响侵袭转移. MMP参与分解基底膜和细胞外基质从而造成肿瘤的侵袭转移, 而TIMP则是其特异性的抑制物. 肿瘤组织中TβRⅡ的活性以及MMP/TIMP间的平衡关系分别决定着TGF-β1和MMP的活性. 一旦TβRⅡ失活和MMP/TIMP关系失衡, 就将影响肿瘤的侵袭转移. 研究发现[6-9]: TβRⅡ, MMP-7和TIMP-2的活性与大肠癌的浸润、转移密切相关. 我们采用免疫组化SP染色法检测TβRⅡ, MMP-7, TIMP-2在HNPCC和散发性大肠癌中的表达, 探讨其与HNPCC生物学行为之间的关系.
选取1980-05/2005-06空军总医院收治的30例HNPCC病例组成试验组, 全部病例均符合AmsterdamⅡ标准[10], 即: (1)家族中至少有3例经组织学证实的HNPCC相关肿瘤(包括大肠癌、子宫内膜癌、小肠癌、肾盂输尿管癌)患者, 其中1例是另外2例的一级亲属, 除外家族性腺瘤病(FAP); (2)大肠癌累及连续的两代人; (3)至少1例患者在50岁前获得诊断. 随机选取同期我院收治的年龄≥60岁的、没有家族遗传倾向和多原发癌的散发性大肠癌病例30例组成对照组. 试验组: 男23例, 女7例; 年龄18-68(中位年龄46.0±10.6)岁. 肿瘤部位: 右半结肠18例, 左半结肠3例, 直肠9例. Dukes分期: A期2例, B期19例, C期7例, D期2例. 对照组: 男20例, 女10例, 年龄60-89(中位年龄70.3±7.2)岁. 肿瘤部位: 右半结肠14例, 左半结肠5例, 直肠癌11例. Dukes分期: A期1例, B期11例, C期15例, D期3例.
选取上述两组病例的大肠癌组织石蜡块切片. 采用免疫组化SP法染色, 按说明书操作. 4 mm切片, 脱蜡至水, 30 mL/L H2O2孵育10 min, 蒸馏水冲洗, PBS浸泡5 min, TIMP-2和TβRⅡ组以pH8.0的EDTA缓冲液修复5 min, MMP-7组不需修复. 滴加正常血清工作液, 孵育10 min后倾去, 不洗; 滴加一抗37 ℃孵育2 h, PBS冲洗3 min×3次. 滴加二抗, 孵育15 min, PBS冲洗3 min×3次. 滴加三抗, 孵育15 min, PBS冲洗3 min×3次, DAB显色, 苏木素复染, 脱水, 透明, 封片. PBS代替一抗作阴性对照, 已知阳性切片作阳性对照. 兔抗人TβRⅡ多克隆抗体(编号sc-400, 稀释度1:100)购自美国Santa Cruz Biotechnology公司. MMP-7鼠抗人mAb(克隆系1D2, 编号ZM-0334)、TIMP-2鼠抗人mAb(克隆系3A4, 编号ZM-0431)工作液、SP试剂盒、DAB显色试剂盒均购自北京中杉金桥生物公司. 试验由自动染色仪系统(福建迈新公司LAB vision Autostainer360)程控完成、镜下图像由Olympus Dp70图像采集分析仪采集、分析. 以上设备由空军总医院病理科提供.
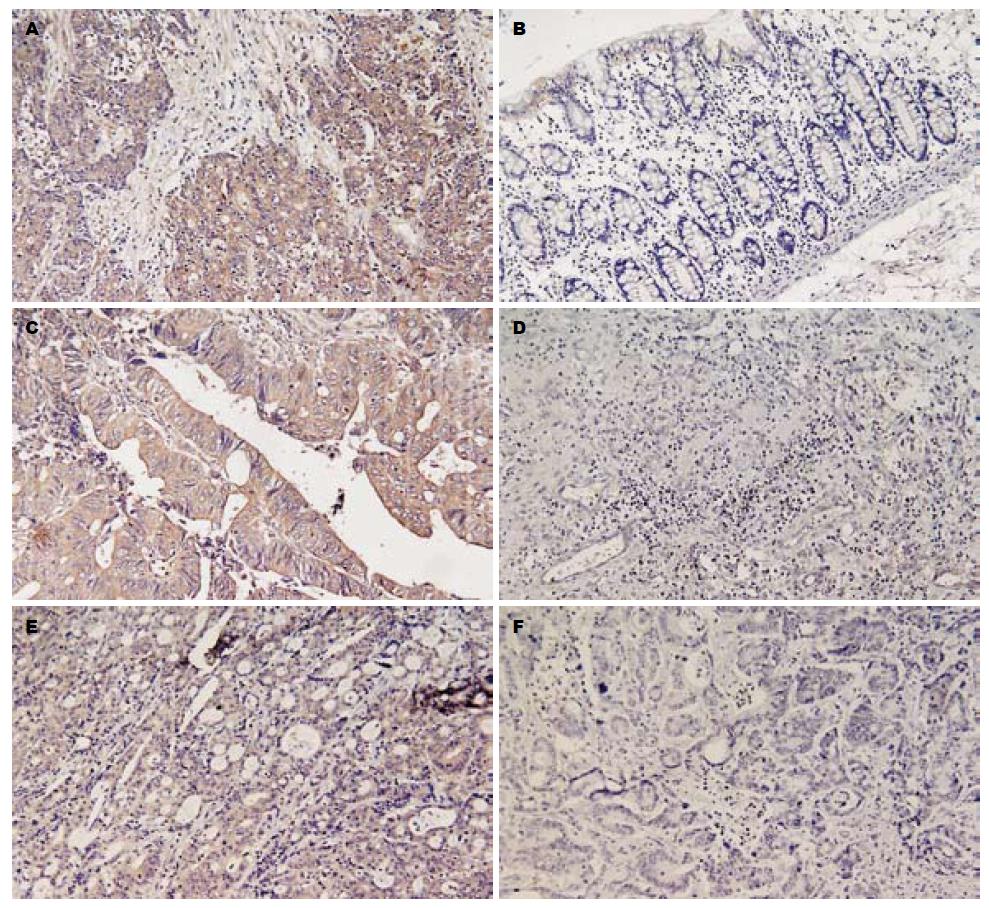
TβRⅡ, MMP-7, TIMP-2均定位于肿瘤细胞的胞质, 部分胞膜着色; 肿瘤间质轻度着色. 依据染色强度和阳性细胞率来计算评分. 染色强度: 0为无染色; 1为染色弱; 2为中等染色强度; 3为染色强. 阳性细胞率: 0为<5%, 1为<25%, 2为<50%, 3为<75%, 4为≥75%. 以染色强度与阳性细胞率之和计算评分, 0-2分为阴性(-), 3-5分为阳性(+), 6-7分为强阳性(++). 评分过程由两名高年资病理科医生独立完成.
统计学处理 应用SPSS13.0统计软件进行统计分析. 数据用mean±SD表示, 计数资料采用多个样本率(或构成比)的比较(即: R×C表的χ2检验), 免疫组化积分采用Spearman等级相关分析, 检验水准P<0.05.
TβRⅡ, MMP-7, TIMP-2三者均主要表达在大肠癌肿瘤细胞的细胞质, 镜下可见肿瘤细胞胞质内出现棕黄色颗粒(图1A, C, E), 部分细胞膜染色, 肿瘤间质不染色或浅染. TβRⅡ, MMP-7的染色强度高于TIMP-2在肿瘤中的表达. TβRⅡ, MMP-7, TIMP-2在HNPCC中的阳性表达率依次为40.0%, 46.7%和63.3%(强阳性表达率为13.3%, 10.0%和13.3%). 而在散发性大肠癌中的阳性率依次为73.3%, 86.7%和20.0%(强阳性表达率为26.7%, 33.3%和0%). 统计学差异显著(表1).
TβRⅡ, MMP-7, TIMP-2的阳性表达率与患者的性别、肿瘤的大小和部位、肿瘤分化类型均无明显关系(P>0.05), 而与肿瘤的侵犯深度和转移与否密切相关. 即: TβRⅡ, MMP-7, TIMP-2的表达与大肠癌患者的Dukes分期密切相关. MMP-7在Dukes C, D期肿瘤的阳性表达率明显高于Dukes A, B期(P<0.05). 而TβRⅡ, TIMP-2在Dukes A, B期肿瘤中的阳性率明显高于Dukes C, D期(P<0.05). 在Dukes A, B, C期病例中, HNPCC组中MMP-7的阳性表达率明显低于散发性大肠癌组(P<0.05), 而其TβRⅡ, TIMP-2的阳性表达率明显高于散发性大肠癌组(P<0.05). 在Dukes B, C, D期病例中, TβRⅡ, TIMP-2在HNPCC中的表达阳性率高于散发性大肠癌组(P<0.05), 而其MMP-7的阳性表达率则低于散发性大肠癌(P<0.05, 表2).
两组大肠癌中TβRⅡ与MMP-7的表达均呈正相关, 而TIMP-2与TβRⅡ, MMP-7的表达均呈负相关, 统计学差异显著. HNPCC组中TβRⅡ与MMP-7的相关系数为0.735(P = 0.000); TIMP-2与TβRⅡ的相关系数为-0.582(P = 0.001); TIMP-2与MMP-7的相关系数为-0.473(P = 0.008). 而散发性大肠癌组中TβRⅡ与MMP-7的相关系数为0.792(P = 0.000); TIMP-2与TβRⅡ的相关系数为-0.394(P = 0.031); TIMP-2与MMP-7的相关系数为-0.388(P = 0.034). HNPCC中MMP-7(+~++)/TIMP-2(-)者有10例(33.3%); MMP-7(-)/TIMP-2(+~++)者有15例(50.0%). 而散发性大肠癌组中MMP-7(+~++)/TIMP-2(-)者有22例(73.3%); MMP-7(-)/TIMP-2(+~++)表达者2例(6.7%). 两组中MMP-7(+~++)/TIMP-2(-), MMP-7(-)/TIMP-2(+~++)病例差异显著(P<0.01, 表3).
| 分组 | TβRⅡ表达 | MMP-7表达 | ||||||
| (++) | (+) | (-) | (++) | (+) | (-) | |||
| HNPCC组 | MMP-7 | (++) | 1 | 2 | 0 | |||
| (+) | 3 | 2 | 6 | |||||
| (-) | 0 | 4 | 12 | |||||
| TIMP-2 | (++) | 0 | 0 | 4 | 0 | 3 | 1 | |
| (+) | 0 | 4 | 11 | 0 | 1 | 14 | ||
| (-) | 4 | 4 | 3 | 3 | 7 | 1 | ||
| 散发性大肠癌组 | MMP-7 | (++) | 7 | 3 | 0 | |||
| (+) | 1 | 11 | 4 | |||||
| (-) | 0 | 0 | 4 | |||||
| TIMP-2 | (++) | 0 | 0 | 0 | 0 | 0 | 0 | |
| (+) | 2 | 2 | 2 | 3 | 1 | 2 | ||
| (-) | 6 | 12 | 6 | 7 | 15 | 2 | ||
HNPCC又称Lynch综合征, 是一种由人类错配修复基因(MMR)种系突变引起的常染色体显性遗传病[11-13], 约占全部大肠癌的5%. 因其分子生物学病因特殊、临床病理特点突出而成为目前大肠癌研究的热点. 研究发现[2,6]: HNPCC的生物学行为与散发性大肠癌截然不同. 与后者相比, HNPCC的发病年龄早、病理分化类型差、多原发癌多见, 但其预后却明显好于散发性大肠癌. 原因[6]: 与散发性大肠癌相比, HNPCC在获得诊断时的侵袭更弱、转移更少. 在大肠癌侵袭转移的复杂过程中, TGF-β1, MMP-7和TIMP-2起着非常重要的作用. TGF-β在肿瘤的生长分化、侵袭转移过程中是一把双刃剑[14], 其对早期肿瘤细胞有抑制作用, 但对进展期肿瘤则起到促进作用[15]. 其与肿瘤细胞膜上TβRⅡ结合是TGF-β/Smad信息通路的启动环节[16], TβRⅡ的突变失活将直接影响TGF-β/Smad通路的启动以及TGF-β对早期肿瘤细胞的抑制作用. MMP家族及其抑制物TIMP在大肠癌的侵袭转移过程中也起着非常重要的作用[17-18]. MMP-7在MMP家族中分子量最小, 而且是唯一在肿瘤细胞及其邻近血管的内皮细胞中表达、而不在肿瘤间质表达的MMP; 因其分子结构中缺乏与TIMP相互作用的C末端区域, 使MMP-7具有强大的基质降解功能和广泛的底物特异性(包括Ⅳ型胶原、层黏连蛋白、纤维结合素、蛋白多糖、Ⅰ型明胶、可溶性弹性蛋白、MMP-1、MMP-9、TNF-α等), 同时受TIMP的负调节作用较小. 因此, 在大肠癌的侵袭转移过程中MMP-7的作用比其他MMP成员更重要[17-18]. TIMP-2作为MMP家族的特异性抑制剂, 可抑制血管内皮细胞迁移、肿瘤生长和血管生成, 并可造成现有血管的坏死[19]. MMP-7/TIMP-2的产生与激活的失平衡是导致大肠癌侵袭转移的关键. 其比例的失衡较单纯的MMP-7或TIMP-2水平的变化意义更大[3-5].
研究发现[20]: TβRⅡ是MMR的一个靶基因. MMR基因的突变在引起HNPCC发病的同时也带来TβRⅡ的突变失活. 本研究显示HNPCC组中TβRⅡ的表达率仅为40.0%, 明显少于散发性大肠癌(73.3%), 这与报道一致. TβRⅡ的突变失活将导致TGF-β1对肿瘤细胞的作用减弱. 缺乏了TGF-β1对早期肿瘤的抑制作用可能是HNPCC表现出发病年纪早、病理分化差、多原发癌多见的一个原因. 研究显示[21-24]: MMP-7是Wnt/β-catenin信息通路的靶基因. TGF-β/Smad和Wnt/β-catenin两个信息通路间是相互联系的[25-28]. TGF-β1可通过Smad7的介导来诱导MMP-7的表达, 并下调TIMP-2的表达[25-30]. 因此, 伴发大量TβRⅡ突变失活的HNPCC肿瘤细胞对TGF-β1的反应减弱的同时, 也将使TGF-β1诱导肿瘤细胞MMP-7表达减弱并上调TIMP-2的表达. 这可能是HNPCC中MMP-7表达减少、TIMP-2表达增多的原因, 而上述MMP-7/TIMP-2变化的结果将影响肿瘤的侵袭转移. 这可能是HNPCC在获得诊断时侵袭弱、转移少的一个原因. 本研究显示: TβRⅡ, MMP-7在散发性大肠癌中的表达率和表达强度明显高于HNPCC, 而TIMP-2的表达则相反, 且三者的表达有相关性. 因此, 散发性大肠癌中MMP-7/TIMP-2的比例失衡明显高于HNPCC组, 而其原因可能于HNPCC中存在的大量TβRⅡ的突变失活有关. 这有待继续探索.
总之, 我们的研究提示: HNPCC中TβRⅡ的表达和MMP-7/TIMP-2的比例失衡明显少于散发性大肠癌, 这可能是导致HNPCC在获得诊断时侵袭弱、转移少并最终导致其预后好的一个原因. 其更深层次的原因可能与MMR突变在引起HNPCC发病的同时也导致TβRⅡ突变失活有关. TβRⅡ失活将使细胞逃逸TGF-β1对早期肿瘤的抑制作用, 从而促进肿瘤的进展; 但同时也使TGF-β1诱导肿瘤中MMP-7表达的能力减弱并上调TIMP的表达.
TGF, MMP, TIMP和HNPCC均是胃肠肿瘤学的研究热点. TGF-β/Smad信息通路与肿瘤的生长分化、侵袭转移密切相关. MMP通过参与降解细胞外基质(ECM)而在肿瘤的侵袭转移过程中扮演着重要角色, 而TIMP则是其特异性的抑制剂. MMP/TIMP比例的失衡将影响肿瘤的侵袭、转移. 研究发现TGF-β, MMP-7和TIMP-2与大肠癌的侵袭转移密切相关. 但研究其在HNPCC中作用的文章却鲜有报道.HNPCC预后比散发性大肠癌好的原因就在于其在获得诊断时的侵袭更弱、转移更少.
大肠癌可分为5个临床亚型(散发性大肠癌、家族性大肠癌、FAP恶变、HNPCC、大肠IBD恶变), 目前虽有TGF-β/Smad信息通路、MMP, TIMP在大肠癌中作用的研究报道, 但多是将各亚型混在一起处理. 而大肠癌不同临床亚型之间生物学行为可以截然不同, 其中可能存在着TGF-β/Smad信息通路蛋白、MMP、TIMP表达的差异. 目前HNPCC的研究集中在基因和临床两端, 研究蛋白水平这个中间环节的报道很少, 本文应用免疫组化方法对TβRⅡ, MMP-7, TIMP-2在HNPCC和散发性大肠癌组织的表达进行了研究, 分析其表达与临床病理的关系及其表达的相关性和意义, 初步探讨TGF-β/Smad信息通路、MMP-7/TIMP-2在HNPCC侵袭转移中可能的作用机制, 希望为以后深入研究打下基础.
本研究的结果显示TβRⅡ, MMP-7/TIMP-2与肿瘤的侵袭转移密切相关, 因此, TβRⅡ, MMP-7/TIMP-2的检测有可能成为判断肿瘤侵袭能力及预后的一个指标. 目前MMP的化学合成的抑制剂已开始在临床用于肿瘤的治疗, 本研究为新药物的应用提供了一些理论借鉴依据.
遗传性非息肉病性大肠癌(HNPCC): 是一种由错配修复基因(MMR)的种系突变而引起的常染色体显性遗传病, 约占全部大肠癌的5%, 其临床诊断标准目前采用AmsterdamⅡ标准, 即: (1)家系中至少有3例HNPCC相关肿瘤(包括大肠癌、子宫内膜癌、小肠癌、输尿管或肾盂癌等)患者; (2)大肠癌至少连续2代发病; (3)至少1例在50岁之前被诊断.
本文应用免疫组化法检测了HNPCC和散发性大肠癌中TβRⅡ, MMP-7, TIMP-2的表达情况, 发现他们在散发性大肠癌和HNPCC中的表达差异显著, 认为这可能是造成HNPCC较散发性大肠癌侵袭弱、转移少以及预后较好的原因. 该论文在检测指标的选择上具有一定的新意, 文献综述比较全面, 分析较合理.
编辑: 张焕兰 电编:张敏
| 1. | Jass JR. Hereditary Non-Polyposis Colorectal Cancer: the rise and fall of a confusing term. World J Gastroenterol. 2006;12:4943-4950. [PubMed] [DOI] |
| 4. | Colombino M, Cossu A, Manca A, Dedola MF, Giordano M, Scintu F, Curci A, Avallone A, Comella G, Amoruso M. Prevalence and prognostic role of microsatellite instability in patients with rectal carcinoma. Ann Oncol. 2002;13:1447-1453. [PubMed] [DOI] |
| 5. | 盛 剑秋, 李 世荣, 杨 欣艳, 张 英辉, 苏 惠, 余 东亮, 闫 伟, 耿 洪刚. 遗传性非息肉病性大肠癌和家族性腺瘤性息肉病腺瘤的预防性干预治疗. 中华医学杂志. 2006;86:526-529. |
| 6. | Behrens P, Mathiak M, Mangold E, Kirdorf S, Wellmann A, Fogt F, Rothe M, Florin A, Wernert N. Stromal expression of invasion-promoting, matrix-degrading proteases MMP-1 and -9 and the Ets 1 transcription factor in HNPCC carcinomas and sporadic colorectal cancers. Int J Cancer. 2003;107:183-188. [PubMed] [DOI] |
| 7. | Morán A, Iniesta P, García-Aranda C, De Juan C, Díaz-López A, Sánchez-Pernaute A, Torres AJ, Díaz-Rubio E, Balibrea JL, Benito M. Clinical relevance of MMP-9, MMP-2, TIMP-1 and TIMP-2 in colorectal cancer. Oncol Rep. 2005;13:115-120. [PubMed] [DOI] |
| 8. | Ii M, Yamamoto H, Adachi Y, Maruyama Y, Shinomura Y. Role of matrix metalloproteinase-7 (matrilysin) in human cancer invasion, apoptosis, growth, and angiogenesis. Exp Biol Med (Maywood). 2006;231:20-27. [PubMed] |
| 10. | Lenz HJ. First Amsterdam, then Bethesda, now Melbourne? J Clin Oncol. 2005;23:6445-6449. [PubMed] [DOI] |
| 11. | Chialina SG, Fornes C, Landi C, de la Vega Elena CD, Nicolorich MV, Dourisboure RJ, Solano A, Solis EA. Microsatellite instability analysis in hereditary non-polyposis colon cancer using the Bethesda consensus panel of microsatellite markers in the absence of proband normal tissue. BMC Med Genet. 2006;7:5. [PubMed] [DOI] |
| 12. | Liu WZ, Jin F, Zhang ZH, Wang SB. Role of detection of microsatellite instability in Chinese with hereditary nonpolyposis colorectal cancer or ordinary hereditary colorectal cancer. World J Gastroenterol. 2006;12:4745-4749. [PubMed] [DOI] |
| 14. | Akhurst RJ, Derynck R. TGF-beta signaling in cancer--a double-edged sword. Trends Cell Biol. 2001;11:S44-S51. [PubMed] |
| 15. | Xiong B, Gong LL, Zhang F, Hu MB, Yuan HY. TGF beta1 expression and angiogenesis in colorectal cancer tissue. World J Gastroenterol. 2002;8:496-498. [PubMed] [DOI] |
| 16. | Shin KH, Park YJ, Park JG. Mutational analysis of the transforming growth factor beta receptor type II gene in hereditary nonpolyposis colorectal cancer and early-onset colorectal cancer patients. Clin Cancer Res. 2000;6:536-540. [PubMed] |
| 17. | Heslin MJ, Yan J, Johnson MR, Weiss H, Diasio RB, Urist MM. Role of matrix metalloproteinases in colorectal carcinogenesis. Ann Surg. 2001;233:786-792. [PubMed] [DOI] |
| 18. | Rundhaug JE. Matrix metalloproteinases and angiogenesis. J Cell Mol Med. 2005;9:267-285. [PubMed] [DOI] |
| 19. | Li BH, Zhao P, Liu SZ, Yu YM, Han M, Wen JK. Matrix metalloproteinase-2 and tissue inhibitor of metallo-proteinase-2 in colorectal carcinoma invasion and metastasis. World J Gastroenterol. 2005;11:3046-3050. [PubMed] [DOI] |
| 20. | Bian Y, Caldes T, Wijnen J, Franken P, Vasen H, Kaklamani V, Nafa K, Peterlongo P, Ellis N, Baron JA. TGFBR1*6A may contribute to hereditary colorectal cancer. J Clin Oncol. 2005;23:3074-3078. [PubMed] [DOI] |
| 21. | Brabletz T, Jung A, Dag S, Hlubek F, Kirchner T. beta-catenin regulates the expression of the matrix metalloproteinase-7 in human colorectal cancer. Am J Pathol. 1999;155:1033-1038. [PubMed] [DOI] |
| 22. | Behrens J, Lustig B. The Wnt connection to tumorigenesis. Int J Dev Biol. 2004;48:477-487. [PubMed] [DOI] |
| 23. | Wong NA, Pignatelli M. Beta-catenin--a linchpin in colorectal carcinogenesis? Am J Pathol. 2002;160:389-401. [PubMed] [DOI] |
| 24. | Johnson V, Volikos E, Halford SE, Eftekhar Sadat ET, Popat S, Talbot I, Truninger K, Martin J, Jass J, Houlston R. Exon 3 beta-catenin mutations are specifically associated with colorectal carcinomas in hereditary non-polyposis colorectal cancer syndrome. Gut. 2005;54:264-267. [PubMed] [DOI] |
| 25. | Tian YC, Phillips AO. Interaction between the transforming growth factor-beta type II receptor/Smad pathway and beta-catenin during transforming growth factor-beta1-mediated adherens junction disassembly. Am J Pathol. 2002;160:1619-1628. [PubMed] [DOI] |
| 26. | Calvisi DF, Factor VM, Loi R, Thorgeirsson SS. Activation of beta-catenin during hepatocarcinogenesis in transgenic mouse models: relationship to phenotype and tumor grade. Cancer Res. 2001;61:2085-2091. [PubMed] |
| 27. | Labbé E, Letamendia A, Attisano L. Association of Smads with lymphoid enhancer binding factor 1/T cell-specific factor mediates cooperative signaling by the transforming growth factor-beta and wnt pathways. Proc Natl Acad Sci U S A. 2000;97:8358-8363. [PubMed] [DOI] |
| 28. | Peinado H, Quintanilla M, Cano A. Transforming growth factor beta-1 induces snail transcription factor in epithelial cell lines: mechanisms for epithelial mesenchymal transitions. J Biol Chem. 2003;278:21113-21123. [PubMed] [DOI] |
| 29. | Behrens J. Cross-regulation of the Wnt signalling pathway: a role of MAP kinases. J Cell Sci. 2000;113:911-919. [PubMed] |
| 30. | Li YJ, Wei ZM, Meng YX, Ji XR. Beta-catenin up-regulates the expression of cyclinD1, c-myc and MMP-7 in human pancreatic cancer: relationships with carcinogenesis and metastasis. World J Gastroenterol. 2005;11:2117-2123. [PubMed] [DOI] |