修回日期: 2007-02-27
接受日期: 2007-03-06
在线出版日期: 2007-04-08
目的: 观察MTA1, PTEN, E-cadherin蛋白在胃癌和正常胃黏膜组织中的表达, 探讨其与胃癌浸润、转移和生物学行为的关系.
方法: 应用免疫组织化学方法检测54例胃癌手术切除标本和15例正常胃黏膜组织中MTA1, PTEN, E-cadherin的表达. 各指标之间相关因素的差异性比较采用χ2检验, 相关性研究采用Spearman相关分析.
结果: 与正常胃组织相比, MTA1蛋白在胃癌组织中高表达(46.3% vs 6.7%, P<0.01), PTEN和E-cadherin蛋白在胃癌组织中表达下调或缺失(51.9% vs 100%, 42.6% vs 100%, 均P<0.01). MTA1和PTEN的阳性表达率与肿瘤浸润深度(P = 0.003, P = 0.001)、病理分期(P = 0.004, P = 0.008)、淋巴转移(P = 0.000, P = 0.001)、远隔转移(P = 0.004, P = 0.006)、临床分期有关(P = 0.001, P = 0.000); E-cadherin的正常表达率与肿瘤浸润深度(P = 0.027)、病理分化程度(P = 0.006)、淋巴转移(P = 0.044)、临床分期有关(P = 0.000). Spearman相关分析显MTA1与PTEN蛋白、MTA1与E-cadherin蛋白的表达呈负相关(r = -0.518, r = -0.424, 均P<0.05). PTEN蛋白与E-cadherin蛋白的表达呈正相关(r = 0.53, P<0.05).
结论: MTA1蛋白水平高表达和PTEN, E-cadherin蛋白水平低表达可能与胃癌浸润和转移有关, 且联合检测可以用于判断胃癌的生物学行为.
引文著录: 桑海泉, 王强. 胃癌组织中MTA1, PTEN, E-cadherin的表达及其相互关系. 世界华人消化杂志 2007; 15(10): 1096-1102
Revised: February 27, 2007
Accepted: March 6, 2007
Published online: April 8, 2007
AIM: To investigate the expression of metastasis-associated gene 1 (MTA1), PTEN and E-cadherin in gastric carcinoma and normal gastric mucosa and their relationships with the invasion, metastasis and biological behavior of gastric carcinoma.
METHODS: Immunohistochemistry was used to examine the expression of MTA1, PTEN and E-cadherin proteins in gastric carcinoma (n = 54) and normal gastric mucosa (n = 15). The data were processed by chi-square test and the correlation was analyzed by Spearman test.
RESULTS: In comparison with those in normal gastric mucosa, the expression of MTA1 in gastric carcinoma was significantly higher (46.3% vs 6.7%, P < 0.01), and the expression of PTEN and E-cadherin in gastric carcinoma were down-regulated or even disappeared (51.9% vs 100%, 42.6% vs 100%; both P < 0.01). The expression of MTA1 and PTEN were correlated with the invasion depth (P = 0.003, P = 0.001), pathological grades (P = 0.004, P = 0.008), lymph node metastasis (P = 0.000, P = 0.001), distant metastasis (P = 0.004, P = 0.006) and clinical classification (P = 0.001, P = 0.000), and the normal expression of E-cadherin had relationship with the invasion depth (P = 0.027), pathological grades (P = 0.006), lymph node metastasis (P = 0.044), and clinical classification (P = 0.000). There was a negative correlation between the expression of MTA1 and PTEN as well as between the expression of MTA1 and E-cadherin (r = -0.518, r = -0.424; both P < 0.05), but there was a positive correlation between the expression of PTEN and E-cadherin (r = 0.53, P < 0.05).
CONCLUSION: High expression of MTA1 and low expression of PTEN and E-cadherin may be associated with the invasion and metastasis of gastric carcinoma. Combined examination of three indexes may be used to evaluate the biological behavior of gastric carcinoma.
- Citation: Sang HQ, Wang Q. Expression of metastasis-associated gene 1, PTEN and E-cadherin in gastric carcinoma and their correlations. Shijie Huaren Xiaohua Zazhi 2007; 15(10): 1096-1102
- URL: https://www.wjgnet.com/1009-3079/full/v15/i10/1096.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i10.1096
胃癌是发病率较高的恶性肿瘤, 其浸润和转移是一个复杂过程, 是影响胃癌患者预后的主要因素. 肿瘤转移相关基因1(MTA1)是一个新近发现的基因, 他通过影响染色质的状态来调节转录, 调控组蛋白脱乙酰基从而发挥其生物学作用. PTEN是人类新发现的第一个具有磷酸酶活性的抑癌基因, 能通过脱磷酸化作用调控细胞内信号传导通路, 从而抑制肿瘤细胞增殖、黏附、转移. 上皮型钙黏蛋白(E-cadherin)是钙黏附蛋白分子家族中跨膜蛋白亚型的一种, 在介导上皮细胞与上皮细胞的黏附、维持组织正常形态结构中发挥重要作用. 本文通过对胃癌组织中MTA1蛋白, PTEN蛋白, E-cadherin蛋白表达的研究, 来探讨他们在胃癌浸润和转移中的作用.
选择临床及病理资料齐全的中国医科大学附属盛京医院普通外科2001-2003年手术切除、病理证实为胃癌的蜡块标本54例, 全部病例术前均未行过化疗或放疗, 病理均证实为腺癌. 其中男37例, 女17例; 年龄38-78(平均61.6)岁; 局部淋巴结转移: 无转移29例, 有转移25例; 远隔转移: 无转移42例, 有转移12例. 另取正常胃黏膜组织15例作对照, 标本取自胃溃疡或十二指肠溃疡手术标本中正常的胃黏膜组织, 并经病理观察证实且排除重度不典型增生. 其中男10例, 女5例, 年龄44-77(平均58)岁.
采用PV9000免疫组化方法检测上述抗体对应抗原, 浓缩型MTA1羊抗人多克隆抗体(SC-9446)购于美国Santa Cruz公司, 浓缩型PTEN鼠抗人mAb、浓缩型E-cadherin鼠抗人mAb、PV-9000试剂盒及DAB显色试剂盒均购于北京中杉金桥生物技术有限公司. 所有实验操作均按说明书操作规范进行, 用已知阳性的乳腺癌切片作为阳性对照, PBS缓冲液代替一抗作为阴性对照.
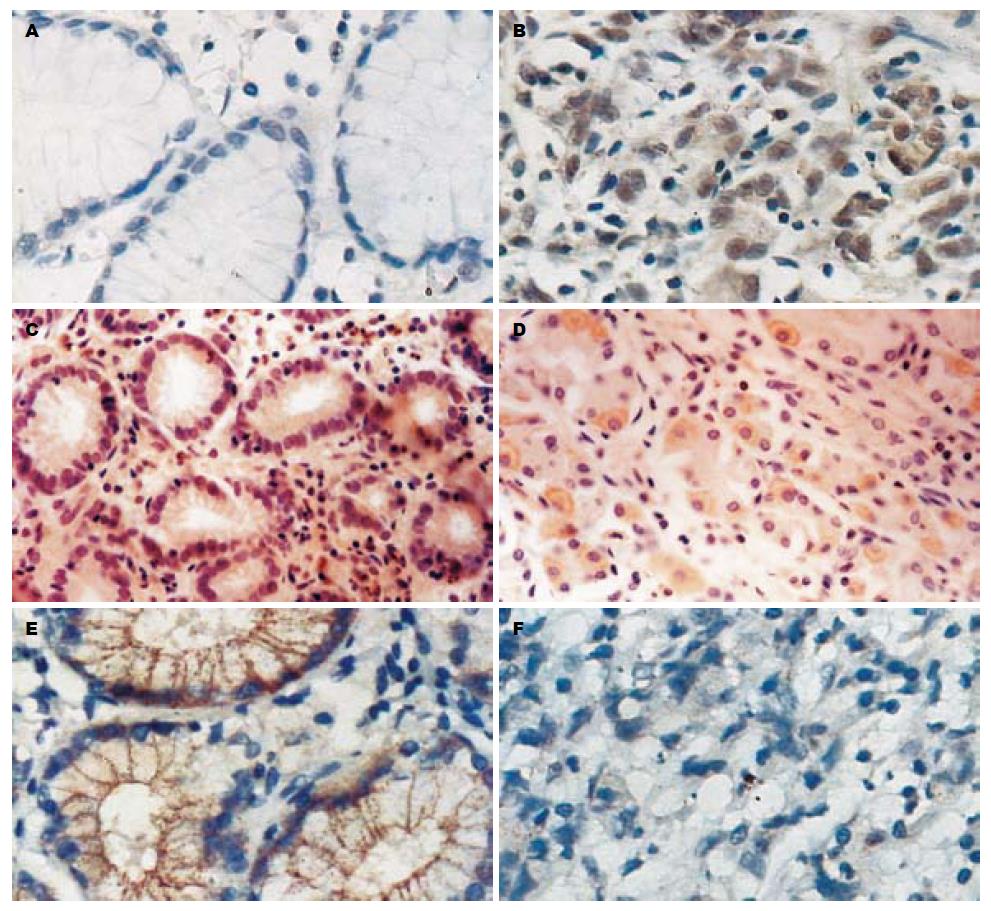
以检测细胞出现棕黄色颗粒为阳性细胞. MTA1主要在细胞核表达, 部分细胞胞质也呈阳性反应. 阳性细胞数量计0-4分: 无计0分, ≤25%计1分, 26%-50%计2分, 51%-75%计3分, >75%计4分. 染色强度计0-3分: 无色计0分, 浅黄色计1分, 棕黄色计2分, 棕褐色计3分. 将两项指标评分相乘, 根据总分分为四级: 阴性(-), 0分; 弱阳性(+), 1-2分; 阳性(++), 3-4分; 强阳性(+++), >4分. PTEN是细胞胞质内呈明显阳性表达. 按阳性细胞率, 将PTEN蛋白染色结果分为4级: 阴性(-), 阳性细胞率<5%; 弱阳性(+), 阳性细胞率5%-25%; 阳性(++), 阳性细胞率25%-50%; 强阳性(+++), 阳性细胞率>50%. E-cadherin以细胞膜呈明显阳性表达. 按阳性细胞率及染色定位, 将E-cadherin蛋白染色结果分为2级: 正常, 正确定位表达细胞数>10%; 异常, 染色细胞<10%或染色部位改变(定位于细胞质或细胞核).
统计学处理 对所有统计资料都采用SPSS13.0软件包进行统计分析. 各指标之间相关因素的差异性比较采用χ2检验. 各指标间的相关性研究采用Spearman相关分析.
MTA1蛋白在胃癌组织中的阳性表达率为46.3%, 明显高于在正常胃组织中的表达(6.7%), 二者的差异有统计学意义(χ2 = 7.851, P<0.01). PTEN蛋白在胃癌组织中的阳性表达率为51.9%, 明显低于在正常胃组织中的表达(100%), 二者的差异有统计学意义(χ2 = 11.589, P<0.01). E-cadherin蛋白在胃癌组织中的正常表达率为42.6%, 明显低于在正常胃组织中的表达(100%), 二者的差异有统计学意义(χ2 = 15.636, P<0.01)(表1, 图1).
| 项目 | n | MTA1 | P值 | PTEN | P值 | E-cadherin | P值 | |||
| 阴性 | 阳性 | 阴性 | 阳性 | 异常 | 正常 | |||||
| 实验组 | 54 | 29(53.7%) | 25(46.3%) | 0.005 | 26(48.1%) | 28(51.9%) | 0.001 | 31(57.4%) | 23(42.6%) | 0.000 |
| 对照组 | 15 | 14(93.3%) | 1(6.7%) | 0(0.0%) | 15(100.0%) | 0(0.0%) | 15(100.0%) | |||
MTA1的阳性表达率随肿瘤浸润深度加深、病理分期程度降低、淋巴转移产生、远隔转移发生、临床分期提高而升高(P<0.05); 而与患者的性别、年龄、肿瘤大小无关. PTEN的阳性表达率随肿瘤浸润深度加深、病理分化程度降低、淋巴转移产生、远隔转移发生、临床分期提高而降低(P<0.05), 而与患者的性别、年龄、肿瘤大小无关. E-cadherin的正常表达率随肿瘤浸润深度加深、病理分化程度降低、淋巴转移产生、临床分期提高而降低(P<0.05), 而与患者的性别、年龄、肿瘤大小、远隔转移无关(表2).
| 项目 | n | MTA1 | P值 | PTEN | P值 | E-cadherin | P值 | |||
| 阴性 | 阳性 | 阴性 | 阳性 | 异常 | 正常 | |||||
| 浸润深度 | 0.003 | 0.001 | 0.027 | |||||||
| 浆膜下 | 15 | 13(86.7%) | 2(13.3%) | 2(13.3%) | 13(86.7%) | 5(33.3%) | 10(66.7%) | |||
| 浸透浆膜 | 39 | 16(41%) | 23(59%) | 24(61.5%) | 15(38.5%) | 26(66.7%) | 13(33.3%) | |||
| 分化 | 0.004 | 0.008 | 0.006 | |||||||
| 高 | 19 | 14(73.7%) | 5(26.3%) | 7(36.8%) | 12(63.2%) | 6(31.6%) | 13(68.4%) | |||
| 中 | 17 | 11(64.7%) | 6(35.3%) | 5(29.4%) | 12(70.6%) | 10(58.8%) | 7(41.2%) | |||
| 低 | 18 | 4(22.2%) | 14(77.8%) | 14(77.8%) | 4(22.2%) | 15(83.3%) | 3(16.7%) | |||
| 淋巴转移 | 0.000 | 0.001 | 0.044 | |||||||
| 无 | 29 | 22(75.9%) | 7(24.1%) | 8(27.6%) | 21(72.4%) | 13(44.8%) | 16(55.2%) | |||
| 有 | 25 | 7(28.0%) | 18(72.0%) | 18(72.0%) | 7(28.0%) | 18(72.0%) | 7(28.0%) | |||
| 远隔转移 | 0.004 | 0.006 | 0.941 | |||||||
| 无 | 42 | 27(64.3%) | 15(35.7%) | 16(38.1%) | 26(61.9%) | 24(57.1%) | 18(42.9%) | |||
| 有 | 12 | 2(16.7%) | 10(83.3%) | 10(83.3%) | 2(16.7%) | 7(58.3%) | 5(41.7%) | |||
| TNM分期1 | 0.001 | 0.000 | 0.000 | |||||||
| Ⅰ+Ⅱ | 26 | 20(76.9%) | 6(23.1%) | 6(23.1%) | 20(76.9%) | 8(30.8%) | 18(69.2%) | |||
| Ⅲ+Ⅳ | 28 | 9(32.1%) | 19(67.9%) | 20(71.4%) | 8(28.6%) | 23(82.1%) | 5(17.9%) | |||
| 性别 | 0.609 | 0.487 | 0.653 | |||||||
| 男 | 37 | 19(51.4%) | 18(48.6%) | 19(51.4%) | 18(48.6%) | 22(59.5%) | 15(40.5%) | |||
| 女 | 17 | 10(58.8%) | 7(41.2%) | 7(41.2%) | 10(58.8%) | 9(52.9%) | 8(47.1%) | |||
| 年龄 | 0.652 | 0.394 | 0.902 | |||||||
| <60岁 | 24 | 12(50.0%) | 12(50.0%) | 10(41.7%) | 14(58.3%) | 14(58.3%) | 10(41.7%) | |||
| ≥60岁 | 30 | 17(56.7%) | 13(43.3%) | 16(53.3%) | 14(46.7%) | 17(56.7%) | 13(43.3%) | |||
| 肿瘤大小 | 0.507 | 0.099 | 0.297 | |||||||
| <5 cm | 37 | 21(56.8%) | 16(43.2%) | 15(40.5%) | 22(59.5%) | 23(62.2%) | 14(37.8%) | |||
| ≥5 cm | 17 | 8(47.1%) | 9(52.9%) | 11(64.7%) | 6(35.3%) | 8(47.1%) | 9(52.9%) | |||
胃癌组织中MTA1与PTEN, MTA1与E-cadherin表达呈负相关, P<0.05, PTEN与E-cadherin表达呈正相关(P<0.05, 表3, 表4).
| 项目 | PTEN的表达 | P值 | rs | E-cadherin的表达 | P值 | rs | ||
| 阴性 | 阳性 | 异常 | 正常 | |||||
| MTA1的表达 | ||||||||
| 阴性 | 7 | 22 | <0.001 | -0.518 | 11 | 18 | <0.01 | -0.424 |
| 阳性 | 19 | 6 | 20 | 5 | ||||
| 项目 | E-cadherin的表达 | P值 | rs | |
| 异常 | 正常 | |||
| PTEN的表达 | ||||
| 阴性 | 22 | 4 | <0.001 | 0.53 |
| 阳性 | 9 | 19 | ||
mta1是1993年Pencil et al[1]应用差异杂交从具有转移潜能的鼠乳腺癌细胞株13762NF中筛选得到的基因. 因该基因的表达与乳腺肿瘤转移能力正相关, 故被命名为(肿瘤)转移相关基因1(metastasis associated 1, mta1). 其cDNA全长2756 bp, 包含一个独立开放阅读框[2-3]. 随后在人类高转移力乳腺癌细胞株中, 也发现了mta1的相关序列MTA1, 位于人染色体14q32.3[4]. MTA1编码一个含715个氨基酸残基的蛋白, 分子量82 kDa, 应用间接免疫荧光位于细胞核内, 是一种核蛋白[5].
MTA1蛋白羧基末端富含脯氨酸, 其696-705残基序列为LPPRPPPPAP, 与SH3结合域XPXXPPPFXP或XpFPpXP完全配对[5]. SH3在信号转导通路中参与蛋白和蛋白间相互作用, 构成细胞骨架组分, 并在信号转导通路中与浸润和转移相关的基因有关. MTA1蛋白还具有9个蛋白激酶C(PKCs)、2个酪氨酸激酶(TKs)、7个酪蛋白激酶Ⅱ(CKⅡ)的磷酸化位点以及4个N-糖基化位点, 说明MTA1蛋白可能在信号转导通路中与其他一些维持细胞正常功能蛋白发生作用[2].
MTA1被认为是核小体重构及组蛋白脱乙酰基酶复合物(nucleosome remodeling and histone deacetylase, NuRD)的一个亚单位[6]. NuRD具有核小体重构与组蛋白脱乙酰活性. 乙酰化可以减少基因组DNA与组蛋白的结合, 松散的染色质结构利于基因组DNA的转录. 而MTA1在此复合物中与组蛋白去乙酰化酶1(HDAC1)结合紧密, 与组蛋白去乙酰化成正相关, 作为组蛋白去乙酰化酶的辅助激动因子抑制转录, 成为转录过程中一个辅助抑制因子. MTA1促进胃癌转移的分子机制可能与组蛋白去乙酰化调节转录有关. Hofer et al[7]研究发现MTA1可以显著改变细胞角蛋白丝系统的组装及细胞骨架蛋白的定位, 并使细胞获得更具侵袭性和转移性的表型. 观察发现, 细胞骨架相关蛋白IQGAP1在EGFP-MTA1表达的细胞膜上分布异常增多. IQGAP能从E-cadherin/连接素复合物中解离出α-连接素, 破坏该复合物结构, 使细胞间黏附性减弱, 增强细胞的侵袭能力. 由此可见, MTA1可能是通过参与信号转导与基因表达, 调控一系列与浸润、转移有关蛋白, 在癌细胞侵袭和生长过程中发挥重要作用[8]. 研究发现MTA1的高表达与多种人类肿瘤的侵袭力密切相关[9]. 本实验发现, MTA1蛋白在胃癌组织中的表达率(46.3%, 25/54)明显高于正常胃组织(6.7%, 1/15, χ2 = 7.851, P<0.01), 并随肿瘤浸润深度加深、淋巴转移产生、远隔转移发生、临床分期提高、肿瘤病理分化程度降低而升高(P<0.05), 与文献报道一致, 提示MTA1蛋白高表达与胃癌的浸润、转移密切相关, 可以作为转移相关标志物预测胃癌的恶性程度.
PTEN基因是1997年由Steck et al[10]3个研究小组分别发现并命名的第1个具有磷酸酯酶活性的抑癌基因, 即与张力蛋白同源的、第10染色体丢失的磷酸酶(phosphatase and tensin homology deleted on chromosome 10, PTEN), 定位于人染色体10q23.3, 在多个进展期肿瘤中均有突变.
PTEN蛋白主要功能区位于N端, 由1209个核苷酸编码403个氨基酸组成一条多肽链, 第122-133位的氨基酸序列(IHCKAGKGRTG)符合蛋白酪氨酸磷酸酶及双特异性磷酸酶催化区的核心基序(HCXXGXGRXG)[11]. PTEN编码产生的蛋白质具有双特异性磷酸酶功能, 能使信号分子3,4,5-三磷酸-磷脂酰肌醇(PIP3)去磷酸化, 抑制细胞的不正常增殖分裂[12-13]. PTEN具有与细胞张力蛋白和辅助蛋白同源的序列, 可以在局灶黏附点与肌动蛋白结合, 与该位点的复合物(包括整合素、局灶黏附激酶FAK、Src、酪氨酸激酶及生长因子受体)相互作用, 在肿瘤细胞浸润、肿瘤转移中起一定作用[14]. PTEN使FAK(focal adhesion kinase)自身酪氨酸磷酸化而活化, 活化的FAK在衔接蛋白的偶联下可调节有丝分裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)通路, 从而介导细胞的黏附与转移[10]. 由此可见, PTEN可能通过调节细胞的黏附和转移发挥其抑癌作用. Weng et al[15]发现PTEN蛋白表达高低与患者的病理分级及预后有关, 预后越差, 恶性程度越高, PTEN蛋白表达水平越低. 国内有研究表明, PTEN蛋白的表达下调或缺失与胃癌和结直肠癌的发生、发展、淋巴转移、新生血管形成及肿瘤分化程度密切相关[16-21]. 本实验发现, PTEN蛋白在胃癌组织中的表达率(51.9%, 28/54)明显低于正常胃组织(100%, 15/15, χ2 = 11.589, P<0.01), 并随肿瘤浸润深度加深、病理分化程度降低、淋巴转移发生、远隔转移产生及临床分期增高而降低(P<0.05), 与文献报道一致, 提示PTEN蛋白表达的缺失与胃癌的浸润、转移密切相关. 有文献报道, 由于PTEN蛋白的下降, 使癌细胞对凋亡信号的敏感性降低, 致肿瘤生长速度增快, 故PTEN的表达与肿瘤的大小有密切的相关性[22]. 但本实验发现PTEN蛋白的表达与肿瘤的大小有相关趋势, 但无统计学意义, 可能与样本量较小有关.
E-cadherin是分子量120 kDa的细胞膜整合蛋白, 广泛分布于上皮细胞, 通过具有钙依赖性的同型细胞黏附作用在保持组织的形态发生、发展和细胞间连接起关键作用[23]. E-cadherin基因位于16q22.1[24], 由细胞外区, 跨膜区和胞质区组成. 细胞外区能与Ca2+特异性地结合, 含有由组-丙-缬(HAV)序列组成的黏附识别位点, 介导同种细胞间的黏附反应[25]. 胞内区包含一个高度保守的结构域, 通过羧基末端与连环蛋白(catenins)分子形成一种黏着复合体(AJS), 再与细胞骨架的肌动蛋白结合, 形成E-cadherin介导的黏附系统, 在上皮细胞间发挥重要的黏附作用和信号转导功能[26]. 正常胃黏膜上皮E-cadherin呈强阳性表达, 与正常胃黏膜相比, 17%-92%的胃癌组织E-cadherin表达减弱[27]. 同时肿瘤细胞转染E-cadherin cDNA后其体外浸润能力下降[28-29]. 研究表明E-cadherin的异常表达在胃癌中很常见, 抑制E-cadherin的表达可以增加胃癌的浸润和转移, 有利于胃癌的淋巴结转移[30-33]. 本实验发现, E-cadherin在胃癌组织中的正常表达率(42.6%, 23/54)明显低于正常胃组织(100%, 15/15, χ2 = 15.636, P<0.01), 并随肿瘤浸润深度加深、病理分化程度降低、淋巴转移发生、临床分期提高而降低(P<0.05), 与文献报道一致, 提示E-cadherin表达异常与胃癌的浸润和转移密切相关.
本实验发现, MTA1与PTEN在胃癌组织中的表达呈负相关(P<0.001, rs = -0.518), MTA1和E-cadherin在胃癌组织中的表达呈负相关(P<0.01, rs = -0.424), 提示胃癌组织中MTA1表达的上调对PTEN, E-cadherin的抑制作用加强, 导致PTEN, E-cadherin的低表达, 促进了肿瘤细胞的浸润和转移. 本实验亦发现, 胃癌组织中PTEN和E-cadherin的表达呈正相关(P<0.001, rs = 0.53), 提示PTEN表达降低和E-cadherin表达异常在胃癌浸润和转移中相互促进.
总之, 胃癌组织中MTA1, PTEN, E-cadherin蛋白的异常表达在胃癌的浸润和转移过程中发挥重要作用, 其作用途径和形式复杂且相互联系, 需要进一步研究其作用机制. 联合检测MTA1, PTEN, E-cadherin蛋白可以更准确的判断胃癌的生物学行为, 预测患者的预后, 指导临床治疗, 且为开发新的抗癌药物和寻求新的基因治疗的靶基因提供新思路.
胃癌是发病率较高的恶性肿瘤, 其浸润和转移是一个复杂过程, 是影响胃癌患者预后的主要因素. 本文通过对胃癌组织中MTA1 蛋白, PTEN蛋白, E-cadherin蛋白表达的研究, 来探讨他们在胃癌浸润和转移中的作用.
目前关于胃癌浸润和转移的研究是胃癌研究领域中的热点和重点, 其具体机制有待于进一步阐明.
国内外许多研究发现MTA1, PTEN, E-cadherin的异常表达与胃癌的浸润和转移密切相关. 联合检测可以更准确的评估胃癌的生物学行为, 预测患者的预后.
本文系统的阐述了MTA1, PTEN, E-cadherin分别在胃癌组织中的表达及与胃癌浸润和转移的关系. 研究了三者之间的相关性, 提供了更准确的判断胃癌生物学行为的方法.
联合检测MTA1, PTEN, E-cadherin可以更准确的判断胃癌的生物学行为, 预测患者的预后, 指导临床治疗, 且为开发新的抗癌药物和寻求新的基因治疗的靶基因提供新思路.
NuRD: 核小体重构及组蛋白脱乙酰基酶复合物, 具有核小体重构与组蛋白脱乙酰活性.
本文采用免疫组化PowerVisionTM2PV9000法检测了胃癌和正常胃黏膜组织中MTA1, PTEN, E-cadherin在蛋白水平的表达, 并研究这些蛋白表达与胃癌浸润、转移和生物学行为的关系, 结果提示MTA1蛋白水平高表达和PTEN, E-cadherin蛋白水平的低表达可能与胃癌浸润和转移的有关, 且联合检测可以用于判断胃癌的生物学行为. 文章立题有一定的实用价值, 研究方法较先进, 研究内容较新颖, 结果准确.
编辑: 张焕兰 电编:张敏
| 1. | Pencil SD, Toh Y, Nicolson GL. Candidate metastasis-associated genes of the rat 13762NF mammary adenocarcinoma. Breast Cancer Res Treat. 1993;25:165-174. [PubMed] [DOI] |
| 2. | Toh Y, Pencil SD, Nicolson GL. A novel candidate metastasis-associated gene, mta1, differentially expressed in highly metastatic mammary adenocarcinoma cell lines. cDNA cloning, expression, and protein analyses. J Biol Chem. 1994;269:22958-22963. [PubMed] |
| 3. | Toh Y, Pencil SD, Nicolson GL. Analysis of the complete sequence of the novel metastasis-associated candidate gene, mta1, differentially expressed in mammary adenocarcinoma and breast cancer cell lines. Gene. 1995;159:97-104. [PubMed] [DOI] |
| 4. | Cui Q, Takiguchi S, Matsusue K, Toh Y, Yoshida MA. Assignment of the human metastasis-associated gene 1 (MTA1) to human chromosome band 14q32.3 by fluorescence in situ hybridization. Cytogenet Cell Genet. 2001;93:139-140. [PubMed] [DOI] |
| 5. | Nawa A, Nishimori K, Lin P, Maki Y, Moue K, Sawada H, Toh Y, Fumitaka K, Nicolson GL. Tumor metastasis-associated human MTA1 gene: its deduced protein sequence, localization, and association with breast cancer cell proliferation using antisense phosphorothioate oligonucleotides. J Cell Biochem. 2000;79:202-212. [PubMed] [DOI] |
| 6. | Xue Y, Wong J, Moreno GT, Young MK, Côté J, Wang W. NURD, a novel complex with both ATP-dependent chromatin-remodeling and histone deacetylase activities. Mol Cell. 1998;2:851-861. [PubMed] [DOI] |
| 7. | Hofer MD, Menke A, Genze F, Gierschik P, Giehl K. Expression of MTA1 promotes motility and invasiveness of PANC-1 pancreatic carcinoma cells. Br J Cancer. 2004;90:455-462. [PubMed] [DOI] |
| 8. | Toh Y, Oki E, Oda S, Tokunaga E, Ohno S, Maehara Y, Nicolson GL, Sugimachi K. Overexpression of the MTA1 gene in gastrointestinal carcinomas: correlation with invasion and metastasis. Int J Cancer. 1997;74:459-463. [PubMed] [DOI] |
| 9. | Nicolson GL, Nawa A, Toh Y, Taniguchi S, Nishimori K, Moustafa A. Tumor metastasis-associated human MTA1 gene and its MTA1 protein product: role in epithelial cancer cell invasion, proliferation and nuclear regulation. Clin Exp Metastasis. 2003;20:19-24. [PubMed] [DOI] |
| 10. | Steck PA, Pershouse MA, Jasser SA, Yung WK, Lin H, Ligon AH, Langford LA, Baumgard ML, Hattier T, Davis T. Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers. Nat Genet. 1997;15:356-362. [PubMed] [DOI] |
| 11. | Li J, Yen C, Liaw D, Podsypanina K, Bose S, Wang SI, Puc J, Miliaresis C, Rodgers L, McCombie R. PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer. Science. 1997;275:1943-1947. [PubMed] [DOI] |
| 12. | Scheid MP, Woodgett JR. PKB/AKT: functional insights from genetic models. Nat Rev Mol Cell Biol. 2001;2:760-768. [PubMed] [DOI] |
| 13. | Cantley LC, Neel BG. New insights into tumor suppression: PTEN suppresses tumor formation by restraining the phosphoinositide 3-kinase/AKT pathway. Proc Natl Acad Sci U S A. 1999;96:4240-4245. [PubMed] [DOI] |
| 14. | Akbiyik F, Ray DM, Gettings KF, Blumberg N, Francis CW, Phipps RP. Human bone marrow megakaryocytes and platelets express PPARgamma, and PPARgamma agonists blunt platelet release of CD40 ligand and thromboxanes. Blood. 2004;104:1361-1368. [PubMed] [DOI] |
| 15. | Weng LP, Smith WM, Brown JL, Eng C. PTEN inhibits insulin-stimulated MEK/MAPK activation and cell growth by blocking IRS-1 phosphorylation and IRS-1/Grb-2/Sos complex formation in a breast cancer model. Hum Mol Genet. 2001;10:605-616. [PubMed] [DOI] |
| 16. | Zheng HC, Li YL, Sun JM, Yang XF, Li XH, Jiang WG, Zhang YC, Xin Y. Growth, invasion, metastasis, differentiation, angiogenesis and apoptosis of gastric cancer regulated by expression of PTEN encoding products. World J Gastroenterol. 2003;9:1662-1666. [PubMed] [DOI] |
| 17. | Zhou YJ, Xiong YX, Wu XT, Shi D, Fan W, Zhou T, Li YC, Huang X. Inactivation of PTEN is associated with increased angiogenesis and VEGF overexpression in gastric cancer. World J Gastroenterol. 2004;10:3225-3229. [PubMed] [DOI] |
| 23. | Nagafuchi A, Shirayoshi Y, Okazaki K, Yasuda K, Takeichi M. Transformation of cell adhesion properties by exogenously introduced E-cadherin cDNA. Nature. 1987;329:341-343. [PubMed] [DOI] |
| 24. | Oda T, Kanai Y, Oyama T, Yoshiura K, Shimoyama Y, Birchmeier W, Sugimura T, Hirohashi S. E-cadherin gene mutations in human gastric carcinoma cell lines. Proc Natl Acad Sci U S A. 1994;91:1858-1862. [PubMed] [DOI] |
| 25. | Takeichi M. Cadherin cell adhesion receptors as a morphogenetic regulator. Science. 1991;251:1451-1455. [PubMed] [DOI] |
| 26. | Mareel M, Leroy A. Clinical, cellular, and molecular aspects of cancer invasion. Physiol Rev. 2003;83:337-376. [PubMed] [DOI] |
| 27. | Gabbert HE, Mueller W, Schneiders A, Meier S, Moll R, Birchmeier W, Hommel G. Prognostic value of E-cadherin expression in 413 gastric carcinomas. Int J Cancer. 1996;69:184-189. [PubMed] [DOI] |
| 28. | Korinek V, Barker N, Morin PJ, van Wichen D, de Weger R, Kinzler KW, Vogelstein B, Clevers H. Constitutive transcriptional activation by a beta-catenin-Tcf complex in APC-/- colon carcinoma. Science. 1997;275:1784-1787. [PubMed] [DOI] |
| 29. | Vessey CJ, Wilding J, Folarin N, Hirano S, Takeichi M, Soutter P, Stamp GW, Pignatelli M. Altered expression and function of E-cadherin in cervical intraepithelial neoplasia and invasive squamous cell carcinoma. J Pathol. 1995;176:151-159. [PubMed] [DOI] |
| 30. | Zhou YN, Xu CP, Han B, Li M, Qiao L, Fang DC, Yang JM. Expression of E-cadherin and beta-catenin in gastric carcinoma and its correlation with the clinicopathological features and patient survival. World J Gastroenterol. 2002;8:987-993. [PubMed] [DOI] |
| 31. | Zheng ZH, Sun XJ, Zhou HT, Shang C, Ji H, Sun KL. Analysis of metastasis suppressing function of E-cadherin in gastric cancer cells by RNAi. World J Gastroenterol. 2005;11:2000-2003. [PubMed] [DOI] |
| 32. | Wu ZY, Zhan WH, Li JH, He YL, Wang JP, Lan P, Peng JS, Cai SR. Expression of E-cadherin in gastric carcinoma and its correlation with lymph node micrometastasis. World J Gastroenterol. 2005;11:3139-3143. [PubMed] [DOI] |