修回日期: 2007-02-28
接受日期: 2007-03-07
在线出版日期: 2007-04-08
目的: 研究金雀异黄素(Genistein)对人胃腺癌细胞SGC-7901中Akt及其磷酸化蛋白p-Akt (Ser473)和p-Akt(Thr308)表达的影响.
方法: 用浓度为0、5、10、20、40和80 μmol/L的Genistein处理SGC-7901细胞24 h后, 采用四甲基偶氮唑盐(MTT)方法检测Genistein对SGC-7901增殖的抑制作用, Hoechst 33342染色观察Genistein对SGC-7901凋亡的诱导作用, Western blot方法检测不同浓度Genistein处理后的SGC-7901细胞中Akt, p-Akt(Ser473)和p-Akt(Thr308)的表达情况.
结果: 5, 10, 20, 40和80 μmol/L的Genistein对SGC-7901细胞增殖的抑制率分别为6.85%±3.71%, 13.19%±1.90%, 20.94%±1.83%, 29.58%±1.19%和41.75%±1.92%. 20-80 μmol/L的Genistein处理组细胞呈现明显的凋亡形态学改变. Genistein对细胞中Akt蛋白的表达没有明显影响. 不同浓度Genistein处理SGC-7901细胞24 h后, 均有两种磷酸化Akt蛋白的表达, 两种磷酸化蛋白表达均随Genistein浓度的增加而逐渐减弱, 80 μmol/L Genistein处理组表达最弱.
结论: Genistein的抗癌活性与其抑制磷酸化Akt蛋白表达有关.
引文著录: 付荣霞, 杨艳梅, 张春艳. 金雀异黄素对人胃腺癌细胞中Akt及其磷酸化蛋白表达的影响. 世界华人消化杂志 2007; 15(10): 1055-1059
Revised: February 28, 2007
Accepted: March 7, 2007
Published online: April 8, 2007
AIM: To investigate the effects of Genestein on the expression of Akt and its phosphorylated proteins (p-Akts) in human gastric carcinoma cell line SGC-7901.
METHODS: SGC-7901 cells were exposed to 0、5、10、20、40 and 80 μmol/L Genistein for 24 h. The effect of Genistein on cell proliferation was measured by methyl thiazolyl tetrazolium (MTT) assay, and the apoptosis of SGC-7901 cells was evaluated by Hoechst 33342 staining. The expression of Akt and p-Akts (Ser473 and Thr308) were measured by Western blot.
RESULTS: The inhibitory rate was 6.85% ± 3.71%, 13.19% ± 1.90%, 20.94% ± 1.83%, 29.58% ± 1.19% and 41.75% ± 1.92%, respectively, as SGC-7901 cells were exposed to 5, 10, 20, 40 and 80 μmol/L Genistein for 24 h. Typical morphological changes of apoptosis were induced by Genistein at the concentrations (20-80 μmol/L). Genistein had no marked influences on Akt expression. Both Ser473 and Thr308 were expressed in SGC-7901 cells 24 h after Genistein treatment, and they were decreased with the increasing of Genistein concentrations. The weakest expression appeared as 80 μmol/L Genistein was used.
CONCLUSION: The anti-cancer action of Genistein may be associated with the decreased expression of p-Akt (Ser473) and p-Akt (Thr308).
- Citation: Fu RX, Yang YM, Zhang CY. Effect of Genistein on the expression of Akt and phosphorylated Akts in human gastric carcinoma cell line. Shijie Huaren Xiaohua Zazhi 2007; 15(10): 1055-1059
- URL: https://www.wjgnet.com/1009-3079/full/v15/i10/1055.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i10.1055
金雀异黄素(Genistein)又称为染料木黄酮, 是一种来源于豆类植物和齿类植物的异黄酮类化合物, 其化学名为4', 5, 7-三羟基异黄酮[1]. 研究表明, Genistein可能抑制多种肿瘤细胞的体外增殖, 故Genistein已经成为广受各界关注的一种非营养素成分[2-5]. Akt又被称为蛋白激酶B(protein kinase B, PKB), 他是一种丝氨酸/苏氨酸蛋白激酶, 是PI3K/Akt通路中的关键分子. 磷酸化活化的Akt在促进肿瘤细胞的增殖、抑制细胞凋亡、促进细胞侵袭和转移等方面起重要作用[6-12]. 最近在许多人类肿瘤中发现, PKB/Akt信号传导通路异常与肿瘤发生、发展关系密切[13-17], 因此, Akt可能成为抗肿瘤治疗的一个新靶点. Akt的充分激活必须有两个磷酸化位点(Thr308和Ser473)都被磷酸化. 我们采用体外细胞培养技术, 拟研究Genistein对人胃腺癌细胞SGC-7901中Akt及其磷酸化蛋白p-Akt(Ser473)和p-Akt(Thr308)表达的影响, 探讨Genistein抑制胃癌细胞增殖与其影响Akt表达和磷酸化Akt蛋白表达的关系.
Genistein、MTT、胰酶和荧光染料Hoechst 33342均购自美国Sigma公司, Genistein纯度不低于98%; RPMI1640培养基购自美国Gibco公司, 胎牛血清购自杭州四季青公司. 兔抗人Akt, p-Akt(Ser473)和p-Akt(Thr308)抗体购自美国Cell Signaling公司. 碱性磷酸酶标记羊抗兔二抗和BCIP/NBT显色系统购自美国Promega公司. SGC-7901由哈尔滨医科大学肿瘤研究所提供. 细胞常规培养于含100 mL/L胎牛血清的RPMI1640培养液中. Genistein用二甲基亚砜(DMSO)溶解, 配制成80 mmol/L的储备液, 用培养液稀释至所需浓度. DMSO在各组培养液中的终浓度均为1 mL/L.
1.2.1 四甲基偶氮唑盐(MTT)实验检测Genistein对SGC-7901细胞增殖的抑制作用: 取对数生长期的SGC-7901细胞, 常规胰酶消化接种于96孔板, 每孔4×103个细胞, 培养24 h后加入Genistein使其终浓度为0、5、10、20、40和80 μmol/L, 每个浓度设5个平行孔. 培养24 h后加入5 g/L MTT 20 μL, 再培养4 h后倒尽板中的培养液, 各孔加100 μL DMSO, 轻轻振荡后用酶标仪(波长490 nm)测定各孔的吸光度A值, 以每组5个孔A值的平均值作为各组的平均A值. 实验重复3次. 根据下列公式计算Genistein对SGC-7901细胞的抑制率: 抑制率 = (1-实验组A值/对照组A值)×100%.
1.2.2 荧光显微镜观察Genistein对SGC-7901细胞凋亡的作用: 常规培养SGC-7901细胞, 按1×105个/孔接种于24孔细胞培养板. 24 h后用含不同剂量Genistein的20 g/L RPMI1640处理24 h. 加入5 mg/L的Hoechst 33342, 于4 ℃避光染色15 min后, PBS洗2次, 置Nikon荧光倒置显微镜下观察.
1.2.3 Western blot方法检测Genistein对SGC-7901细胞中Akt, p-Akt(Ser473)和p-Akt(Thr308)表达的影响: 常规收集不同浓度Genistein处理24 h的细胞, 提取细胞总蛋白; 用Bradford法测定含量后, 取50 μg总蛋白经100 g/L聚丙烯酰胺凝胶电泳分离并转移至硝酸纤维素膜上. 用含10 g/L BSA的TBST室温封闭1 h; 分别加1:600稀释的兔抗人Akt, p-Akt(Ser473)和p-Akt(Thr308)抗体, 室温孵育2 h; 用TBST漂洗10 min, 3次; 加1:7500稀释的碱性磷酸酶标记的二抗, 室温孵育1 h; 用TBST漂洗10 min, 3次, TBS漂洗2次, NBT/BCIP显色, 去离子水漂洗, 上海天能凝胶成像图像分析系统照相记录结果.
统计学处理 采用SPSS12.0统计软件进行单因素方差分析, 组间比较用LSD法.
在5-80 μmol/L浓度时, Genistein对SGC-7901细胞的增殖有明显抑制作用, 并且其抑制作用随着Genistein浓度的提高而增强(表1).
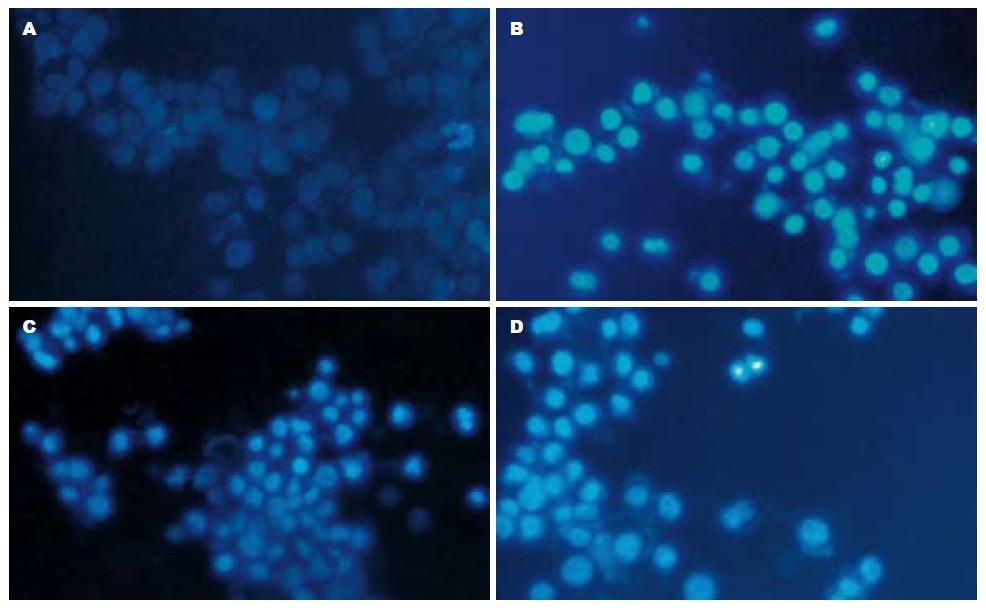
Hoechst 33342荧光染料特异性结合细胞内的DNA, 使细胞核发出淡蓝色荧光. 在荧光显微镜下观察, 正常细胞呈现弥散均匀蓝色荧光, 细胞边缘整齐; 凋亡细胞变圆、体积缩小、核染色质致密深染形成浓染致密的颗粒块状蓝色荧光, 核碎裂呈大小不等的圆形小体. 本实验对照组偶见凋亡细胞, 而各Genistein处理组则可见较多的凋亡细胞, 并且随着Genistein浓度的提高, 凋亡细胞数明显增多(图1).
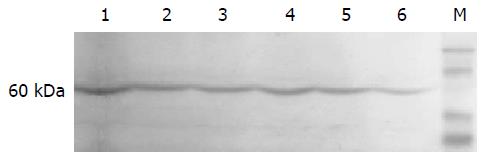
不同浓度Genistein处理SGC-7901细胞24 h后, 均有Akt蛋白的表达条带, 各组Akt蛋白条带的光密度强度差别不明显, 仅80.0 μmol/L Genistein处理组Akt表达量略有降低(图2).
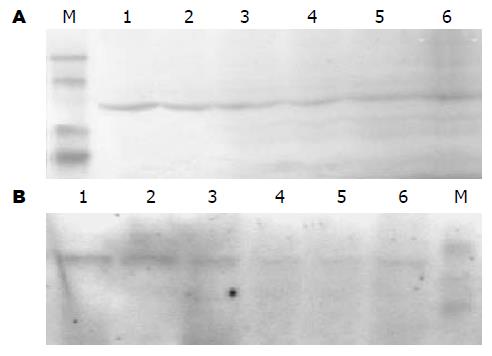
不同浓度Genistein处理SGC-7901细胞24 h后, 均有两种磷酸化Akt蛋白的表达条带, 但条带的光密度强度不同, 两种磷酸化蛋白均在对照组表达最强, 随Genistein浓度的增加, 其表达程度逐渐减弱, 80 μmol/L Genistein处理组表达最弱(图3).
Genistein是一种具有多种生物学作用的异黄酮类物质, 自从发现Genistein是一种蛋白酪氨酸激酶(protein tyrosine kinase, PTK)特异性抑制剂以来, 其抗癌活性引起广泛关注. 体内体外实验及流行病学研究结果显示, Genistein对多种肿瘤均有抑制作用[18-26]. 本研究采用MTT方法也证实Genistein对SGC-7901细胞的体外增殖有抑制作用, 并且20-80 μmol/L的Genistein处理能诱导SGC-7901细胞形成典型的凋亡形态学改变. 上述研究结果说明, Genistein具有抑制肿瘤细胞增殖的作用.
Akt是细胞内信息传导途径中的一个重要的蛋白激酶, 他是磷脂酰肌醇-3-激酶(phosphoinositide-3-kinase, PI3K)下游的靶蛋白, 是PI3K/Akt信号传导途径的中心环节, 他在控制细胞存活和凋亡过程中具有重要作用[27]. Akt的持续活化是其发挥促细胞生存、抑制细胞凋亡功能的重要前提[28], 而Ser473和/或Thr308位点的磷酸化是Akt激活的必要条件. 例如, 表皮生长因子(epidermal growth factor, EGF)等生长因子通过激活PI3K而磷酸化Akt的Ser473和Thr308位点使Akt活化, 继而活化的Akt磷酸化失活一些下游靶基因, 从而抑制凋亡而促进细胞存活[29-30]. Akiyama et al[31]早在1987年就首次报道了Genistein是一种选择性的, 有效的PTK抑制剂, 同时对丝/苏氨酸的活性也有弱抑制作用. 本研究中我们发现, Genistein对SGC-7901细胞中Akt的表达没有明显影响, 但是显著降低Akt的活性形式--p-Akt(Ser473)和p-Akt(Thr308)两种磷酸化蛋白的表达. 目前已发现, Akt可通过磷酸化使多种细胞内蛋白失活, 其中一些底物蛋白, 如Bad, Caspase 9, IκB激酶(IκB kinase, IKK)、糖原合酶激酶3b(glycogen synthase kinase3b, GSK3b)等在磷酸化后可通过直接改变凋亡途径的组件或间接改变编码凋亡途径组件的基因表达水平, 从而抑制细胞凋亡的发生. 因此, Genistein可通过抑制Akt活性形式--磷酸化Akt的形成而诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖.
总之, Akt可能成为肿瘤治疗的一个新靶点, 本研究结果表明, 抑制磷酸化Akt的表达可能是Genistein诱导人胃腺癌细胞SGC-7901细胞凋亡、抑制其增殖的原因之一. 因此, 在化疗时联合应用Genistein可能是一种有效治疗胃癌的措施.
衷心感谢刘金福教授和李晓雁老师对课题的关注及给予的大力支持.
研究表明Genis-tein对多种肿瘤有抑制作用. Akt作为一种丝氨酸/苏氨酸蛋白激酶, 是PI3K/Akt通路中的关键分子. 在许多人类肿瘤中发现, Akt信号传导通路异常与肿瘤发生、发展关系密切. 因此, Akt可能成为抗肿瘤治疗的一个新靶点. 探讨Genistein抑制胃癌细胞增殖与其影响Akt表达和磷酸化Akt蛋白表达的关系有助于揭示Genistein的抗癌机制, 为将Genistein应用于预防和治疗胃癌提供理论依据.
自从发现Genis-tein是一种蛋白酪氨酸激酶(PTK)特异性抑制剂以来, 其抗癌活性引起广泛关注. 体内体外实验及流行病学研究结果显示, Genistein对多种肿瘤均有抑制作用. 研究Genistein对肿瘤细胞中信号传导途经的调节作用已经成为研究其抗癌活性机制的一个主要环节.
本研究发现Geni-stein抑制磷酸化Akt的表达可能是Genistein诱导人胃腺癌细胞SGC-7901细胞凋亡、抑制其增殖的原因之一.
探讨Genistein抑制胃癌细胞增殖与其影响Akt表达和磷酸化Akt蛋白表达的关系有助于揭示Genistein的抗癌机制, 为将Genistein应用于预防和治疗胃癌提供理论依据.
Akt: 又被称为蛋白激酶B(proteinkinase B, PKB), 他是一种丝氨酸/苏氨酸蛋白激酶, 是PI3K/Akt通路中的关键分子. 磷酸化活化的Akt在促进肿瘤细胞的增殖、抑制细胞凋亡、促进细胞侵袭和转移等方面起重要作用.
本文研究了金雀异黄素对人胃腺癌细胞中Akt及其磷酸化蛋白表达的影响, 文章书写较流畅, 逻辑性较强, 具有一定的创新性和指导临床胃癌治疗的作用.
编辑: 王晓瑜 电编:张敏
| 1. | Griffiths K, Morton MS, Denis L. Certain aspects of molecular endocrinology that relate to the influence of dietary factors on the pathogenesis of prostate cancer. Eur Urol. 1999;35:443-455. [PubMed] [DOI] |
| 2. | Li Y, Sarkar FH. Gene expression profiles of genistein-treated PC3 prostate cancer cells. J Nutr. 2002;132:3623-3631. [PubMed] |
| 3. | Sarkar FH, Li Y. Mechanisms of cancer chemoprevention by soy isoflavone genistein. Cancer Metastasis Rev. 2002;21:265-280. [PubMed] [DOI] |
| 4. | Kazi A, Daniel KG, Smith DM, Kumar NB, Dou QP. Inhibition of the proteasome activity, a novel mechanism associated with the tumor cell apoptosis-inducing ability of genistein. Biochem Pharmacol. 2003;66:965-976. [PubMed] [DOI] |
| 5. | Cui HB, Na XL, Song DF, Liu Y. Blocking effects of genistein on cell proliferation and possible mechanism in human gastric carcinoma. World J Gastroenterol. 2005;11:69-72. [PubMed] [DOI] |
| 6. | Nicholson KM, Anderson NG. The protein kinase B/Akt signalling pathway in human malignancy. Cell Signal. 2002;14:381-395. [PubMed] [DOI] |
| 7. | Whitley BR, Beaulieu LM, Carter JC, Church FC. Phosphatidylinositol 3-kinase/Akt regulates the balance between plasminogen activator inhibitor-1 and urokinase to promote migration of SKOV-3 ovarian cancer cells. Gynecol Oncol. 2007;104:470-479. [PubMed] [DOI] |
| 8. | Shin I, Arteaga CL. Expression of active Akt protects against tamoxifen-induced apoptosis in MCF-7 Cells. IUBMB Life. 2006;58:664-669. [PubMed] [DOI] |
| 9. | Yoon SO, Shin S, Lee HJ, Chun HK, Chung AS. Isoginkgetin inhibits tumor cell invasion by regulating phosphatidylinositol 3-kinase/Akt-dependent matrix metalloproteinase-9 expression. Mol Cancer Ther. 2006;5:2666-2675. [PubMed] [DOI] |
| 10. | Liu LZ, Hu XW, Xia C, He J, Zhou Q, Shi X, Fang J, Jiang BH. Reactive oxygen species regulate epidermal growth factor-induced vascular endothelial growth factor and hypoxia-inducible factor-1alpha expression through activation of AKT and P70S6K1 in human ovarian cancer cells. Free Radic Biol Med. 2006;41:1521-1533. [PubMed] [DOI] |
| 11. | Włodarski P, Grajkowska W, Łojek M, Rainko K, Jóźwiak J. Activation of Akt and Erk pathways in medulloblastoma. Folia Neuropathol. 2006;44:214-220. [PubMed] |
| 12. | Longo PG, Laurenti L, Gobessi S, Petlickovski A, Pelosi M, Chiusolo P, Sica S, Leone G, Efremov DG. The Akt signaling pathway determines the different proliferative capacity of chronic lymphocytic leukemia B-cells from patients with progressive and stable disease. Leukemia. 2007;21:110-120. [PubMed] [DOI] |
| 13. | Michl P, Downward J. Mechanisms of disease: PI3K/AKT signaling in gastrointestinal cancers. Z Gastroenterol. 2005;43:1133-1139. [PubMed] [DOI] |
| 14. | Lim WT, Zhang WH, Miller CR, Watters JW, Gao F, Viswanathan A, Govindan R, McLeod HL. PTEN and phosphorylated AKT expression and prognosis in early- and late-stage non-small cell lung cancer. Oncol Rep. 2007;17:853-857. [PubMed] [DOI] |
| 15. | Murakami D, Tsujitani S, Osaki T, Saito H, Katano K, Tatebe S, Ikeguchi M. Expression of phosphorylated Akt (pAkt) in gastric carcinoma predicts prognosis and efficacy of chemotherapy. Gastric Cancer. 2007;10:45-51. [PubMed] [DOI] |
| 16. | Dillon RL, White DE, Muller WJ. The phosphatidyl inositol 3-kinase signaling network: implications for human breast cancer. Oncogene. 2007;26:1338-1345. [PubMed] [DOI] |
| 17. | Hou P, Liu D, Shan Y, Hu S, Studeman K, Condouris S, Wang Y, Trink A, El-Naggar AK, Tallini G. Genetic alterations and their relationship in the phosphatidylinositol 3-kinase/Akt pathway in thyroid cancer. Clin Cancer Res. 2007;13:1161-1170. [PubMed] [DOI] |
| 18. | Shushan A, Ben-Bassat H, Mishani E, Laufer N, Klein BY, Rojansky N. Inhibition of leiomyoma cell proliferation in vitro by genistein and the protein tyrosine kinase inhibitor TKS050. Fertil Steril. 2007;87:127-135. [PubMed] [DOI] |
| 19. | Piao M, Mori D, Satoh T, Sugita Y, Tokunaga O. Inhibition of endothelial cell proliferation, in vitro angiogenesis, and the down-regulation of cell adhesion-related genes by genistein. Combined with a cDNA microarray analysis. Endothelium. 2006;13:249-266. [PubMed] [DOI] |
| 20. | Wang Y, Raffoul JJ, Che M, Doerge DR, Joiner MC, Kucuk O, Sarkar FH, Hillman GG. Prostate cancer treatment is enhanced by genistein in vitro and in vivo in a syngeneic orthotopic tumor model. Radiat Res. 2006;166:73-80. [PubMed] [DOI] |
| 21. | Sarkar FH, Adsule S, Padhye S, Kulkarni S, Li Y. The role of genistein and synthetic derivatives of isoflavone in cancer prevention and therapy. Mini Rev Med Chem. 2006;6:401-407. [PubMed] [DOI] |
| 22. | Puli S, Lai JC, Bhushan A. Inhibition of matrix degrading enzymes and invasion in human glioblastoma (U87MG) cells by isoflavones. J Neurooncol. 2006;79:135-142. [PubMed] [DOI] |
| 23. | Gu Y, Zhu CF, Iwamoto H, Chen JS. Genistein inhibits invasive potential of human hepatocellular carcinoma by altering cell cycle, apoptosis, and angiogenesis. World J Gastroenterol. 2005;11:6512-6517. [PubMed] [DOI] |
| 24. | Whitsett TG, Lamartiniere CA. Genistein and resveratrol: mammary cancer chemoprevention and mechanisms of action in the rat. Expert Rev Anticancer Ther. 2006;6:1699-1706. [PubMed] [DOI] |
| 25. | Hillman GG, Wang Y, Che M, Raffoul JJ, Yudelev M, Kucuk O, Sarkar FH. Progression of renal cell carcinoma is inhibited by genistein and radiation in an orthotopic model. BMC Cancer. 2007;7:4. [PubMed] [DOI] |
| 26. | Yang Y, Zhou ZT, Ge JP. Effect of genistein on DMBA-induced oral carcinogenesis in hamster. Carcinogenesis. 2006;27:578-583. [PubMed] [DOI] |
| 27. | Osaki M, Oshimura M, Ito H. PI3K-Akt pathway: its functions and alterations in human cancer. Apoptosis. 2004;9:667-676. [PubMed] [DOI] |
| 28. | Franke TF, Yang SI, Chan TO, Datta K, Kazlauskas A, Morrison DK, Kaplan DR, Tsichlis PN. The protein kinase encoded by the Akt proto-oncogene is a target of the PDGF-activated phosphatidylinositol 3-kinase. Cell. 1995;81:727-736. [PubMed] [DOI] |
| 29. | Okano J, Gaslightwala I, Birnbaum MJ, Rustgi AK, Nakagawa H. Akt/protein kinase B isoforms are differentially regulated by epidermal growth factor stimulation. J Biol Chem. 2000;275:30934-30942. [PubMed] [DOI] |
| 30. | Brunet A, Bonni A, Zigmond MJ, Lin MZ, Juo P, Hu LS, Anderson MJ, Arden KC, Blenis J, Greenberg ME. Akt promotes cell survival by phosphorylating and inhibiting a Forkhead transcription factor. Cell. 1999;96:857-868. [PubMed] [DOI] |
| 31. | Akiyama T, Ishida J, Nakagawa S, Ogawara H, Watanabe S, Itoh N, Shibuya M, Fukami Y. Genistein, a specific inhibitor of tyrosine-specific protein kinases. J Biol Chem. 1987;262:5592-5595. [PubMed] |