修回日期: 2006-10-20
接受日期: 2006-10-25
在线出版日期: 2007-01-08
目的: 研究形态基因Sonic hedgehog (Shh)以及IL-1β和TNF-α在H pylori相关性胃炎中表达的相关性及作用.
方法: ♂蒙古沙鼠50只给予悉尼菌株灌胃造成H pylori感染模型, 另设50只♂蒙古沙鼠作为对照. 应用RT-PCR的方法对沙鼠胃黏膜组织中的Shh, IL-1β以及TNF-α mRNA表达水平进行检测; 应用免疫组化的方法对于Shh蛋白进行细胞定位以及半定量分析其表达水平.
结果: H pylori灌胃36 和48 wk后, Shh mRNA表达水平明显降低(0.28 vs 0.48, t = 3.24, P<0.05; 0.18 vs 0.45, t = 3.01, P<0.05). Shh mRNA表达水平与IL-1β, TNF-α mRNA表达之间以及与炎症分级之间呈显著负相关(r = -0.37, P<0.01; r = -0.30, P<0.05; r = -0.39, P<0.001). Shh蛋白主要表达于胃体壁细胞胞质中, H pylori灌胃36和46 wk, 表达Shh抗原的阳性细胞数明显减少(Z = 4.84, P<0.001; Z = 4.57, P<0.001). Shh蛋白的表达与IL-1β mRNA, TNF-α mRNA的表达以及慢性炎症分级之间也呈显著负相关(r = -0.321, P<0.05; r = -0.313, P<0.05; r = -0.371, P<0.001).
结论: 蒙古沙鼠胃黏膜感染H pylori后, IL-1β和TNF-α表达上调, 并与炎症程度呈显著正相关; Shh表达下调, 并与炎症分级及IL-1β和TNF-α表达呈显著负相关.
引文著录: 李忠武, 刘鲁英, 田萌萌, 游伟程, 李吉友. 蒙古沙鼠幽门螺杆菌相关性胃炎Sonic hedgehog基因、IL-1β及TNF-α的表达. 世界华人消化杂志 2007; 15(1): 7-13
Revised: October 20, 2006
Accepted: October 25, 2006
Published online: January 8, 2007
AIM: To investigate the expression of morphogene Sonic hedgehog (Shh), interleukin-1β (IL-1β), tumor necrosis factor-α (TNF-α) in gastric epithelium of mongolian gerbils after H pylori inoculation and their correlations with the pathologic changes of Helicobacter pylori related gastritis.
METHODS: A total of 50 male mongolian gerbils were inoculated with H pylori and another 50 gerbils served as controls. The levels of Shh, IL-1β and TNF-α mRNA expression were detected by reverse transcription-polymerase chain reaction (RT-PCR), and the level of Shh protein expression was examined by immunohistochemistry 4, 12, 24, 36 and 48 weeks after inoculation.
RESULTS: As compared with those in the controls, both the expression levels of Shh mRNA and protein were decreased significantly at the 36th (t = 3.24, P < 0.05; Z = 4.84, P < 0.001) and 48th week (t = 3.01, P < 0.05; Z = 4.65, P < 0.001) after H pylori inoculation. Furthermore, the level of Shh mRNA expression was negatively correlated with the expression of IL-1β mRNA, TNF-α mRNA and the grade of gastritis, respectively (r = -0.372, P < 0.01; r = -0.301, P < 0.05; r = -0.397, P < 0.001). Similarly, the level of Shh protein expression was negatively correlated with the expression of IL-1β mRNA, TNF-α mRNA and the grade of gastritis (r = -0.321, P < 0.05; r = -0.313, P < 0.05; r = -0.371, P < 0.001) respectively.
CONCLUSION: After H pylori infection, the expression of IL-1β and TNF-α is increased and positively correlated with the grade of gastritis, and while the expression of Shh is decreased and negatively correlated with the expression of IL-1β, TNF-α and gastritis grades.
- Citation: Li ZW, Liu LY, Tian MM, You WC, Li JY. Expression of Sonic hedgehog gene, interleukin-1β, tumor necrosis factor-α in gastric epithelium of mongolian gerbils after H pylori inoculation. Shijie Huaren Xiaohua Zazhi 2007; 15(1): 7-13
- URL: https://www.wjgnet.com/1009-3079/full/v15/i1/7.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i1.7
幽门螺杆菌(H pylori)感染是非萎缩性胃炎、萎缩性胃炎和肠上皮化生发生的重要因素[1-7]. H pylori的毒力因子如cagA, vacA以及babA等与这些病变密切相关[8-14], 但他们引发的宿主反应以及上述病变的发病机制仍在探讨中. Sonic hedgehog(Shh)基因在胃肠道黏膜的发育以及维持黏膜的结构、形态、功能中发挥重要的作用. Shh基因敲除的小鼠, 胃黏膜上皮被能分泌碱性磷酸酶的肠上皮所取代[15]. 有研究发现, Shh基因在萎缩性胃炎及肠上皮化生中表达下调[16]. 这些结果提示, Shh基因可能在萎缩性胃炎及肠上皮化生病变中发挥着重要作用. 另外, Dimmler et al[17]在体外实验发现, 低pH值环境促进Shh基因在胃癌细胞系23132中的表达; 而在pH值升高的情况下, Shh基因的表达明显下调. IL-1β和TNF-α是胃酸分泌强有力的抑制因子, 引起胃内pH值升高[18-26], IL-1β和TNF-α与Shh基因表达水平之间可能存在一定的联系, 而这种联系可能在萎缩性胃炎以及肠上皮化生的发病过程中发挥着重要的作用. 我们以蒙古沙鼠经口灌服H pylori造成H pylori感染模型为实验对象, 检测IL-1β和TNF-α与Shh基因在H pylori相关性胃炎中的表达, 分析其表达水平与H pylori相关性胃炎分级的相关性及Shh表达与IL-1β和TNF-α表达之间的相关性, 探讨其在非萎缩性胃炎、萎缩性胃炎及肠上皮化生发生中可能的作用.
无菌6周龄SPF级♂蒙古沙鼠100只, 由浙江医学科学院提供, 随机分为对照组和实验组两组, 每组各50只. 禁食水12 h后, 实验组沙鼠给予(1015 CFU/L)H pylori(SS1, 悉尼菌株)悬浮液0.8 mL灌胃, 共3次, 每次间隔24 h; 对照组沙鼠只用相应的H pylori培养液灌胃. 分别于灌胃后4, 12, 24, 36和48 wk股动脉放血处死对照组及实验组沙鼠各5只. 将胃组织标本剪成两半, 一半固定于中性甲醛用于HE, Warthin-Starry银染及免疫组化染色, 另一半保存在-70℃冰箱用于RT-PCR检测.
胃组织石蜡切片厚度5 μm, HE染色显微镜观察, 按新悉尼标准对慢性胃炎的分级进行评判, 分为轻度、中度、重度3级. Warthin-Starry银染用以判断H pylori的感染状态. 免疫组化: 切片常规脱蜡至水; 浸泡于3 mL/L过氧化氢中10 min以消除内源性过氧化物酶; 将切片放入枸橼酸钠(0.01 mol/L, pH 6.5)抗原修复液中, 微波加热至100℃并维持10 min, 自然冷却; PBS清洗3遍; 滴加Shh抗体(1:100; sc1194, Santa Cruth, Calif, USA), 4℃过夜; 滴加羊抗兔二抗(111-035-003, Jackson, USA), 37℃孵育30 min; DAB(00-214, Zymed, USA)显色, 镜下控制显色时间, 充分水洗, 苏木素复染细胞核; 计数阳性区5个高倍视野(×400)下Shh表达阳性的细胞数, 用求得平均值表示Shh蛋白表达情况. 另按TRIzol(15596-026, Invitrogen, USA)试剂盒说明提取总RNA; 紫外分光光度计测定总RNA浓度及纯度; 应用逆转录试剂盒(A3500, Promega, USA)逆转录合成cDNA. 具体的步骤如下: 取总RNA 0.5 g/L, 在70℃条件下使其充分变性10 min, 然后将变性的RNA 2 μL, 4 μL MgCl2(25 mmol/L), 10×RT Buffer 2 μL, dNTP混合物(10 mmol/L) 2 μL, RNA酶抑制剂0.5 μL, 250 nkat逆转录酶, 随机引物0.5 μg充分混合, 42℃孵育60 min, 95℃ 5 min充分灭活逆转录酶. PCR反应体系为: 无菌蒸馏水16.25 μL, 10×Buffer 5 μL, MgCl2(25 mmol/L) 2.0 μL, dNTP(2.5 mmol/L) 1.0 μL, Taq聚合酶(Promega, Madison, WI)83.35 nkat, cDNA模板1.0 μL; 反应条件: 95℃预变性5 min, 94℃ 1 min, 特异退火温度40 s, 72℃ 1 min, 经30个循环, 72℃延伸10 min. 产物于20 g/L琼脂糖凝胶电泳, 溴化乙锭染色(10 mg/L)后, 通过美国Alphamager 2200凝胶成像系统对目的电泳条带进行图像分析; Shh, IL-1β, TNF-α目的条带与b-actin灰度的比值代表该基因的mRNA表达水平; Shh, IL-1β, TNF-α, β-actin特异性引物及其退火温度详见表1.
| 基因 | 引物序列 | 退火温度 | PCR产物 |
| IL-1β | F 5'-CTGAAAGCTCTCCACCTC-3' | 54.0℃ | 542 bp |
| R 5'-CTTTGAACAGAATGTGCC-3' | |||
| TNF-α | F 5'-CCATCGGACGGGCTGTACCTC-3' | 66.0℃ | 274 bp |
| R 5'-CTCGGCGCTGAGTCGGTCTC-3' | |||
| Shh | F 5'-GGCAGATACGAAGGGAAGAT-3' | 66.2℃ | 261 bp |
| R 5'-ACCGCTCGGCCCTCGTAGTG-3' | |||
| β-actin | F 5'-GCACCACACCTTCTACAATGAG-3' | 66.0℃ | 164 bp |
| R 5'-ATAGCACAGCCTGGATAGCAAC-3' |
统计学处理 采用SPSS 11.5统计学软件对数据进行处理. 两组之间Shh mRNA以及Shh蛋白表达情况的比较分别采用t检验和Wilcoxon秩和检验; 实验组不同时间点IL-1β, TNF-α mRNA表达情况的比较采用方差分析; 各基因表达与胃炎分级之间的相关性分析采用Spearman秩相关检验, 双侧P<0.05表明差异具有统计学意义.
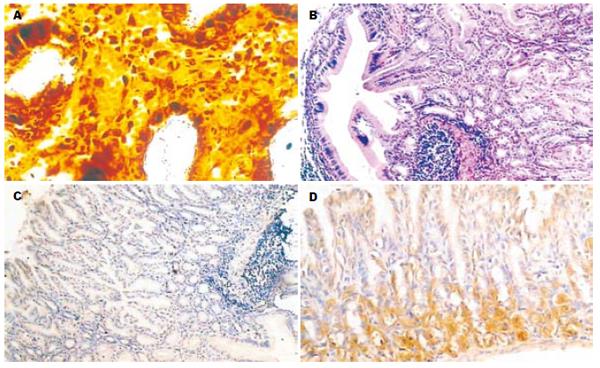
Warthin-Starry银染镜下观察发现, 实验组沙鼠H pylori感染均为阳性(图1A). 对照组沙鼠胃黏膜仅见少量的炎症细胞浸润. 在实验组中, H pylori灌胃4 wk后, 5只沙鼠胃黏膜固有层均可观察到轻度炎症细胞浸润, 以淋巴细胞和少量单核细胞为主, 中性粒细胞少见. 炎症反应以胃体与胃窦移行区为著. H pylori灌胃24, 36 wk后, 沙鼠胃黏膜可见重度慢性胃炎表现, 并伴有淋巴滤泡形成. H pylori灌胃48 wk后, 沙鼠胃黏膜除大量淋巴细胞浸润为特征的重度慢性胃炎改变外, 还可见囊性扩张的腺体(图1B). 对照组及实验组炎症分级见表2.
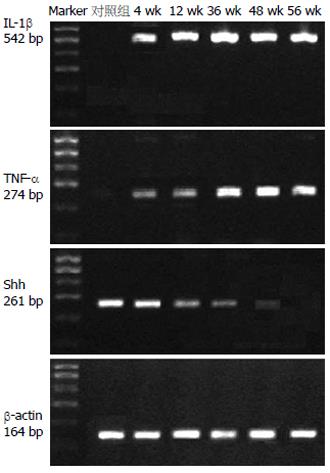
对照组沙鼠胃黏膜组织IL-1β, TNF-α mRNA的表达均为阴性. 实验组沙鼠胃黏膜组织在H pylori灌胃后4 wk即可观察到 IL-1β, TNF-α mRNA表达(图2). H pylori灌胃后36, 48 wk后, IL-1β, TNF-α mRNA表达水平较H pylori灌胃后4, 12, 24 wk显著升高(表2). IL-1β, TNF-α mRNA的表达与慢性炎症的分级呈显著正相关(rs = 0.433, P<0.01, rs = 0.456, P<0.01, 表3).
| Shh mRNA | IL-1β mRNA | TNF-α mRNA | 炎症分级 | |
| Shh mRNA | rs = -0.372, P<0.01 | rs = -0.301, P<0.05 | rs = -0.397, P<0.001 | |
| Shh protein | rs = 0.431, P<0.01 | rs = -0.321, P<0.05 | rs = -0.313, P<0.05 | rs = -0.371, P<0.001 |
| IL-1β mRNA | rs = -0.372, P<0.01 | rs = 0.422, P<0.01 | rs = 0.433, P<0.01 | |
| TNF-α mRNA | rs = -0.301, P<0.05 | rs = 0.422, P<0.01 | rs = 0.456, P<0.01 |
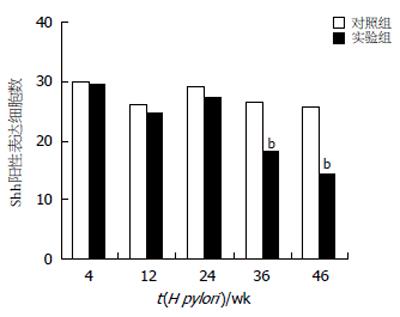
Shh mRNA以及蛋白的表达之间显著正相关(rs = 0.431, P<0.01). Shh mRNA表达水平在H pylori灌胃4, 12, 24 wk呈下降的趋势, 但是并未达到统计学意义. 与对照组相比, H pylori灌胃后36和48 wk, Shh mRNA表达水平显著降低(t = 3.240, P<0.05; t = 3.812, P<0.05, 表2). Shh mRNA的表达与IL-1β mRNA, TNF-α mRNA的表达以及慢性炎症分级之间均呈显著负相关(r = - 0.372, P<0.01; r = - 0.301, P<0.05; r = - 0.397, P<0.001, 表3). 免疫组化结果显示, Shh主要表达于胃体腺壁细胞的胞质中. 灌胃后4, 12, 24 wk的实验组与对照组相比, 表达Shh阳性细胞数没有统计学差异. 灌胃后第36和第48周, 实验组表达Shh抗原的阳性细胞数较同一时间点对照组明显减少(Z = 4.843, P<0.001; Z = 4.657, P<0.001, 图1C-D及图3). Shh蛋白的表达与IL-1β mRNA, TNF-α mRNA的表达以及慢性炎症分级之间呈显著负相关(r = - 0.321, P<0.05; r = - 0.313, P<0.05; r = - 0.371, P<0.001, 表3).
本研究结果显示, IL-1β, TNF-α mRNA在H pylori灌胃后4 wk就有所表达, 而且与慢性胃炎的分级正相关. 这表明IL-1, TNF-α在H pylori相关性胃炎的早期就发挥作用. 有研究表明, IL-1, TNF-α与NF-kB可以形成自我激活的循环联系, 并且与NF-kB所调控的下游众多趋化因子如: IL-8, MCP-1, RANTES和MIP-1a等共同构成复杂的细胞因子网络, 增强和放大H pylori感染后胃黏膜的炎症反应, 加重胃黏膜的损伤[27].
Shh基因是胃肠道发育过程中有着重要作用的形态基因. Shh与其特异性受体Patched(Ptc)结合以后, 可以移除Ptc对另一种转录蛋白Smoothened(Smo)的抑制作用, 并最终通过Gli家族发挥转录调控作用. 有研究表明, Shh蛋白主要表达于胃体腺壁细胞中, 在H pylori感染阳性的患者, Shh蛋白表达明显下调, 而且该蛋白的表达下调与萎缩及肠化病变严重程度之间存在显著正相关[16]. Suzuki et al[28]的研究结果显示, 蒙古沙鼠在H pylori感染后51 wk, Shh基因表达显著下调, 而且该基因的表达与壁细胞的丢失及腺颈部细胞的分化受阻呈显著正相关. 在本实验中, 虽未观察到明显的萎缩及肠化等病变, 但是Shh mRNA以及蛋白的表达在H pylori灌胃后36和48 wk显著下调, 且与IL-1β, TNF-α mRNA的表达以及胃黏膜的炎症反应分级之间存在着显著负相关. 有研究表明, IL-1β和TNF-α是胃酸分泌强有力的抑制因子[18-26]. 而胃内pH值对于Shh基因表达至关重要, 在pH值升高的情况下Shh基因表达明显下调[17]. 所以本实验中Shh基因的表达下调可能与IL-1β和TNF-α抑制胃酸分泌, 胃内的pH值升高有关.
本实验结果显示, Shh基因主要表达于沙鼠胃体黏膜壁细胞胞质中, 这与以往研究报道一致[28]. 壁细胞通过Shh-Ptc信号通路在调节主细胞以及胃腺体其他细胞的分化、维持其功能方面发挥着重要作用[29-30]. 与以往的研究结果不同的是, 在本实验中, 形态基因Shh表达在萎缩性胃炎与肠上皮化生发生之前就已经发生改变. Canfield et al[31]发现, 敲除壁细胞的转基因小鼠, 其主细胞系的分化也会受到抑制. 我们发现, Shh基因显示表达下调, 可能会影响到胃黏膜腺体的其他成分(如主细胞等)在受到炎症损伤后的再生, 从而不利于胃黏膜腺体修复而发生萎缩. 另外, 有研究表明, Shh基因敲除的小鼠, 其胃黏膜上皮细胞被肠上皮细胞所取代[15]. 所以, Shh基因在H pylori感染后的表达下调, 还可能是肠上皮化生发生的重要原因之一. 因而, Shh基因表达下调, 也有可能成为预测萎缩性胃炎以及肠上皮化生发生的一个重要的生物标记物. 本研究结果显示, H pylori感染蒙古沙鼠胃黏膜, IL-1β和TNF-α等前炎症性细胞因子的表达上调, 并与炎症程度正相关; 同时发现, 形态基因Shh表达下调, 并与炎症分级及IL-1β和TNF-α等前炎症性细胞因子的表达水平呈显著负相关, 这可能与IL-1β和TNF-α抑制胃酸的分泌相关. Shh的表达下调, 可能是萎缩性胃炎和肠化生的前驱, 他发生于组织学上出现萎缩性胃炎和肠上皮化生病变之前, 即Shh的表达下调继之可能导致萎缩性胃炎和肠化生的发生, 这有待于进一步研究证实.
幽门螺杆菌(H pylori)感染是非萎缩性胃炎、萎缩性胃炎和肠上皮化生发生的重要因素. Sonic hedgehog(Shh)基因在胃肠道黏膜的发育以及维持黏膜的结构、形态、功能中发挥重要的作用, 有研究报道, Shh基因在H pylori感染后表达下调. 在H pylori感染后, IL-1β和TNF-α显著上调, 并可能通过抑制胃酸分泌而引发相应的病理学变化.
关于Shh基因的研究主要侧重于如前列腺癌、基底细胞癌、乳腺癌、胃肠道等肿瘤的研究以及胃肠道等器官的发育两方面. IL-1β和TNF-α是H pylori相关性胃炎中重要的前炎症性细胞因子.
Shiotani A et al报道Shh蛋白主要表达于人胃体腺壁细胞中, 而且该蛋白的表达下调与萎缩及肠化病变严重程度之间存在显著正相关. Suzuki et al的研究结果显示, 蒙古沙鼠在H pylori感染后51 wk, Shh基因表达显著下调, 而且该基因的表达与壁细胞的丢失及腺颈部细胞的分化受阻呈显著正相关. Beales IL et al报道IL-1β和TNF-α是胃酸分泌强有力的抑制因子.
以往研究只侧重于Shh基因表达或宿主免疫反应与形态学变化单方面的研究, 而本实验将Shh基因以及IL-1β, TNF-α的表达结合在一起, 研究了在H pylori感染后不同阶段, 形态基因Shh以及宿主免疫反应动态变化, 并初步探讨了萎缩性胃炎和肠上皮化生的发病机制.
本实验中, Shh表达在H pylori感染后下调, 可能与IL-1β和TNF-α抑制胃酸的分泌相关. 而Shh基因表达下调, 有可能作为预测萎缩性胃炎以及肠上皮化生发生的一个重要的生物标记物.
hedgehog基因: 是一种分泌性的分子, 他能通过自我剪切而形成活性N末端再经过二分子一胆固醇修饰而发挥作用.脊椎动物体内存在三种hedgehog基因的同分异构体, 分别为Sonic hedgehog(Shh), Desert hedgehog (Dhh), Indian hedgehog(Ihh). Shh的相关报道最多, 他与中枢神经系统、四肢、肺脏、胃、牙齿的发育相关. Dhh和Ihh则分别与生殖系统以及骨骼系统的发育相关.
本文对蒙古沙鼠幽门螺杆菌相关性胃炎的研究方法先进, 结论可靠, 有理论价值和使用价值, 具有国内领先水平.
电编: 张敏 编辑: 潘伯荣
| 1. | Leodolter A, Ebert MP, Peitz U, Wolle K, Kahl S, Vieth M, Malfertheiner P. Prevalence of H pylori associated "high risk gastritis" for development of gastric cancer in patients with normal endoscopic findings. World J Gastroenterol. 2006;12:5509-5512. [PubMed] [DOI] |
| 2. | Perry S, Sanchez L, Yang S, Haggerty TD, Hurst P, Parsonnet J. Helicobacter pylori and risk of gastroenteritis. J Infect Dis. 2004;190:303-310. [PubMed] [DOI] |
| 3. | Prinz C, Schwendy S, Voland P. H pylori and gastric cancer: shifting the global burden. World J Gastroenterol. 2006;12:5458-5464. [PubMed] [DOI] |
| 4. | Trautmann K, Stolte M, Miehlke S. Eradication of H pylori for the prevention of gastric cancer. World J Gastroenterol. 2006;12:5101-5107. [PubMed] |
| 5. | Beswick EJ, Suarez G, Reyes VE. H pylori and host interactions that influence pathogenesis. World J Gastroenterol. 2006;12:5599-5605. [PubMed] [DOI] |
| 6. | Beyer BC, Heiss MM, Simon EH, Gruetzner KU, Babic R, Jauch KW, Schildberg FW, Allgayer H. Urokinase system expression in gastric carcinoma: prognostic impact in an independent patient series and first evidence of predictive value in preoperative biopsy and intestinal metaplasia specimens. Cancer. 2006;106:1026-1035. [PubMed] [DOI] |
| 7. | Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper RJ. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med. 2001;345:784-789. [PubMed] [DOI] |
| 8. | Rad R, Prinz C, Neu B, Neuhofer M, Zeitner M, Voland P, Becker I, Schepp W, Gerhard M. Synergistic effect of Helicobacter pylori virulence factors and interleukin-1 polymorphisms for the development of severe histological changes in the gastric mucosa. J Infect Dis. 2003;188:272-281. [PubMed] [DOI] |
| 9. | Broutet N, Moran A, Hynes S, Sakarovitch C, Mégraud F. Lewis antigen expression and other pathogenic factors in the presence of atrophic chronic gastritis in a European population. J Infect Dis. 2002;185:503-512. [PubMed] [DOI] |
| 10. | Beswick EJ, Pinchuk IV, Suarez G, Sierra JC, Reyes VE. Helicobacter pylori CagA-dependent macrophage migration inhibitory factor produced by gastric epithelial cells binds to CD74 and stimulates procarcinogenic events. J Immunol. 2006;176:6794-6801. [PubMed] [DOI] |
| 11. | Murakami K, Kodama M, Fujioka T. Latest insights into the effects of Helicobacter pylori infection on gastric carcinogenesis. World J Gastroenterol. 2006;12:2713-2720. [PubMed] [DOI] |
| 12. | Leung WK, Chan MC, To KF, Man EP, Ng EK, Chu ES, Lau JY, Lin SR, Sung JJ. H. pylori genotypes and cytokine gene polymorphisms influence the development of gastric intestinal metaplasia in a Chinese population. Am J Gastroenterol. 2006;101:714-720. [PubMed] [DOI] |
| 13. | Ohnita K, Isomoto H, Honda S, Wada A, Wen CY, Nishi Y, Mizuta Y, Hirayama T, Kohno S. Helicobacter pylori strain-specific modulation of gastric inflammation in Mongolian gerbils. World J Gastroenterol. 2005;11:1549-1553. [PubMed] [DOI] |
| 14. | Rad R, Dossumbekova A, Neu B, Lang R, Bauer S, Saur D, Gerhard M, Prinz C. Cytokine gene polymorphisms influence mucosal cytokine expression, gastric inflammation, and host specific colonisation during Helicobacter pylori infection. Gut. 2004;53:1082-1089. [PubMed] [DOI] |
| 15. | Ramalho-Santos M, Melton DA, McMahon AP. Hedgehog signals regulate multiple aspects of gastrointestinal development. Development. 2000;127:2763-2772. [PubMed] |
| 16. | Shiotani A, Iishi H, Uedo N, Ishiguro S, Tatsuta M, Nakae Y, Kumamoto M, Merchant JL. Evidence that loss of sonic hedgehog is an indicator of Helicobater pylori-induced atrophic gastritis progressing to gastric cancer. Am J Gastroenterol. 2005;100:581-587. [PubMed] [DOI] |
| 17. | Dimmler A, Brabletz T, Hlubek F, Häfner M, Rau T, Kirchner T, Faller G. Transcription of sonic hedgehog, a potential factor for gastric morphogenesis and gastric mucosa maintenance, is up-regulated in acidic conditions. Lab Invest. 2003;83:1829-1837. [PubMed] [DOI] |
| 18. | Takashima M, Furuta T, Hanai H, Sugimura H, Kaneko E. Effects of Helicobacter pylori infection on gastric acid secretion and serum gastrin levels in Mongolian gerbils. Gut. 2001;48:765-773. [PubMed] [DOI] |
| 19. | Beales IL, Calam J. Interleukin 1 beta and tumour necrosis factor alpha inhibit acid secretion in cultured rabbit parietal cells by multiple pathways. Gut. 1998;42:227-234. [PubMed] [DOI] |
| 20. | Furuta T, El-Omar EM, Xiao F, Shirai N, Takashima M, Sugimura H. Interleukin 1beta polymorphisms increase risk of hypochlorhydria and atrophic gastritis and reduce risk of duodenal ulcer recurrence in Japan. Gastroenterology. 2002;123:92-105. [PubMed] [DOI] |
| 21. | Kusters JG, van Vliet AH, Kuipers EJ. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev. 2006;19:449-490. [PubMed] [DOI] |
| 22. | Troost E, Hold GL, Smith MG, Chow WH, Rabkin CS, McColl KE, El-Omar EM. The role of interleukin-1beta and other potential genetic markers as indicators of gastric cancer risk. Can J Gastroenterol. 2003;17 Suppl B:8B-12B. [PubMed] |
| 23. | Machado JC, Figueiredo C, Canedo P, Pharoah P, Carvalho R, Nabais S, Castro Alves C, Campos ML, Van Doorn LJ, Caldas C. A proinflammatory genetic profile increases the risk for chronic atrophic gastritis and gastric carcinoma. Gastroenterology. 2003;125:364-371. [PubMed] [DOI] |
| 24. | Muramatsu A, Azuma T, Okuda T, Satomi S, Ohtani M, Lee S, Suto H, Ito Y, Yamazaki Y, Kuriyama M. Association between interleukin-1beta-511C/T polymorphism and reflux esophagitis in Japan. J Gastroenterol. 2005;40:873-877. [PubMed] [DOI] |
| 25. | Klausz G, Buzás E, Scharek P, Tiszlavicz L, Gyulai Z, Fülöp AK, Falus A, Mándi Y. Effects of Helicobacter pylori infection on gastric inflammation and local cytokine production in histamine-deficient (histidine decarboxylase knock-out) mice. Immunol Lett. 2004;94:223-228. [PubMed] [DOI] |
| 26. | Hopman WP, de Jong DJ, Naber AH, Jansen JB. Tumour necrosis factor alpha antibody affects gastrin release in Crohn disease. Scand J Gastroenterol. 2003;38:522-525. [PubMed] [DOI] |
| 27. | Isomoto H, Mizuta Y, Miyazaki M, Takeshima F, Omagari K, Murase K, Nishiyama T, Inoue K, Murata I, Kohno S. Implication of NF-kappaB in Helicobacter pylori-associated gastritis. Am J Gastroenterol. 2000;95:2768-2776. [PubMed] [DOI] |
| 28. | Suzuki H, Minegishi Y, Nomoto Y, Ota T, Masaoka T, van den Brink GR, Hibi T. Down-regulation of a morphogen (sonic hedgehog) gradient in the gastric epithelium of Helicobacter pylori-infected Mongolian gerbils. J Pathol. 2005;206:186-197. [PubMed] [DOI] |
| 29. | van den Brink GR, Hardwick JC, Tytgat GN, Brink MA, Ten Kate FJ, Van Deventer SJ, Peppelenbosch MP. Sonic hedgehog regulates gastric gland morphogenesis in man and mouse. Gastroenterology. 2001;121:317-328. [PubMed] [DOI] |
| 30. | van den Brink GR, Hardwick JC, Nielsen C, Xu C, ten Kate FJ, Glickman J, van Deventer SJ, Roberts DJ, Peppelenbosch MP. Sonic hedgehog expression correlates with fundic gland differentiation in the adult gastrointestinal tract. Gut. 2002;51:628-633. [PubMed] [DOI] |
| 31. | Canfield V, West AB, Goldenring JR, Levenson R. Genetic ablation of parietal cells in transgenic mice: a new model for analyzing cell lineage relationships in the gastric mucosa. Proc Natl Acad Sci U S A. 1996;93:2431-2435. [PubMed] [DOI] |