修回日期: 2006-10-10
接受日期: 2006-10-18
在线出版日期: 2007-01-08
目的: 通过改变碱性成纤维细胞生长因子(bFGF)作用于LoVo细胞的时间, 检测PKB活性和Cyclin A的表达情况, 进一步研究bFGF通过PI3-K/PKB通路调控大肠癌细胞生长的信号转导机制.
方法: MTT法分析bFGF对LoVo细胞增殖程度的影响; (γ-32P)ATP掺入法检测大肠癌LoVo细胞株中PKB的活性; RT-PCR法检测大肠癌LoVo细胞株中Cyclin A的表达; Western blot法检测bFGF作用LoVo细胞后Cyclin A的表达.
结果: bFGF以不同时间作用于LoVo细胞时, 通过(γ-32P)ATP掺入法检测发现其可提高细胞PKB活性, PI3-K的抑制剂LY294002预处理后再施加bFGF, 可显著降低PKB的活性, 两者相比差异显著[704.32±12.35 pmol/(mg·min) vs 1352.79±19.85 pmol/(mg·min), P<0.05]. bFGF刺激LoVo细胞时Cyclin A蛋白和Cyclin A mRNA表达均高于其他各施加因素组, 而PI3-K的抑制剂LY294002组的Cyclin A蛋白和Cyclin A mRNA明显降低.
结论: bFGF刺激大肠LoVo细胞后可通过依赖PI3-K/PKB途径调节Cyclin A的转录活性, 促进其表达, 进而促进细胞增殖.
引文著录: 周颖, 王桂玲. bFGF促进人大肠癌LoVo细胞增殖的信号转导机制. 世界华人消化杂志 2007; 15(1): 34-38
Revised: October 10, 2006
Accepted: October 18, 2006
Published online: January 8, 2007
AIM: To investigate the activity of protein kinase B (PKB) and the expression of Cyclin A in colorectal cancer LoVo cell line after treatment of basic fibroblast growth factor (bFGF), and to further analyze the signal transduction mechanism of bFGF in regulating the growth of LoVo cells via PI3-K/PKB pathway.
METHODS: Colorectal cancer cell line LoVo was cultured in vitro using routine method, and then treated with bFGF, LY294002 (inhibitor of PI3-K), and bFGF plus LY294002, respectively. MTT assay was used to determine the proliferaion of LoVo cells; PKB activity in LoVo cells was measured by (γ-32P)ATP incorporation assay; Cyclin A mRNA expression was examined by reverse transcription-polymerase chain reaction (RT-PCR); Cyclin A protein expression was detected by Western blot.
RESULTS: The activity of PKB was increased in LoVo cells after bFGF treatment at different time, but it was decreased by LY294002 pre-treatment [704.32 ± 12.35 pmol/(mg·min) vs 1352.79 ± 19.85 pmol/(mg·min), P < 0.05]. The expression of Cyclin A was significantly increased at both protein and mRNA levels in the cells treated by bFGF, but the up-regulation of Cyclin A was obviously inhibited by LY294002 pre-treatment.
CONCLUSION: Via PI3-K/PKB pathway, bFGF can regulate the transcriptional activity of Cyclin A and modulate its expression in LoVo cells, which may promote the proliferation of colorectal cancer cells.
- Citation: Zhou Y, Wang GL. Signal transduction mechanism of basic fibroblast growth factor in promoting the growth of colorectal cancer LoVo cell line. Shijie Huaren Xiaohua Zazhi 2007; 15(1): 34-38
- URL: https://www.wjgnet.com/1009-3079/full/v15/i1/34.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i1.34
碱性成纤维细胞生长因子(bFGF)作为一种细胞丝裂原和促血管生成因子, 在许多肿瘤的生长中起着重要的作用[1-2]. 他对神经胶质瘤、白血病、肺癌、肝癌等细胞具有促增殖分化的功能, 但对大肠癌细胞这方面的研究报道很少. 目前认为, bFGF不仅可以促进肿瘤血管的生成, 在肿瘤的发生、发展中起着重要作用, 而且对肿瘤细胞具有促增殖作用[3]. 大肠癌是常见恶性肿瘤之一, 手术治疗仍是大肠癌首选治疗方法. 但相当一部分在发现时已出现浸润或转移, 即便手术切除之后仍有复发, 对放疗和化疗的治疗效果亦不甚理想. 关于bFGF通过PI3-K/PKB信号途径调控大肠癌细胞生长的具体机制仍不清楚[4]. 我们通过改变bFGF作用于LoVo细胞的时间, 检测PKB活性和Cyclin A的表达情况, 进一步研究bFGF通过PI3-K/PKB通路调控大肠癌细胞生长的信号转导机制, 以抑制肿瘤细胞增殖, 诱导肿瘤细胞凋亡, 这为治疗大肠癌提供了新思路.
LoVo细胞株购自中科院上海细胞所; DMEM培养基(Gibcolbrl公司); 小牛血清(华美生物工程公司); 扶济复(重组人bFGF, 北京双鹭药业有限公司); LY294002(美国Sigma公司); TRLzol(Life-Technology公司); Cyclin A(美国NeoMarkers公司)及PKB(SANTA CRUZ)一抗, 羊抗鼠及兔抗羊辣根过氧化物酶标记的二抗和ECL试剂盒(北京中山生物技术公司), TaKaRa RNA PCR试剂盒(大连宝生物工程有限公司).
1.2.1 细胞培养: 将低温冷冻的大肠癌LoVo细胞株常规方法制成均匀细胞悬液(8×107/L)37℃, 50 mL/L CO2孵箱中培养. 24 h换液密度达到106个以上时收集对数生长期细胞, 以6×107/L接种于培养瓶, 每24 h换液一次.
1.2.2 实验分组及施加实验因素: 将培养的大肠癌细胞按随机原则分为: (1)空白对照(作为bFGF及LY294002组的对照); (2)bFGF组: 观察bFGF对细胞的作用; (3)LY294002组: 观察LY294002对细胞的作用; (4)bFGF+LY294002组: 观察bFGF及LY294002同时施加时对细胞的作用.
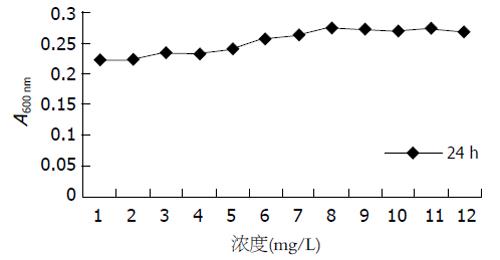
1.2.3 MTT比色: 胰酶消化处于对数增殖期的细胞, 以5×103个细胞/孔接种于96孔板, 在37℃, 50 mL/L CO2, 及饱和湿度的条件下恒温密闭培养. 按分组要求加入肝素8 μL(2 g/L)和含有不同浓度的bFGF培养液, 使各孔终体积均为200 μL. 将96孔板放回孵箱, 3 d后倾出培养液, 每孔加MTT溶液(5 g/L)20 μL. 继续孵育4 h, 每孔加入150 μL DMSO, 振荡10 min, 用酶联免疫检测仪读取每孔A值(测量波长600 nm, 参考波长570 nm), 绘制细胞生长曲线, 根据公式B/A×100%计算细胞的增殖、抑制率(A, B分别为对照组和实验组的光密度值). 实验重复3次, 每浓度均设3孔.
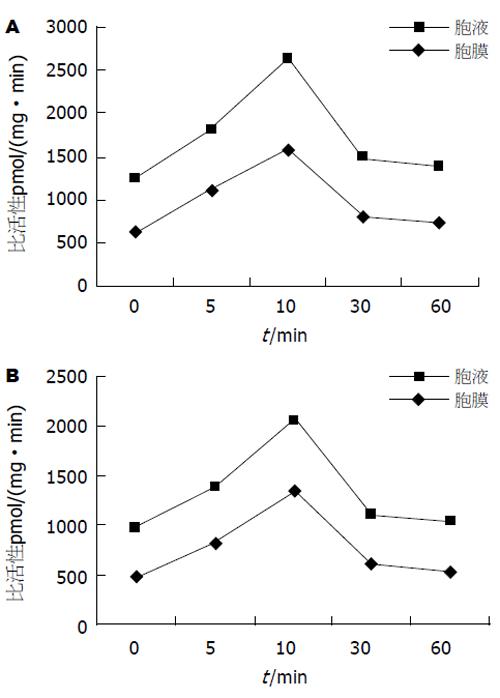
1.2.4 (g-32P)ATP掺入法检测大肠癌LoVo细胞株中PKB的活性: 实验分组: 根据预实验结果确定对LoVo细胞不同浓度bFGF处理时间为4 h, bFGF浓度分别为0, 25, 50, 75, 100 μg/L. 进行3次重复测定, 对结果进行统计学处理. PKB活性测定方法: 将-70℃保存的样品取出融化, 超声波处理30 s, 离心(35 000 g, 60 min), 上清液用于胞液PKB测定, 沉淀用150 μL匀浆缓冲液溶解后, 作膜性PKB测定. 反应完成后取25 μL在WhatmanP81强阳离子交换滤纸上, 放入75 mmol/L磷酸溶液终止反应, 并用此磷酸液反复洗3次, 每次2 min, 取出晾干, 放入预装有9 mL蒸馏水的液闪瓶中, 液闪仪测定cpm数. PKB比活性计算方法: PKB比活性 = (CPM数-本底CPM数)/总放射性×ATP浓度/时间(min)/蛋白量.
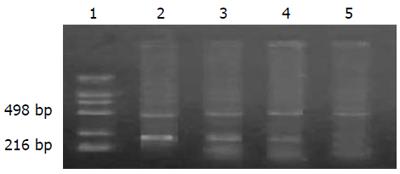
1.2.5 RT-PCR检测Cyclin A的表达: 细胞总RNA提取, 在设定条件下进行逆转录反应. PCR扩增后的产物, 取8 μL进行聚丙烯酰胺凝胶电泳, 凝胶成像仪扫描摄影, 用b-actin作为参照标化各组中Cyclin A的含量.
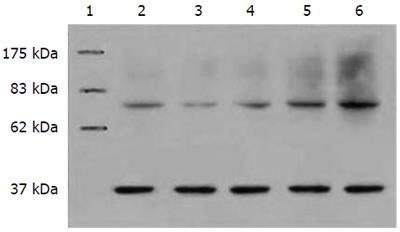
1.2.6 Western blot检测Cyclin A的表达: 收集细胞, 进行裂解, 蛋白定量采用考马斯亮蓝定量法. 取各组细胞40 μg总蛋白上样于100 g/L SDS-PAGE电泳分离后, 电转移至硝酸纤维素膜上, 转印膜在封闭液中封闭过夜. 分别用Cyclin A和GAPDH一抗, 37℃孵育2 h, 洗膜, 加上兔抗羊和羊抗鼠辣根过氧化物酶标二抗, 孵育1 h, TTBS洗2次, TBS洗1次. 化学发光试剂ECL A液和B液等量混合, 按0.125 mL/cm2膜面积点于转印膜上, 室温孵育1 min, 倾掉ECL, 保鲜膜覆盖后置暗盒中曝光40 s至1 min, 冲洗胶片, 可重复曝光. X光片扫描成像, 经凝胶自动分析成像系统分析各样品灰度值.
统计学处理 根据分析采用SPSS 10.0软件包中进行统计处理, t检验来判断差异的统计学意义, P<0.05具有显著性.
(1)12 h A值变化不明显, 24 h细胞开始随浓度增大而增加(图1), 36 h细胞数随着浓度加大而下降, 48 h细胞数量下降更加明显; (2)48, 36 h第一个空白孔A值相似, 12, 24 h第一个空白孔A值相似, 两个A值差异显著, 这说明此细胞的增殖周期为30 h左右.
当采用外源性bFGF(50 μg/L)以不同时间作用于LoVo细胞时, 通过(g-32P)ATP掺入法检测发现, 其可提高细胞PKB活性(图2A). LY294002(100 nmol/L)预处理1 h后再施加bFGF, 可显著降低PKB的活性, 单因素方差分析表明, LY294002预处理组和未做预处理组之间差异有显著性[704.32±12.35 pmol/(mg·min) vs 1352.79±19.85 pmol/(mg·min), P<0.05], 说明bFGF可通过PI3-K调控PKB的活性(图2B).
当外源性bFGF(50 μg/L)以不同时间作用于LoVo细胞时, Cyclin A表达增加, 在30 min时达到高峰, 与未处理相比升高1倍, 用LY294002预处理1 h后施加bFGF, 发现Cyclin A表达减少, 说明, bFGF可通过PI3-K调节Cyclin A表达增加(图3).
bFGF刺激LoVo细胞时Cyclin A蛋白表达都高于其他各施加因素组, LY294002抑制组蛋白明显降低(图4), 从而也证实bFGF引起LoVo细胞Cyclin A的蛋白表达是通过PKB之途径而介导.
关于FGF的细胞内转导通路虽然早有报道[1-2], 但至今为止, 人们对其调节仍然没有统一认识. bFGF作为一种细胞有丝分裂原和促血管生成因子, 可以直接刺激内皮细胞的增生, 促进内皮细胞产生蛋白酶, 调节内皮细胞的迁移, 从而促进肿瘤血管生成, 在许多肿瘤的生长中起着重要的作用[3-5]. bFGF不仅可以促进肿瘤血管的生成, 而且对肿瘤细胞有促增殖的作用. 许多研究表明, bFGF能够促进细胞恶性转化及肿瘤形成[6-10].
蛋白激酶B(protein kinase B, PKB)是丝氨酸/苏氨酸蛋白激酶, PKB是磷脂酰肌醇3-激酶(phosphatidylinositol3-Kinase, PI3- Kinase)的直接下游靶蛋白, PKB就成为信号转导深入研究的焦点[11]. PKB在蛋白质和脂类合成、葡萄糖代谢与运输、细胞周期、凋亡和肿瘤转化等方面发挥重要的作用, 处于多个信号转导通路的交叉点, 成为生长因子介导的PI3-K信号转导通路中的重要组成因子[22-27], 尤为重要的是PKB介导细胞存活而且在恶性肿瘤发生中也是关键的因素[12-13]. PKB蛋白的过度活化可使细胞发生恶性转化, 在不同的肿瘤如胰腺癌、甲状腺癌、大肠癌、卵巢癌和乳腺癌等均发现PKB的过度活化, 提示PKB在肿瘤细胞恶性行为中起重要的作用[14-19]. 体外实验发现, 不仅PKB水平在人肺癌癌前病变细胞和肺癌细胞中明显高于正常支气管上皮细胞, 而且PKB在前两者中处于持续活化状态, 在后者中却处于非活化状态, 提示PKB在肺癌的发生过程中可能起重要作用[20-21].
本实验研究表明, 当采用外源性bFGF (50 μg/L)以不同时间作用于LoVo细胞时, 通过(g-32P)ATP掺入法检测发现, 其可提高细胞PKB活性. 而PI3-K的抑制剂LY294002预处理1 h后再施加bFGF[32], 可显著降低PKB的活性, 单因素方差分析表明, LY294002预处理组和未做预处理组之间差异有显著性, 说明bFGF可通过PI3-K调控PKB的活性. 随着对细胞周期调控认识的不断深入, 出现了"癌症可能是一类细胞周期性疾病"的观点! 因为, 在多种肿瘤细胞都存在着若干细胞周期调控因子的改变. 而肿瘤的发生、发展和恶变与细胞周期调控失控密切相关. 周期素是一类存在于细胞周期的不同阶段, 能够活化CDK的蛋白, 是细胞得以通过细胞周期的各个阶段所必需的. Cyclin A是一类在哺乳动物细胞S期和G2/M期两个调节点均起重要作用的蛋白. Cyclin A在S期可以检测到, 在进入G2期含量增加, 是细胞增殖的有用标记物[28-29]. 在多种肿瘤中可检测到周期素A表达的增加, 提示与肿瘤增殖状态密切相关[30-31].
我们采用外源性bFGF处理LoVo细胞, 显示bFGF能促进Cyclin A mRNA水平的提高, 导致Cyclin A的表达增加. 已知Cyclin A属S期和G2期达峰值[28-29], PI3-K抑制剂LY294002预处理的细胞, 经bFGF刺激后, 在各时间点Cyclin A mRNA水平均下降, 同时Cyclin A表达水平也降低, 表明bFGF对LoVo细胞周期素A表达的影响是通过影响其转录活性实现的, 而且这种调节作用依赖于PI3-K/PKB途径. 我们通过体外实验证明, PI3-K/PKB途径可介导bFGF对LoVo细胞的促增殖作用, 通过调节Cyclin A的转录活性促进其表达而促进细胞增殖. 进一步的体内研究如能证实内源性bFGF通过PI3-K/PKB途径影响Cyclin A表达, 将为在信号转导通路的不同水平上的肿瘤治疗提供新思路和新方法.
近年来, 肿瘤的发生与细胞生长因子关系已日益受到重视. 碱性成纤维细胞生长因子(bFGF)作为一种细胞丝裂原和促血管生成因子, 在许多肿瘤的生长中起着重要的作用, 研究证明bFGF与多种肿瘤发生密切相关.
肿瘤细胞信号转导特别是细胞生长因子与肿瘤发生的信号转导更是该领域的研究热点, bFGF通过PI3-K/PKB通路调控大肠癌细胞生长的信号转导机制是其中之一.
目前国内外关于bFGF在大肠癌组织中的表达及临床意义的研究较多, 而关于bFGF通过PI3-K/PKB信号途径调控大肠癌细胞生长的具体机制研究不多并还不清楚. 本文通过改变bFGF作用于LoVo细胞的时间, 检测PKB活性和Cyclin A的表达情况, 进一步研究bFGF通过PI3-K/PKB通路调控大肠癌细胞生长的信号转导机制.
研究bFGF通过PI3-K/PKB通路调控大肠癌细胞生长的信号转导机制, 以抑制肿瘤细胞增殖, 诱导肿瘤细胞凋亡, 这为治疗大肠癌提供了新思路.
本文目的明确, 行文流畅, 各部分内容简洁明了, 理论价值较高.
电编: 张敏 编辑: 王晓瑜
| 1. | Tsang M, Friesel R, Kudoh T, Dawid IB. Identification of Sef, a novel modulator of FGF signalling. Nat Cell Biol. 2002;4:165-169. [PubMed] [DOI] |
| 2. | Okada-Ban M, Thiery JP, Jouanneau J. Fibroblast growth factor-2. Int J Biochem Cell Biol. 2000;32:263-267. [PubMed] [DOI] |
| 3. | Dow JK, deVere White RW. Fibroblast growth factor 2: its structure and property, paracrine function, tumor angiogenesis, and prostate-related mitogenic and oncogenic functions. Urology. 2000;55:800-806. [PubMed] [DOI] |
| 4. | Lundin L, Rönnstrand L, Cross M, Hellberg C, Lindahl U, Claesson-Welsh L. Differential tyrosine phosphorylation of fibroblast growth factor (FGF) receptor-1 and receptor proximal signal transduction in response to FGF-2 and heparin. Exp Cell Res. 2003;287:190-198. [PubMed] [DOI] |
| 5. | Fenig E, Kanfi Y, Wang Q, Beery E, Livnat T, Wasserman L, Lilling G, Yahalom J, Wieder R, Nordenberg J. Role of transforming growth factor beta in the growth inhibition of human breast cancer cells by basic fibroblast growth factor. Breast Cancer Res Treat. 2001;70:27-37. [PubMed] [DOI] |
| 6. | Jang JH, Chung CP. A novel splice variant of fibroblast growth factor receptor 2 in human leukemia HL-60 cells. Blood Cells Mol Dis. 2002;29:133-137. [PubMed] [DOI] |
| 7. | Zhao J, Miao J, Zhao B, Zhang S, Yin D. Suppressing Akt phosphorylation and activating Fas by safrole oxide inhibited angiogenesis and induced vascular endothelial cell apoptosis in the presence of fibroblast growth factor-2 and serum. Int J Biochem Cell Biol. 2006;38:1603-1613. [PubMed] [DOI] |
| 10. | Zhang B, Cao H, Rao GN. Fibroblast growth factor-2 is a downstream mediator of phosphatidylinositol 3-kinase-Akt signaling in 14,15-epoxyeicosatrienoic acid-induced angiogenesis. J Biol Chem. 2006;281:905-914. [PubMed] [DOI] |
| 13. | Chou CH, Wei LH, Kuo ML, Huang YJ, Lai KP, Chen CA, Hsieh CY. Up-regulation of interleukin-6 in human ovarian cancer cell via a Gi/PI3K-Akt/NF-kappaB pathway by lysophosphatidic acid, an ovarian cancer-activating factor. Carcinogenesis. 2005;26:45-52. [PubMed] [DOI] |
| 14. | Roy HK, Olusola BF, Clemens DL, Karolski WJ, Ratashak A, Lynch HT, Smyrk TC. AKT proto-oncogene overexpression is an early event during sporadic colon carcinogenesis. Carcinogenesis. 2002;23:201-205. [PubMed] [DOI] |
| 15. | Arboleda MJ, Lyons JF, Kabbinavar FF, Bray MR, Snow BE, Ayala R, Danino M, Karlan BY, Slamon DJ. Overexpression of AKT2/protein kinase Bbeta leads to up-regulation of beta1 integrins, increased invasion, and metastasis of human breast and ovarian cancer cells. Cancer Res. 2003;63:196-206. [PubMed] |
| 16. | Chun KH, Kosmeder JW, Sun S, Pezzuto JM, Lotan R, Hong WK, Lee HY. Effects of deguelin on the phosphatidylinositol 3-kinase/Akt pathway and apoptosis in premalignant human bronchial epithelial cells. J Natl Cancer Inst. 2003;95:291-302. [PubMed] [DOI] |
| 17. | Zinda MJ, Johnson MA, Paul JD, Horn C, Konicek BW, Lu ZH, Sandusky G, Thomas JE, Neubauer BL, Lai MT. AKT-1, -2, and -3 are expressed in both normal and tumor tissues of the lung, breast, prostate, and colon. Clin Cancer Res. 2001;7:2475-2479. [PubMed] |
| 18. | Malik SN, Brattain M, Ghosh PM, Troyer DA, Prihoda T, Bedolla R, Kreisberg JI. Immunohistochemical demonstration of phospho-Akt in high Gleason grade prostate cancer. Clin Cancer Res. 2002;8:1168-1171. [PubMed] |
| 19. | Kandasamy K, Srivastava RK. Role of the phosphatidylinositol 3'-kinase/PTEN/Akt kinase pathway in tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis in non-small cell lung cancer cells. Cancer Res. 2002;62:4929-4937. [PubMed] |
| 20. | Brognard J, Clark AS, Ni Y, Dennis PA. Akt/protein kinase B is constitutively active in non-small cell lung cancer cells and promotes cellular survival and resistance to chemotherapy and radiation. Cancer Res. 2001;61:3986-3997. [PubMed] |
| 21. | Milburn CC, Deak M, Kelly SM, Price NC, Alessi DR, Van Aalten DM. Binding of phosphatidylinositol 3,4,5-trisphosphate to the pleckstrin homology domain of protein kinase B induces a conformational change. Biochem J. 2003;375:531-538. [PubMed] [DOI] |
| 22. | Gonzales M, Bowden GT. The role of PI 3-kinase in the UVB-induced expression of c-fos. Oncogene. 2002;21:2721-2728. [PubMed] [DOI] |
| 23. | Campbell RA, Bhat-Nakshatri P, Patel NM, Constantinidou D, Ali S, Nakshatri H. Phosphatidylinositol 3-kinase/AKT-mediated activation of estrogen receptor alpha: a new model for anti-estrogen resistance. J Biol Chem. 2001;276:9817-9824. [PubMed] [DOI] |
| 24. | Jee SH, Chu CY, Chiu HC, Huang YL, Tsai WL, Liao YH, Kuo ML. Interleukin-6 induced basic fibroblast growth factor-dependent angiogenesis in basal cell carcinoma cell line via JAK/STAT3 and PI3-kinase/Akt pathways. J Invest Dermatol. 2004;123:1169-1175. [PubMed] [DOI] |
| 25. | Chaudhary LR, Hruska KA. Inhibition of cell survival signal protein kinase B/Akt by curcumin in human prostate cancer cells. J Cell Biochem. 2003;89:1-5. [PubMed] [DOI] |
| 26. | Maffucci T, Piccolo E, Cumashi A, Iezzi M, Riley AM, Saiardi A, Godage HY, Rossi C, Broggini M, Iacobelli S. Inhibition of the phosphatidylinositol 3-kinase/Akt pathway by inositol pentakisphosphate results in antiangiogenic and antitumor effects. Cancer Res. 2005;65:8339-8349. [PubMed] [DOI] |
| 27. | Dobashi Y, Shoji M, Jiang SX, Kobayashi M, Kawakubo Y, Kameya T. Active cyclin A-CDK2 complex, a possible critical factor for cell proliferation in human primary lung carcinomas. Am J Pathol. 1998;153:963-972. [PubMed] [DOI] |
| 28. | Dobashi Y, Jiang SX, Shoji M, Morinaga S, Kameya T. Diversity in expression and prognostic significance of G1/S cyclins in human primary lung carcinomas. J Pathol. 2003;199:208-220. [PubMed] [DOI] |
| 29. | Ohashi R, Gao C, Miyazaki M, Hamazaki K, Tsuji T, Inoue Y, Uemura T, Hirai R, Shimizu N, Namba M. Enhanced expression of cyclin E and cyclin A in human hepatocellular carcinomas. Anticancer Res. 2001;21:657-662. [PubMed] |
| 30. | Shih HC, Shiozawa T, Kato K, Imai T, Miyamoto T, Uchikawa J, Nikaido T, Konishi I. Immunohistochemical expression of cyclins, cyclin-dependent kinases, tumor-suppressor gene products, Ki-67, and sex steroid receptors in endometrial carcinoma: positive staining for cyclin A as a poor prognostic indicator. Hum Pathol. 2003;34:471-478. [PubMed] [DOI] |
| 31. | Akli S, Zheng PJ, Multani AS, Wingate HF, Pathak S, Zhang N, Tucker SL, Chang S, Keyomarsi K. Tumor-specific low molecular weight forms of cyclin E induce genomic instability and resistance to p21, p27, and antiestrogens in breast cancer. Cancer Res. 2004;64:3198-3208. [PubMed] [DOI] |
| 32. | Semba S, Itoh N, Ito M, Harada M, Yamakawa M. The in vitro and in vivo effects of 2-(4-morpholinyl)-8-phenyl-chromone (LY294002), a specific inhibitor of phosphatidylinositol 3'-kinase, in human colon cancer cells. Clin Cancer Res. 2002;8:1957-1963. [PubMed] |