修回日期: 2006-01-07
接受日期: 2006-02-08
在线出版日期: 2006-03-28
目的: 报道胃黏膜内类癌合并印戒细胞癌和胃壁内胰腺组织异位1例, 并结合文献探讨其诊断和鉴别诊断问题.
方法: 患者, 男, 63岁, 主因"上腹部烧灼样不适2 年余, 加重2 mo"行胃镜检查, 见胃体大弯前壁黏膜结节状扁平隆起, 直径0.7 cm, 镜下为类癌. 遂行胃大部切除, 常规取材病理送检发现上述3个不同部位的病变, 对此进行组织病理学、组织化学和免疫组织化学观察并复习相关文献.
结果: 胃体黏膜固有层内多灶内分泌细胞增生并于胃体大弯侧形成类癌, 局灶浸润黏膜肌层, 病变呈嗜铬颗粒蛋白A和突触素强阳性; 胃体小弯黏膜固有层内查见印戒细胞癌; 胃窦小弯侧肌壁内查见异位胰腺组织伴内分泌细胞成分显著增生, 后者由胰岛素、胰高血糖素、生长抑素和胃泌素阳性细胞构成.
结论: 胃体大弯黏膜内类癌与小弯黏膜内印戒细胞癌是各自独立的病变; 肌层和浆膜层内分泌细胞团是增生的胰腺内分泌组织而非类癌浸润.
引文著录: 杨琳, 张宏图, 张洵, 孙耘田, 苏勤. 胃黏膜内类癌合并印戒细胞癌伴胃壁胰腺组织异位的临床病理观察. 世界华人消化杂志 2006; 14(9): 874-878
Revised: January 7, 2006
Accepted: February 8, 2006
Published online: March 28, 2006
AIM: To report a case with synchronous occurr-ence of carcinoid, signet-ring cell carcinoma (SRC) and heterotopic pancreas in stomach.
METHODS: One male patient aged 63 years old was diagnosed with coexistence of carcinoid, signet-ring cell carcinoma and heterotopic pancreas in stomach by gastroscopy and pathological examination. These three lesions were further observed by histopathological, histochemical and immunohistochemical approaches, with the related literatures reviewed.
RESULTS: Multiple foci of proliferative endocrine cells were found in lamina propria of the corpus, and carcinoid was found in corpus on the greater curve of the stomach, with muscularis mucosae involved. The tumor cells were strongly positive for neuron-specific enolase, synaptophysin and chromogranin A. An intramucosal SRC lesion was found in the lesser curve of corpus. Heterotopic pancreatic tissue was observed in muscularis propria of the antrum on the lesser curve, with hyperplasia of endocrine cells producing multiple pancreatic hormones.
CONCLUSION: Carcinoid in corpus of the greater curve and SRC in the lesser curve are independent lesions; the foci of endocrine cells in the muscularis propria and serosa are hyperplastic lesions from the heterotopic pancreatic tissue, rather than carcinoid dissemination.
- Citation: Yang L, Zhang HT, Zhang X, Sun YT, Su Q. Coexistence of carcinoid, signet-ring cell carcinoma and heterotopic pancreas in stomach: a clinicopathological observation. Shijie Huaren Xiaohua Zazhi 2006; 14(9): 874-878
- URL: https://www.wjgnet.com/1009-3079/full/v14/i9/874.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i9.874
胃类癌较少见, 占胃肠道肿瘤的0.4%-1.8%[1]; 但印戒细胞癌为较常见的胃癌[2]. 他们发病隐匿, 早期诊断较困难, 但二者的生物学行为有明显区别. 胃壁胰腺组织异位常为胃外科手术或尸检时偶然发现, 发病率为0.6%-13.7%[3]. 目前尚未见有关上述3种病变共存的报道. 我们报道了胃黏膜内类癌合并印戒细胞癌伴有胃壁内胰腺组织异位1例, 结合文献探讨了上述3种病变的鉴别诊断.
患者, 男, 63岁, 主因"上腹部烧灼样不适2 年余, 加重2 mo"行胃镜检查, 见胃体大弯前壁黏膜呈结节状扁平隆起, 直径0.7 cm, 活检病理报告为"胃体神经内分泌源性恶性肿瘤"(经免疫组织化学证实). 入院后查体发现剑突下深压痛. 胸片、上消化道造影、腹部超声未见异常; 腹部CT检查显示胃窦部胃壁略增厚; 血清胃泌素93.2 mg/L, 血清CA19-9、癌胚抗原(CEA)、CA724及CA242水平均正常. 患者否认肿瘤家族史. 术中取大弯前壁黏膜隆起病变(病变1)做冰冻切片, 结合形态及活检切片诊断"符合类癌", 行根治性远端胃大部切除术.
胃大部切除标本经广泛取材, 常规石蜡切片, 苏木精-伊红(HE)、阿尔辛蓝/过碘酸雪夫(AB/PAS)和免疫组织化学染色. 免疫组织化学反应采用PV-9000通用型二步法检测试剂盒, 第一抗体包括针对胰高血糖素、胃泌素、生长抑素、血管活性肠肽(VIP)、胰多肽(PP)等的多克隆抗体; 以及针对细胞角蛋白(CK)18、胰岛素、促肾上腺皮质激素(ACTH)、突触素(SY)、嗜铬素颗粒蛋白A(CgA)、神经元特异性烯醇化酶(NSE)、波形蛋白、P53(DO-7)和Ki-67等的单克隆抗体. 上述试剂均购自北京中杉金桥生物技术有限公司.
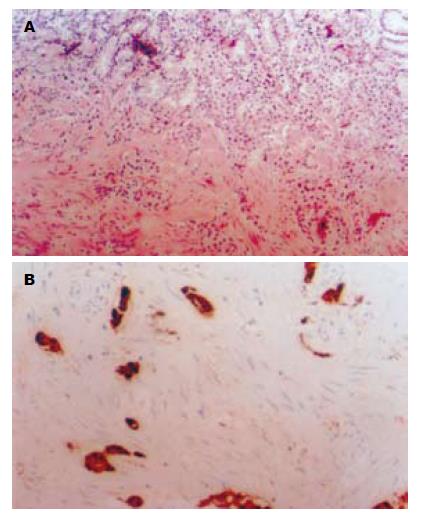
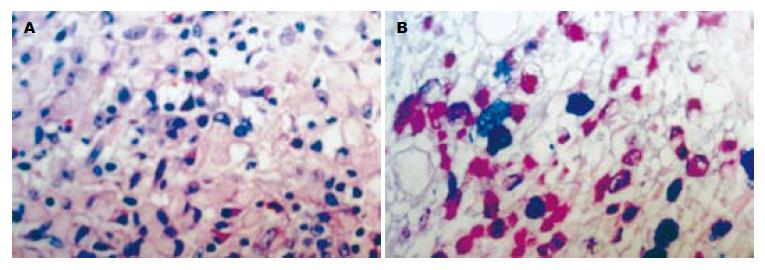
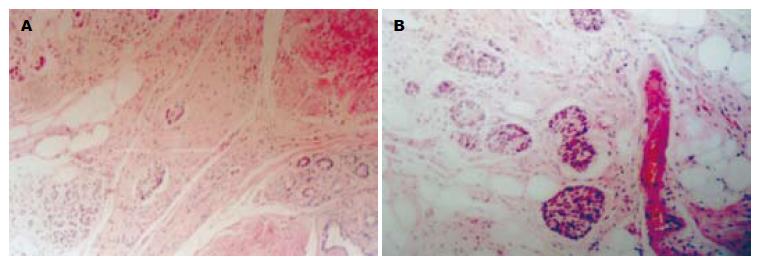
远端胃大部切除标本, 小弯长11.5 cm, 大弯长16.0 cm. 于胃体大弯前壁见一直径约1.0 cm缺损区(病变1, 冰冻已取材), 镜下见轻-中度慢性萎缩性胃炎改变伴黏膜固有层内多灶性内分泌细胞增生, 并在病变1处形成一个直径为0.7 cm的结节. 病变主要位于黏膜固有层, 部分浸润黏膜肌, 呈CK18、NSE、SY和CgA阳性(图1). 胃体小弯侧局部黏膜略增厚, 病变大小为3.0 cm×2.0 cm(病变2). 镜下为黏膜固有层内印戒细胞癌, AB/PAS染色显示肿瘤细胞内含混合性黏液(图2), 神经内分泌标志物阴性. 胃窦小弯侧查见一肌壁增厚区(厚约2.5 cm), 切面见黏膜下层和肌层之间有一边界清楚的灰黄色类圆形结节(病变3), 大小为2.5 cm×2.5 cm×2.0 cm, 质地中等; 镜下显示病变为分化较成熟的胰腺腺泡、导管及胰岛结构, 伴平滑肌组织显著增生; 病变周边见成团的小圆细胞, 他们形态均一, 胞质淡染, 分布于深肌层和浆膜层, 排列成索状, 有的位于扩张的血窦内(图3); 这些细胞团呈CK18、CgA、SY阳性, 由产生胰岛素、胰高血糖素、生长抑素和胃泌素的细胞组成, 形态学和免疫组织化学表型上与异位胰腺组织内胰岛结构相似. 上述3种病变不连续, 其组织化学表型也不同(表1).
| 标志物 | 黏膜病变 | 异位胰腺 (病变3) | |||||
| 类癌(病变1) | 增生的内分泌细胞 | SRC (病变2) | 增生的内分泌细胞团 | 胰岛 | 腺泡 | 导管 | |
| CK18 | +++ | +++ | +++ | + | + | ++ | ++ |
| Vimentin | - | - | - | - | - | - | - |
| NSE | ++ | +-++ | - | +++ | +++ | - | + |
| CgA | +++ | +++ | - | +++ | +++ | - | + |
| Synaptophysin | +++ | +++ | - | +++ | +++ | - | + |
| Insulin | - | - | - | +++ | +++ | - | ± |
| Glucagon | - | - | - | ++ | ++ | - | + |
| Somatostatin | - | + | - | ++ | ++ | ± | ± |
| Gastrin | - | ++ | - | ++ | ++ | - | ± |
| VIP | ± | + | - | ± | ± | - | - |
| ACTH | - | - | - | - | - | - | - |
| PP | - | - | - | - | - | + | ± |
| P53 protein | 2% | - | - | - | - | - | - |
| Ki-67-LI (%) | 2 | <1 | 20 | 1 | <1 | 3 | 5 |
病理诊断为: 胃体小弯黏膜内浅表平坦型印戒细胞癌; 胃体大弯前壁多灶性内分泌细胞增生伴类癌形成, 类癌组织浸润至黏膜肌层; 胃窦-幽门部肌层及浆膜层内胰腺组织异位伴内分泌细胞增生. 上、下切缘净. 胃旁淋巴结未见肿瘤转移灶(0/12). 该患者术后已13 mo, 未见肿瘤复发或转移证据.
2000年WHO将胃的内分泌肿瘤分为类癌(高分化内分泌肿瘤), 小细胞癌(低分化内分泌肿瘤)和瘤样病变(包括内分泌细胞增生和不典型增生)[4], 其中类癌占大多数, 主要由肠嗜铬样细胞(ECL细胞)组成[5]. 类癌分为3型:Ⅰ型与自身免疫性萎缩性胃炎相关; Ⅱ型与多发性内分泌肿瘤综合征Ⅰ型(MEN-Ⅰ)和/或卓-艾综合征(ZES)相关; Ⅲ型为散发型[6]. Ⅰ、Ⅱ型遵从"内分泌细胞增生-不典型增生-肿瘤形成"的发生、发展过程, 内分泌细胞增生和不典型增生均被认为是其前期病变[7]. 当内分泌细胞增生形成结节直径>0.5 cm或浸润黏膜下层时即应诊断为类癌[8]. 本例胃黏膜活检表现为自身免疫性轻-中度萎缩性胃炎伴多灶性内分泌细胞增生, 并在局部形成直径0.7 cm的结节, 该病变浸润黏膜肌层, 其相邻胃黏膜内可见内分泌细胞增生, 符合内分泌细胞增生伴Ⅰ型类癌形成.
本例标本在胃体小弯黏膜内查见表浅的印戒细胞癌(病变2). 这是否为一类特殊的印戒样内分泌细胞癌[9-11]? 即这个病灶是否由类癌(病变1)播散而来? 有3点理由不支持上述假设. 首先, 二者形态不同, 类癌和印戒细胞癌均为典型的病变, 形态学表型无相似之处; 其次, 两个病变发生部位不同, 而且相距较远; 另外, 两个病变各有不同的组织化学表型, 病变1呈黏液染色阴性、神经内分泌标志物阳性, 而病变2为黏液反应阳性、神经内分泌标志物阴性. 因此, 二者为各自独立的病变. 文献中胃类癌合并腺癌的报道共5例[12-16], 其中仅1例为合并印戒细胞癌[16].
胃内胰腺组织异位发生率为0.6%-13.7%[3], 通常位于幽门附近、胃大弯前壁或后壁, 最常见于黏膜下, 也可位于肌层或浆膜下. 组织学上, 胰腺组织异位分为四型:Ⅰ型包含有胰腺的全部成分;Ⅱ型仅由胰导管成分构成; Ⅲ型仅由腺泡成分构成; Ⅳ型仅含有内分泌组织, 由产生多种胰岛激素的细胞构成[17]. 胃壁胰腺异位通常无症状, 偶可因胃黏膜侵蚀引起腹痛、上消化道反复出血、梗阻或恶变. 异位胰腺恶变几率虽然相当低, 但已经有转变为腺癌[18-25]或神经内分泌肿瘤的报道[26]. 判定异位胰腺恶变的标准有3点: 肿瘤必须在异位胰腺组织内部或附近; 肿瘤必须与异位胰腺组织有移行; 非恶变的胰腺组织应当包含分化良好的腺泡和导管[3]. 此外, 功能性胰腺内分泌肿瘤仅由分泌一种激素的细胞组成, 此点与内分泌组织增生不同. 本例属于Ⅰ型胰腺组织异位, 但内分泌部增生较显著, 尤其是在病变周边部分, 在肌层和浆膜层内浸润, 有的位于扩张的血窦内. 这些内分泌细胞增生性病变形态与病变1(类癌)相似. 那么, 病变3中的这些多灶内分泌细胞增生是否已经是肿瘤性病变(即类癌)? 与类癌(病变1)的关系如何? 是否属于病变1的浸润性病灶? 明确这一点将直接影响本例类癌的临床分期. 我们的观察显示, 病变3大部分区域中内分泌部与外分泌部相间排列; 功能上, 病变3的内分泌组织由胰岛素、胰高血糖素和生长抑素阳性细胞组成, 这与正常胰岛的细胞组成相似, 反映了其多克隆性; 而病变1中未见上述激素合成(表1). 这说明, 病变3中的内分泌组织是非肿瘤性增生, 与病变1各自独立, 不是由后者播散形成的. 本例属于Ⅰ型类癌伴胃黏膜内印戒细胞癌及胃窦和幽门部胰腺组织异位. 至于这3种病变在发生机制上有无内在联系, 有待今后观察.
此研究得益于与刘复生教授的讨论以及薛新华和刘秀云技师的支持.
胃内同时发生内分泌细胞增生并典型类癌和印戒细胞癌非常少见, 更未见上述两癌合并胃壁胰腺组织异位的病例. 本文报道了上述三个病变共存1例的情况, 其病理诊断和鉴别诊断是难点, 涉及到胃黏膜内分泌细胞增生与类癌的诊断标准; 典型类癌与印戒样内分泌细胞癌和印戒细胞癌的鉴别以及与异位胰腺灶旁多灶内分泌细胞增生的鉴别. 明确这一点将直接影响本例类癌的临床分期, 与患者的预后判断密切相关. 本文会对今后胃肿瘤病理诊断实践有帮助.
胃内同时发生典型类癌和腺癌或印戒细胞癌非常少见, 曾有1例胃内同时出现腺癌、类癌和神经内分泌黏液癌的报道. 本病例在胃的不同部位同时出现三种不同类型的肿瘤或病变, 确实非常罕见, 有报道价值.
电编: 张敏 编辑:潘伯荣
| 1. | Modlin IM, Kidd M, Lye KD. Biology and manage-ment of gastric carcinoid tumours: a review. Eur J Surg. 2002;168:669-683. [PubMed] [DOI] |
| 2. | Yang XF, Yang L, Mao XY, Wu DY, Zhang SM, Xin Y. Pathobiological behavior and molecular mechanism of signet-ring cell carcinoma and mucinous adeno-carcinoma of the stomach: a comparative study. World J Gastroenterol. 2004;10:750-754. [PubMed] [DOI] |
| 3. | Lack EE. Congenital and developmental abnormali-ties of the pancreas. 1st ed. New York: Oxford University Press Inc 2003; 44-62. |
| 4. | Hamilton SR, Aaltonen LA. (Eds): Endocrine tumours of the stomach. Pathology and Genetics of Tumours of the Digestive System. Lyon: IARC Press 2000; . |
| 5. | Modlin IM, Lye KD, Kidd M. Carcinoid tumors of the stomach. Surg Oncol. 2003;12:153-172. [PubMed] [DOI] |
| 6. | Rindi G, Luinetti O, Cornaggia M, Capella C, Solcia E. Three subtypes of gastric argyrophil carcinoid and the gastric neuroendocrine carcinoma: a cli-nicopathologic study. Gastroenterology. 1993;104:994-1006. [PubMed] [DOI] |
| 7. | Solcia E, Fiocca R, Villani L, Luinetti O, Capella C. Hyperplastic, dysplastic, and neoplastic entero-chromaffin-like-cell proliferations of the gastric mucosa. Classification and histogenesis. Am J Surg Pathol. 1995;19:S1-S7. [PubMed] |
| 8. | Bordi C, Annibale B, Azzoni C, Marignani M, Ferraro G, Antonelli G, D'Adda T, D'Ambra G, Delle Fave G. Endocrine cell growths in atrophic body gastritis. Critical evaluation of a histological classification. J Pathol. 1997;182:339-346. [PubMed] [DOI] |
| 9. | Waldum HL, Aase S, Kvetnoi I, Brenna E, Sandvik AK, Syversen U, Johnsen G, Vatten L, Polak JM. Neuroendocrine differentiation in human gastric carcinoma. Cancer. 1998;83:435-444. [PubMed] [DOI] |
| 10. | Sugihara A, Nakasho K, Yamada N, Nakagomi N, Tsujimura T, Terada N, Tsuji M. Neuroendocrine differentiation of periodic-acid Schiff and Alcian blue-negative signet-ring cell-like cells and tubular adenocarcinoma cells within a gastric cancer. Scand J Gastroenterol. 2004;39:795-800. [PubMed] [DOI] |
| 11. | Morii S, Oka K, Hakozaki H, Nihei T, Mori N. CEA-producing mucin-negative gastric signet-ring cell carcinoma with neuroendocrine markers: a case report. J Clin Gastroenterol. 1999;29:82-85. [PubMed] [DOI] |
| 12. | Olinici CD, Crisan D, Racu I. Synchronous gastric adenocarcinoma and carcinoid. Rom J Gastroenterol. 2004;13:135-137. [PubMed] |
| 13. | De Marco L, Carlinfante G, Botticelli L, Di Maira PV, Putrino I, Cavazza A. Mixed neoplasia of the stomach: description of a case of tubular adenoma combined with carcinoid. Pathologica. 2003;95:214-216. [PubMed] |
| 14. | Adhikari D, Conte C, Eskreis D, Urmacher C, Ellen K. Combined adenocarcinoma and carcinoid tumor in atrophic gastritis. Ann Clin Lab Sci. 2002;32:422-427. [PubMed] |
| 16. | Fujiyoshi Y, Kuhara H, Eimoto T. Composite glandular-endocrine cell carcinoma of the stomach. Report of two cases with goblet cell carcinoid com-ponent. Pathol Res Pract. 2005;200:823-829. [PubMed] [DOI] |
| 17. | Hammock L, Jorda M. Gastric endocrine pancreatic heterotopia. Arch Pathol Lab Med. 2002;126:464-467. [PubMed] |
| 18. | Emerson L, Layfield LJ, Rohr LR, Dayton MT. Adenocarcinoma arising in association with gastric heterotopic pancreas: A case report and review of the literature. J Surg Oncol. 2004;87:53-57. [PubMed] [DOI] |
| 19. | Ura H, Denno R, Hirata K, Saeki A, Hirata K, Natori H. Carcinoma arising from ectopic pancreas in the stomach: endosonographic detection of malignant change. J Clin Ultrasound. 1998;26:265-268. [PubMed] [DOI] |
| 20. | Song DE, Kwon Y, Kim KR, Oh ST, Kim JS. Adeno-carcinoma arising in gastric heterotopic pancreas: a case report. J Korean Med Sci. 2004;19:145-148. [PubMed] [DOI] |
| 21. | Sun Y, Wasserman PG. Acinar cell carcinoma arising in the stomach: a case report with literature review. Hum Pathol. 2004;35:263-265. [PubMed] [DOI] |
| 22. | Osanai M, Miyokawa N, Tamaki T, Yonekawa M, Kawamura A, Sawada N. Adenocarcinoma arising in gastric heterotopic pancreas: clinicopathological and immunohistochemical study with genetic analysis of a case. Pathol Int. 2001;51:549-554. [PubMed] [DOI] |
| 23. | Herold G, Kraft K. Adenocarcinoma arising from ectopic gastric pancreas: two case reports with a review of the literature. Z Gastroenterol. 1995;33:260-264. [PubMed] |
| 24. | Hickman DM, Frey CF, Carson JW. Adenocarci-noma arising in gastric heterotopic pancreas. West J Med. 1981;135:57-62. [PubMed] |
| 25. | Tanimura A, Yamamoto H, Shibata H, Sano E. Carcinoma in heterotopic gastric pancreas. Acta Pathol Jpn. 1979;29:251-257. [PubMed] [DOI] |
| 26. | Chetty R, Weinreb I. Gastric neuroendocrine carci-noma arising from heterotopic pancreatic tissue. J Clin Pathol. 2004;57:314-317. [PubMed] [DOI] |