修回日期: 2006-02-07
接受日期: 2006-02-21
在线出版日期: 2006-03-28
目的: 探讨重症急性胰膜炎(SAP)肺损伤时血清和肺组织内皮素(ET)变化及丹参的保护作用.
方法: Wistar大鼠60只, 随机分为假手术组(J组)、模型组(F组)和丹参治疗组(D组). 50 g/L牛磺胆酸钠胰胆管逆行注射方法制作SAP模型. D组大鼠分别在造模前1 d和造模后10 min ip丹参注射液(5 mL/kg). 各组在制模后24 h及48 h测定血清ET-1水平及其在肺组织(光密度)表达情况, 同时观察肺系数变化及肺组织病理学改变.
结果: 与J组比较, F组24和48 h肺组织损伤明显加重, 血清ET-1水平(F组: 75.8±4.8, 70.4±4.8 ng/L; J组: 32.0±6.9, 30.3±4.8 ng/L)和肺系数显著增高(F组: 0.62±0.06, 0.73±0.07; J组: 0.41±0.08, 0.41±0.07)(P<0.01), 肺组织24和48 h ET-1表达增高(F组: 0.48±0.09, 0.61±0.10; J组: 0.05±0.01, 0.05±0.01)(P<0.01). 与F组比较, D组24和48 h肺组织学损伤明显减轻, 血清ET-1水平和肺系数明显下降(60.2±7.3 ng/L, 0.52±0.06, P<0.05; 57.9±5.43 ng/L, 0.58±0.06, P<0.01), 肺组织ET-1表达明显减少(0.23±0.10, 0.36±0.09, P<0.01). 相关性分析显示, 造模后24和48 h肺组织ET-1表达与肺系数密切相关(r = 0.736, P<0.01; r = 0.828, P<0.01).
结论: ET-1在SAP肺损伤中起着重要的作用, 丹参对SAP肺损伤具有保护作用.
引文著录: 黄晓丽, 刘顺英, 王国品, 曾皓明, 杨丽, 王智. 重症急性胰腺炎肺损伤内皮素的变化及丹参的治疗作用. 世界华人消化杂志 2006; 14(9): 853-857
Revised: February 7, 2006
Accepted: February 21, 2006
Published online: March 28, 2006
AIM: To explore the changes of endothelin (ET) levels, in serum and lung, and the therapeutic effects of labiatae on severe acute pancreatitis (SAP) with lung injury in rats.
METHODS: A total of 60 Wistar rats were randomized into sham operation group (J), model group (F), and Danshen treatment group (D). The model of SAP was established by retrograde injection of 50 g/L sodium taurocholate into the pancreatic and biliary duct. The rats in group D were intraperitoneally injected with Danshen (5 mL/kg) 1 d before and 10 min after modeling. The levels of serum and pulmonary endothelin-1 were evaluated 24 and 48 h after modeling. Meanwhile, the changes of pulmonary histopathology and lung index were observed.
RESULTS: In comparison with those in group J, the pulmonary histopathological changes in group F were significantly aggravated, and the level of serum endothelin-1 and lung index were increased markedly 24 and 48 h after modeling (endothelin-1: 75.8 ± 4.8, 70.4 ± 4.8 ng/L vs 32.0 ± 6.9, 30.3 ± 4.8 ng/L, P < 0.01; lung index: 0.62 ± 0.06, 0.73 ± 0.07 vs0.41 ± 0.08, 0.41 ± 0.07, P < 0.01). Meanwhile, the expression of pulmonary endothelin-1 (using optical density) was elevated (F group: 0.48 ± 0.09, 0.61 ± 0.10; J group: 0.05 ± 0.01, 0.05 ± 0.01, P < 0.01; for 24 and 48 h respectively). Compared with those in group F, the pulmonary pathological changes in group D were notably alleviated, and the levels of serum endothelin-1 and lung index were notably dropped 24 and 48 h after modeling (60.2 ± 7.3 ng/L, 0.52 ± 0.06, P < 0.05; 57.9 ± 5.4 ng/L, 0.58 ± 0.06, P < 0.01), and the expression of pulmonary endothelin-1 was also decreased significantly (0.23 ± 0.10, 0.36 ± 0.09, for 24 and 48 h, respectively, P < 0.01 vs group F). The expression of pulmonary endothelin-1 was correlated with the lung index both at 24 and 48 h (r = 0.736, P < 0.01; r = 0.828, P < 0.01).
CONCLUSION: Endothelin-1 plays an important role in lung injury induced by SAP. Danshen can protect lung tissues from such injury.
- Citation: Huang XL, Liu SY, Wang GP, Zeng HM, Yang L, Wang Z. Changes of endothelin levels and therapeutic effects of Danshen in lung injury induced by severe acute pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(9): 853-857
- URL: https://www.wjgnet.com/1009-3079/full/v14/i9/853.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i9.853
重症急性胰腺炎(severe acute pancreatitis, SAP)常伴有胰外多脏器的损害, 其中肺损伤是最常见和最严重的并发症之一, 且多在SAP的早期出现[1]. SAP发病2 wk内死亡者, 约50%以上是由于并发肺损伤所致[2]. SAP时的微循环障碍是胰腺及肺、肾等胰外器官损害的重要原因之一. 内皮素(endothelin, ET)及其受体对肺通气和肺循环起着重要的调节作用, 其合成、分泌和代谢的异常与许多肺部疾病的发生、发展具有密切关系[3]. 我们旨在观察SAP大鼠血清和肺组织ET的变化及其与肺损伤的相关性, 同时探讨丹参的保护机制.
成年健康Wistar♂大鼠60只, 体质量200-300 g, 购自南京安立默科技有限公司. 牛磺胆酸钠购自美国Sigma公司; 戊巴比妥钠购自中国医药上海化学试剂公司; 丹参注射液为四川升和制药有限公司产品; 内皮素ELISA试剂盒由美国DR lab提供; SP-9000免疫组化染色试剂盒购自北京中杉金桥生物技术有限公司; ET-1一抗购自北京博奥森生物技术有限公司. CliniBio 128C酶标仪: 澳大利亚ASYS Hitech GembH.
将大鼠随机分为3组: 急性重症胰腺炎假手术组(J组)、模型组(F)、丹参治疗组(D). 各组又按模型制备后24 h, 48 h分为2组, 每组10只. 大鼠术前禁食12 h, 不禁水, 按体质量腹腔内注射30 g/L戊巴比妥钠溶液(40 mg/kg), 麻醉生效后, 上腹正中切口, 寻找到十二指肠及胰胆管, 用小动脉夹阻闭胰胆管近肝门端及近肠端, 以4.5号针头逆行穿刺入胰胆管, 注入50 g/L牛磺胆酸钠溶液, 剂量1.5 mL/kg, 注毕5 min后去除小动脉夹, 观察到出现胰腺水肿伴出血后缝合腹壁. J组仅作剖腹及轻轻翻动十二指肠和胰腺. D组在造模前1 d及造模后10 min内分别ip丹参注射液, 剂量5 mL/kg, 余两组ip等容积生理盐水. 各组大鼠均在麻醉前5 min计算呼吸频率, 并在手术清醒后每30 min计算一次呼吸频率, 连续观察6 h, 同时观察临床变化. 大鼠处死后取肺和胰腺组织, 40 g/L福尔马林溶液固定, 取胰头部及右下肺组织常规脱水石蜡包埋, 4-6 μm切片, HE染色, 光镜观察胰腺和肺组织充血、水肿、出血、坏死、炎细胞浸润情况. 模型成功后在规定时相点, 取大鼠股动脉血2 mL, 离心取上清, -20 ℃低温保存, 采用ELISA方法检测血清ET-1水平, 参照ELISA试剂盒说明书操作.
肺系数计算: 肺湿质量(g)/大鼠质量(g)×100. 肺组织ET-1免疫组化染色: 取各组大鼠肺石蜡切片, 常规S-P法免疫组化染色, 按SP-9000免疫组化染色试剂盒说明书操作, 工作浓度1:200, PBS代替一抗为空白对照. 结果判断: 细胞染色为棕黄色, 定位于胞质. 着色强度: (-)为未着色, (+)为浅黄色, (++)为黄色, (+++)为棕黄色. 大鼠肺组织ET-1免疫染色切片(每组5张切片), 并用图像分析软件计算每张切片中5个肺小血管壁及5个细支气管壁的ET-1平均A值.
统计学处理 所有数据均以mean±SD来表示, 采用单因素方差分析和q检验, 肺组织A值与肺系数采用Pearson相关分析, 以P<0.05为差异显著性. 采用SPSS 11.5软件包进行统计学处理.
各组大鼠在实验前呼吸平稳, 呼吸频率(RR)为40-50次/min, F组制模后呼吸立即加快, RR为90-100次/min, 显著高于术前, 伴有呼吸窘迫, 口唇紫绀; D组动物术后呼吸困难渐减轻, RR为70-90次/min; J组动物术后呼吸稍快, 为60-70次/min.
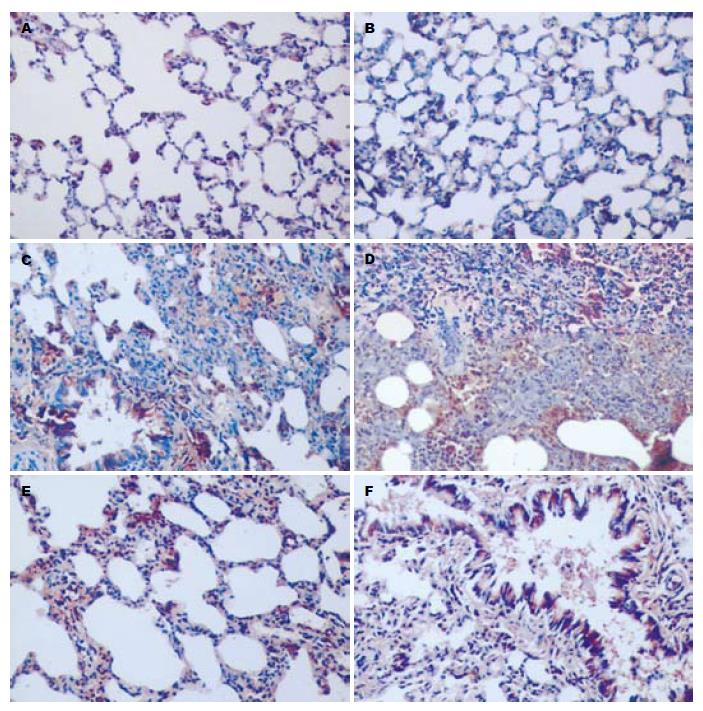
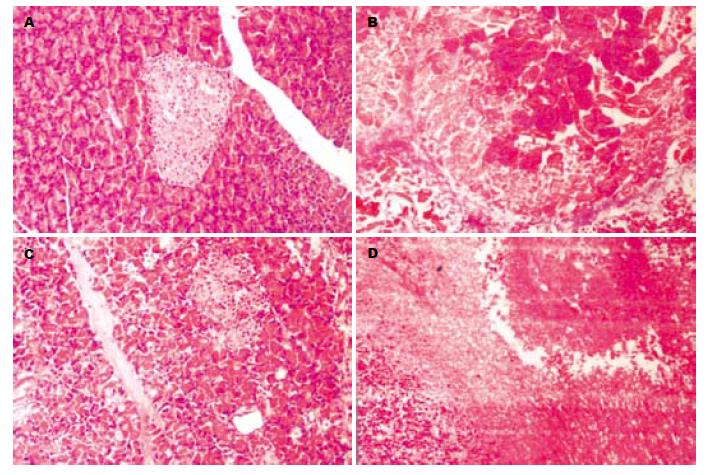
胰腺组织: J组胰腺组织正常; F组大鼠的胰腺腺泡细胞坏死融合成大片状, 叶间隔、小叶间隔及腺泡间隔显著增宽, 炎症细胞浸润明显, 微血管充血伴血栓形成并可见红细胞渗透至间质; D组上述病变程度减轻; F和D组中24 h组均较48 h组病变程度轻. 肺组织: J组肺组织正常; F组大鼠的肺内及支气管周围大量炎细胞浸润、间质充血、水肿、出血, 肺泡壁完整性破坏; D组上述病变程度减轻; F和D组中24 h组均较48 h组病变程度轻(图1-2).
F组各时点血清ET-1水平显著高于D和J组(P<0.01), D组明显高于J组(P<0.01), F组中制模后24 h组的血清ET-1水平稍高于制模后24 h组, 但差异无显著性(表1).
F组各时点肺系数明显高于J组和D组(P<0.01), D组明显高于F组(P<0.01), 且F组中制模后48 h组的肺系数较24 h组明显升高(P<0.05, 表1). ET-1主要在支气管黏膜细胞, 血管浆液细胞、肺泡Ⅱ细胞的胞质表达, 阳性细胞表现为棕黄色颗粒物. F组ET-1免疫组化呈强阳性表达(+++), D组呈阳性表达(+~++), J组呈阴性至弱阳性表达(-~+)(图1). F组各时点的A值显著高于D和J组(P<0.01), D组显著高于J组(P<0.01), F组中制模后48 h组高于24 h组, 但差异无统计学意义(表1).
制模后24 h肺组织免疫组化A值与肺系数密切相关(r = 0.736, P<0.01); 制模后48 h肺组织免疫组化A值与肺系数密切相关(r = 0.828, P<0.01).
ET为内皮细胞分泌释放的一种具多种活性功能的血管活性多肽, 他是迄今认为在体内作用最强、持续时间最久的缩血管物质. 肺脏是体内ET含量最丰富的器官[4], ET在肺内广泛分布于肺血管、呼吸道上皮、黏膜腺体和拟交感神经节. 肺既是ET作用的靶器官, 又是ET合成、分泌、代谢的重要场所[5], 肺内主要产生ET-1, 亦有少量的ET-3. ET-1具有强烈的缩血管和促进气管、支气管平滑肌收缩的功能[6].
本实验应用Aho et al[7]牛磺胆酸钠胰胆管逆行注射方法成功复制了SAP模型, 病理标本可见胰腺及肺组织充血、水肿, 光镜下胰腺腺泡和肺组织均有不同程度坏死、出血、间质水肿、炎细胞浸润, 符合胰腺炎相关性肺损伤病理改变. 本实验结果表明: 大鼠造模后24 h血清ET-1水平增高, 且在肺组织中高表达, 随着时间的延长, 肺组织损伤加重, ET-1在肺组织中表达更明显, 但血清ET-1的浓度反而有所下降, 原因可能为: 由于肺损伤的加重, 肺组织破坏增加, 肺组织中ET-1代谢减慢, 而其合成和释放入血液的ET-1减少. ET-1的这种变化提示我们, ET-1可能主要在SAP肺损伤的早期起作用. 另外, 相关性分析也显示, 在不同的时间点肺组织ET-1的A值与肺系数呈密切正相关, 间接提示肺内ET-1水平与肺水肿程度密切相关. 这与陈晓玲 et al[8]有关肺组织ET-1含量与急性肺损伤病变的程度呈正相关的报道一致. SAP时由于肠道细菌移位出现内毒素血症, 而内毒素又是ET-1合成与释放的强烈刺激因素, 使血清和肺内ET-1升高. ET的过度生成可造成血液循环障碍[9], 降低胰血流, 引起胰腺局部缺血坏死[10-11], 并可引起肺血管的强烈收缩, 导致肺动脉高压和肺水肿. 同时, ET可导致气管、支气管和细支气管的持续收缩, 加重缺氧, 从而导致肺组织进一步损伤. ET还可通过引起细胞外钙内流及动员细胞内钙库, 导致细胞内钙超载[12], 进而促发炎性细胞的呼吸爆破、释放氧自由基等, 促进介质损伤胰腺和肺泡细胞.
本实验发现丹参治疗组胰腺和肺病理改变均较模型组轻, 大鼠临床症状减轻, 肺系数也有所下降, 提示丹参对胰腺坏死及肺损伤具有一定的保护作用. 丹参具有活血化淤、抑制氧自由基、解除血小板聚集、调节脂质炎症介质的代谢等作用, 并能阻止细胞外钙内流, 而使细胞内游离钙浓度维持在生理许可范围内. 已有一些实验证明, 丹参通过以上作用减轻胰腺损害[13-16]. 本实验还发现丹参治疗组血清ET-1水平及其在肺组织的表达均较模型组降低, 提示丹参还能降低血和肺组织ET-1水平. ET-1具有收缩肺血管的作用, 其水平的降低可使肺血管舒张, 改善肺组织血流, 同时可改善气管、支气管和细支气管的持续收缩, 缓解肺组织缺氧使损伤减轻. 总之, 丹参在SAP发病早期应用, 对其并发的肺脏损伤具有一定抑制作用.
SAP常伴有胰外多脏器功能的损害, 其中肺损伤是最常见和最严重的并发症之一. ET是由内皮细胞合成和释放的生物活性肽, 他是胰腺炎急性炎症反应的重要介质, 同时ET也与许多肺部疾病的发生、发展具有密切关系, 而丹参具有活血化淤、抑制氧自由基、解除血小板聚集、调节脂质炎症介质的代谢等作用.
急性肺损伤是SAP早期最常见和最严重的并发症之一, 故有人认为其可以作为临床评价SAP严重程度的标准之一. 因此, 对于ALI的发病机制、诊断和治疗已经成为SAP研究中的一项重要课题.
本文分别观察了造模成功后24 h和48 h ET在血液和肺组织中的表达与肺损伤的关系, 而其他文章多数报道造模24 h内一些炎性介质的变化, 未见用免疫组化法检测ET在SAP相关肺损伤的肺组织中表达的类似报道.
本文不是临床研究, 虽然丹参在实验中的作用被证实, 但临床应用的确切作用尚不能确立, 因此临床意义有限.
内皮素是急性炎症反应的重要介质, 也是SAP合并肺损伤的介质. 本文实验研究SAP大鼠模型的内皮素改变与肺损伤的关系以及丹参的治疗作用及机制, 是当前研究的热点, 有一定意义.
电编: 张敏 编辑:潘伯荣
| 1. | 王祥瑞, 杭燕南主编. 急性肺损伤-基础与临床. 第1版. 北京: 中国协和医科大学出版社 2005; 211-217. |
| 2. | Steer ML. Relationship between pancreatitis and lung diseases. Respir Physiol. 2001;128:13-16. [PubMed] [DOI] |
| 3. | 杨 新良, 周 文波, 富 维骏. 内皮素在肺部的作用及其研究进展. 国外医学呼吸系统分册. 1998;18:104-107. |
| 4. | Matsumoto H, Suzuki N, Onda H, Fujino M. Abundance of endothelin-3 in rat intestine, pituitary gland and brain. Biochem Biophys Res Commun. 1989;164:74-80. [PubMed] [DOI] |
| 5. | Michel RP, Langleben D, Dupuis J. The endothelin system in pulmonary hypertension. Can J Physiol Pharmacol. 2003;81:542-554. [PubMed] [DOI] |
| 6. | Franco-Cereceda A, Matran R, Lou YP, Lundberg JM. Occurrence and effects of endothelin in guinea-pig cardiopulmonary tissue. Acta Physiol Scand. 1990;138:539-547. [PubMed] [DOI] |
| 7. | Aho HJ, Nevalainen TJ. Experimental pancreatitis in the rat. Ultrastructure of sodium taurocholate-induced pancreatic lesions. Scand J Gastroenterol. 1980;15:417-424. [PubMed] [DOI] |
| 9. | Hunley TE, Kon V. Update on endothelins-biology and clinical implications. Pediatr Nephrol. 2001;16:752-762. [PubMed] [DOI] |
| 10. | Foitzik T, Eibl G, Hotz B, Hotz H, Kahrau S, Kasten C, Schneider P, Buhr HJ. Persistent multiple organ microcirculatory disorders in severe acute pancreatitis: experimental findings and clinical implications. Dig Dis Sci. 2002;47:130-138. [PubMed] [DOI] |
| 11. | Eibl G, Hotz HG, Faulhaber J, Kirchengast M, Buhr HJ, Foitzik T. Effect of endothelin and endothelin receptor blockade on capillary permeability in experimental pancreatitis. Gut. 2000;46:390-394. [PubMed] [DOI] |
| 12. | Gandhi CR, Berkowitz DE, Watkins WD. Endo-thelins. Biochemistry and pathophysiologic actions. Anesthesiology. 1994;80:892-905. [PubMed] [DOI] |
| 14. | 张 铁, 陈 铁良. 丹参对急性胰腺炎大鼠氧自由基水平的影响. 中国中西医结合外科杂志. 2004;10:34-36. |
| 15. | 李 雷, 王 桂敏, 蒋 俊明, 夏 庆, 黄 宗文, 陈 光远. 丹参对重症急性胰腺炎早期多器官组织脂质过氧化的影响. 中国中西医结合消化杂志. 2005;13:1-3. |