修回日期: 2006-01-15
接受日期: 2006-01-25
在线出版日期: 2006-03-18
目的: 观察门静脉灌注胶原酶对逆转实验性肝硬化的作用.
方法: 4只兔作为正常对照(A组)给予四氯化碳(CCl4) sc 12 wk, 再行门静脉生理盐水灌注12 wk. 另外4只兔先给予CCl4 sc 12 wk, 再行胶原酶门静脉灌注12 wk (B组), 再有3只兔先行CCl4 sc 12 wk, 再行生理盐水门静脉灌注12 wk (C组).
结果: 经过12 wk的CCl4注射和12 wk的门静脉灌注后, 应用胶原酶灌注的B组动物肝羟脯氨酸含量显著低于用生理盐水灌注的对照组(C组)(177.5±35.6 mg/g vs 446.3±150.1 mg/g; F = 13.78, P<0.01). 肝组织学检查也显示胶原酶治疗后肝硬化完全消退. 肝、肾、肺、脑、心组织学检查未发现胶原酶的毒性反应. 实验中有2只兔发生过敏反应, 其中1只死亡.
结论: 门静脉灌注胶原酶可以促进已形成的肝硬化向正常肝组织结构逆转.
引文著录: 金博, 张志成, 孙涛, 程留芳. 胶原酶门静脉灌注逆转兔CCl4性肝硬化. 世界华人消化杂志 2006; 14(8): 772-777
Revised: January 15, 2006
Accepted: January 25, 2006
Published online: March 18, 2006
AIM: To investigate whether portal collagenase administration can reverse liver cirrhosis.
METHODS: Four normal controls (group A) received olive oil subcutaneously (sc) for 12 weeks followed by normal saline portal perfusion for 12 weeks. Another four rabbits (group B) received carbon tetrachloride (CCl4) sc for 12 weeks and then 6 mg of collagenase portally for 12 weeks, while three control rabbits (group C) received CCl4 for 12 weeks followed by saline for 12 weeks.
RESULTS: After 12 weeks of CCl4 and another 12 weeks of portal vein perfusion, liver hydroxyproline content in collagenase-treated rabbits was significantly decreased as compared with that in saline-treated controls (177.5 ± 35.6 μg/g vs 446.3 ± 150.1 μg/g; F = 13.78, P < 0.01). Further, liver histology showed complete regression of cirrhosis in the collagenase-treated animals. No toxicity of liver, kidney, lung, brain or heart was observed histologically. Anaphylaxis occurred in 2 animals and one was fatal.
CONCLUSION: Portal administration of collagenase can promote the reversion of established liver cirrhosis in the rabbit CCl4 model.
- Citation: Jin B, Zhang ZC, Sun T, Cheng LF. Portal collagenase administration reverses carbon tetrachloride-induced rabbit liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2006; 14(8): 772-777
- URL: https://www.wjgnet.com/1009-3079/full/v14/i8/772.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i8.772
肝硬化是大多数慢性炎症性肝病的终末期, 一旦发生并发症, 5 a死亡率>50%[1]. 肝硬化的病理特征为大量细胞外基质(extracellular matrix, ECM)在肝实质内沉积, 并伴有结节形成和肝功能的损害. 目前肝硬化治疗的唯一方法是肝脏移植, 但供者的缺乏使得大量患者不能得到及时治疗. 近年来的证据表明, 肝纤维化是可逆的[2-6]. 但肝硬化的可逆性仍有争议, 尽管有些肝硬化消退的报道[1,3,7], 但一般认为这些肝硬化的逆转是不完全的[8]. 最近报道用携带金属蛋白酶(matrix metalloproteinase, MMP)序列的腺病毒载体可以使大鼠四氯化碳(carbon tetrachloride, CCl4)肝硬化或胆总管结扎造成的肝硬化发生逆转[9-12]. 然而, 此方法的长期生物学安全性仍受到关注, 而且MMP在体内表达的活性也不能得到有效控制. 我们应用有限剂量胶原酶进行门静脉灌注, 研究此方法可否在体内适当地降解肝硬化肝内过多沉积的胶原组织, 从而逆转肝硬化.
盐酸氯胺酮注射液为上海第一制药厂生产. 动物麻醉剂速眠新是由盐酸二氢埃托菲、保定宁、乙二胺四乙酸和氟哌啶醇组成的复合注射液, 由解放军军需大学兽医研究所生产. 麻醉剂由2 mL一支盐酸氯胺酮注射液(0.1 g)和1 mL一支速眠新混合而成. 一次性硬膜外麻醉导管由陕西志俊科贸有限公司生产, 注射用肝素帽由德国B. Braun Melsungen AG公司生产. Ⅳ型胶原酶购于美国Sigma公司, 活性为388 U/mg, 此型胶原酶由7种不同的胶原酶和少量中性蛋白酶组成[13-15]. 肝素钠注射液为北京制药厂生产. 氯胺T和对二甲胺苯甲醛为德国Merck公司生产. 橄榄油、CCl4、L-羟脯氨酸、氢氧化钾、氯化钾、酚酞、硫代硫酸钠、盐酸、硼酸、丙氨酸及甲苯均购于北京化学试剂公司.
♂新西兰大白兔24只, 体质量1.7-2.2 kg, 随机分为3组: A组: 5只兔, 作为正常对照组, 给予橄榄油sc, 每周2次, 最初2 wk剂量为0.3 mL/kg, 随后改为0.2 mL/kg, 共注射12 wk. 在停止注射橄榄油后, 开始门静脉灌注生理盐水, 2次/wk, 灌注12 wk. B组: 11只兔, 给予用橄榄油稀释的500 mL/L CCl4 sc, 每周2次, 最初2 wk剂量为0.3 mL/kg, 随后改为0.2 mL/kg, 于13 wk停止CCl4注射后开始给予门静脉灌注胶原酶, 2次/wk, 继续灌注12 wk. C组: 8只兔, 给予500 mL/L CCl4 sc, 2次/wk, 与B组相似. 于13 wk停止CCl4注射后开始给予门静脉灌注生理盐水, 2次/wk, 继续灌注12 wk. 所有动物在25 wk处死. 在处死动物前, 从下腔静脉采血并分离血清, 用Beckman Coulter Synchron LX20 Clinical System检测血清ALT, AST, 总胆红素、白蛋白、尿素和肌酐. 动物处死后, 分别采取肝、肾、肺等组织的标本, 用40 g/L甲醛固定, 石蜡包埋, 切片厚5 μm, 用HE及Masson三色法染色. 另取肝脏标本用液氮速冻后, 放在罗口盖管内, 储存于-70℃, 准备进行羟脯氨酸测定. 所有动物均在行门静脉灌注前2-9 d剖腹行永久性门静脉插管术. 打开腹腔后, 暴露肝脏, 以缝扎法切取肝组织一块, 大小约0.1-0.2 cm3, 将活检肝组织分为两部分, 一部分用40 g/L甲醛固定用于病理学检查, 另一部分经液氮速冻后, 储存于-70℃用于羟脯氨酸测定. 然后暴露空肠系膜静脉终末支, 剪一小切口, 结扎远心端, 将一次性硬膜外麻醉导管沿该切口向近心端插入. 导管插入3-4 cm后, 在近心端结扎固定导管, 注射器推注肝素盐水(125 kU/L)无阻力, 回抽可见静脉血后, 将导管剪断, 保留适当长度(12-15 cm), 断端与导管接头连接, 该接头与肝素帽连接. 在接头与肝素帽内充满肝素盐水. 导管带肝素帽的游离端埋入动物右侧腹壁皮下. 此后, 可通过经皮穿刺肝素帽的方法进行门静脉灌注. 将2, 4, 6 mg胶原酶分别溶于20 mL灭菌生理盐水中, 分别对3只兔进行门静脉灌注, 24 h后处死动物. 动物在行门静脉灌注前后分别从耳缘静脉采血, 行血常规、肝肾功能检测. 动物处死后, 取肝、心、肾、肺和脑组织, 用40 g/L甲醛固定, 石蜡包埋, 切片HE染色行病理学检查. 在确定可耐受的胶原酶剂量后, 将6 mg胶原酶溶于20 mL灭菌生理盐水中, 进行胶原酶门静脉灌注. 速度约为2 mL/min, 每周2次, 灌注后注入5 mL肝素盐水以防导管阻塞. 肝组织羟脯氨酸测定采用Kivirikko et al[15]的方法, 稍加改进[16-17].
统计学处理 数据表达方式为mean±SD. 各组之间血清生化指标和肝组织羟脯氨酸含量的差异用F检验比较, 门静脉灌注前后肝组织羟脯氨酸含量的差异用配对t检验比较. 所有统计学分析均用Stata 7.0统计软件进行. P<0.05作为差异显著的标准.
在CCl4诱发肝硬化阶段, 有3只动物死于门静脉插管手术, 还有6只动物死于原发性感染及其他原因. 在参与实验的24只动物中, 早期的死亡合计有9只, 占总数的37.5%. 在应用胶原酶治疗之前, A组(正常对照组)只有4只动物存活, B组有8只存活, C组有3只存活. 在胶原酶灌注过程中, B组有2只动物因导管破裂, 胶原酶漏出至皮下, 导致腹壁皮下组织广泛坏死并继发感染而死亡. B组有一只动物在初次进行胶原酶灌注时发生过敏性休克而死亡. 另有一只动物也曾发生过敏性休克, 在给予肾上腺素皮下注射后恢复, 但由于该动物对胶原酶过敏而被排除. 在实验结束时, 参与实验的24只动物, 只有11只存活, 占总数的46%.
血WBC、RBC、血小板、Hb、ALT、AST、胆红素、白蛋白、尿素氮、肌酐水平均无显著改变, 说明胶原酶门静脉灌注对血细胞及肝肾功能无显著影响. 另外, 给予门静脉灌注胶原酶2, 4和6 mg后, 兔脑、心、肝、肾、肺等组织的病理学检查也无异常发现. 在门静脉灌注胶原酶6 wk或12 wk后, 实验组和正常组比较, 血清ALT、AST、总蛋白、尿素氮、肌酐也无显著性差异, 提示门静脉灌注胶原酶6 mg/兔对肝脏和肾脏无损伤作用.
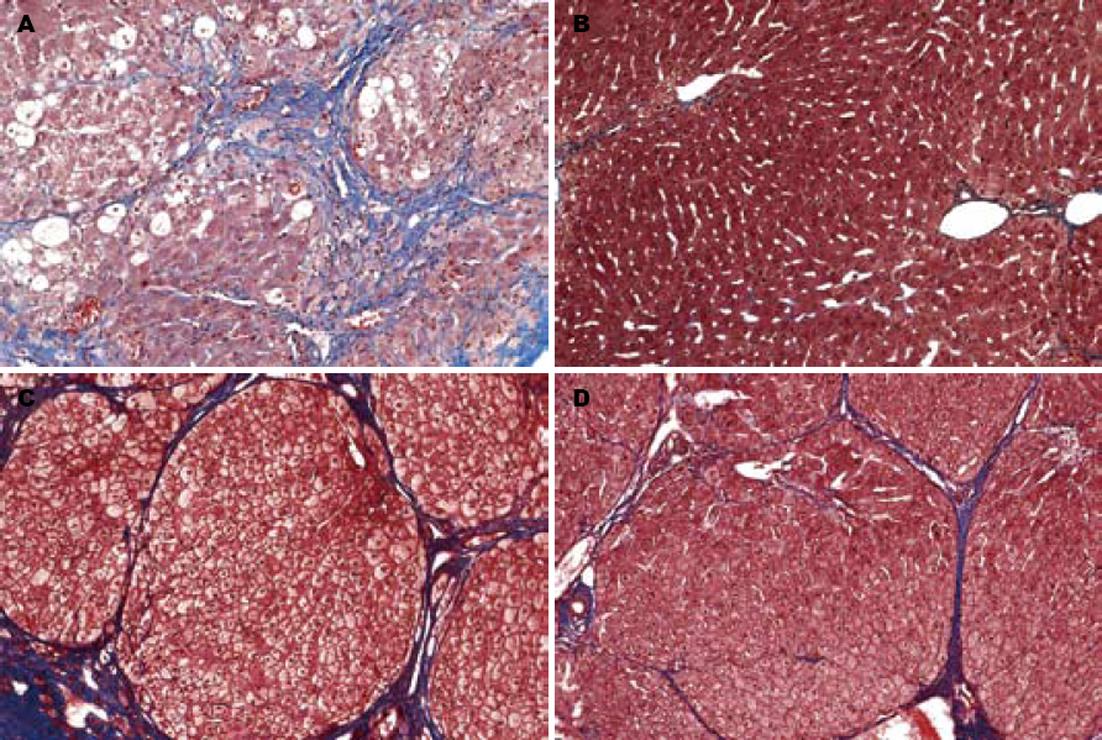
肝脏病理组织学结果表明在CCl4注射12 wk后, 所有动物均发生肝硬化(图1). B组动物在经过随后的12 wk门静脉胶原酶灌注后, 肝内沉积的纤维组织显著减少, 肝脏组织学几乎恢复到正常(图1B). 接受生理盐水门静脉灌注的对照组(C组)动物, 在停用CCl4后的12 wk内, 肝纤维化也呈现明显的自发性消退, 但仍有薄的纤维隔存在(图1D). 肝组织羟脯氨酸含量检测结果也表明, 接受胶原酶治疗的兔(B组)肝组织羟脯氨酸含量显著低于应用CCl4但未接受胶原酶治疗的兔(C组)(177.5±35.6 μg/g vs 446.3±150.1 μg/g, F = 13.78, P<0.01). 接受胶原酶门静脉灌注的兔(B组)肝组织羟脯氨酸含量与未应用CCl4注射的正常组(A组)(177.5±35.6 μg/g vs 153.2±22.3 μg/g)相似, 而应用CCl4但未接受胶原酶治疗的兔(C组)肝组织羟脯氨酸含量则显著高于正常组(A组)(446.3±150.1 μg/g vs 153.2±22.3 μg/g, F = 13.78, P<0.005). 比较B组胶原酶灌注前后肝羟脯氨酸含量(501.8±144.4 μg/g vs 177.5±35.6 μg/g, t = 4.36, P<0.05), 显示经胶原酶灌注后肝羟脯氨酸含量显著降低, 而应用生理盐水灌注的对照组(C组)灌注前后肝羟脯氨酸含量(705.4±113.2 μg/g vs 446.3±150.1 μg/g, t = 2.39, P = 0.124)虽有一定程度的降低, 但未达到统计学显著性. 在门静脉灌注前, 虽然B组和C组的处理是相同的, 但B组肝组织羟脯氨酸含量仍低于C组动物(501.8±144.4 μg/g vs 705.4±113.2 μg/g, t = 2.01, P = 0.101), 这种差异虽然未达到统计学的显著性, 但也反映了动物对CCl4毒性反应的个体差异, 这种差异是否对本实验的结果造成影响, 还需进行更大规模的实验来验证. 在本实验中, 我们未发现门静脉灌注胶原酶可引起肝脏的出血性炎症反应, 但B组有两只动物胶原酶漏出至皮下, 引起了腹部皮下组织的广泛坏死和出血. 另外, 与未用胶原酶的对照组(C组)比较, 经门静脉给予胶原酶的兔(B组), 其肝、肾和肺的组织病理学检查, 则无异常发现. 提示胶原酶血管内应用可能不会导致炎症反应.
近年来的研究表明, 在致病因子去除以后, 动物或患者的肝硬化均有不同程度的消退[2-4,18-19]. 肝脏MMP是参与肝硬化消退的最重要酶类[20]. 研究表明在肝硬化肝内MMP活性降低, 而其抑制因子金属蛋白酶组织抑制物增加[21-22]. 由于过多的ECM沉积导致MMP活性相对不足, 不能有效地降解肝内沉积的ECM, 是肝纤维化发展为肝硬化的主要原因. 肝硬化消退必须首先降解肝内过度沉积的ECM, 随后才是肝脏结构的恢复. 因此, 增加肝硬化肝内的溶胶原活性是触发肝硬化消退的主要因素. 多年来, 肝病学家进行了许多努力试图增加肝硬化肝内胶原溶解酶的活性. 有些化学药品据称有可能增加肝内MMP活性[6,23], 另外还有人将携带MMP DNA的腺病毒载体输入纤维化的大鼠肝内, 携带的MMP DNA可以在纤维化大鼠肝内表达出活性MMP, 从而增加肝内MMP的活性[9-12], 但是由于基因产物的体内表达难以控制, 所以在人类进行类似的肝脏基因治疗是非常困难的. 另外, 还需要防止这种重组腺病毒载体进入除纤维化肝脏以外的其他器官, 以免破坏这些正常器官的ECM支架. 我们通过门静脉插管将活性的胶原酶直接输送到硬化的肝脏, 通过此方法, 肝内胶原降解酶活性可以通过改变给药剂量来控制, 当肝内过度沉积的ECM被降解后, 可以随时停止给药, 以防肝内ECM被过度降解.
由溶组织梭状芽孢杆菌产生的细菌胶原酶是一类胶原降解酶, 他可识别并结合含重复的Gly-Pro-X胶原样序列, 通过水解胶原蛋白链中几乎所有的Y-Gly键而将胶原分子降解为小分子多肽[24]. 我们检测肝羟脯氨酸含量及病理组织学检查结果显示, 门静脉灌注细菌胶原酶可促进兔已形成的肝硬化消退. 由于硬化肝脏含有大量胶原蛋白, 我们认为从门静脉输入的大部分胶原酶会与肝内胶原结合, 因而可防止胶原酶进入全身系统Ñ环, 避免降解除硬化肝脏以外其他器官的胶原. 结果表明, 只有硬化肝脏内的胶原被降解, 而未发现除肝脏之外其他组织的胶原被降解, 这些结果支持我们的假设. 细菌胶原酶被用于临床治疗胶原性疾病已经有多年的历史. 早期研究表明, 这种胶原酶可局部或全身应用[25-27], 且没有证据表明应用胶原酶可以引起全身性副作用、神经或血管损害、皮肤损伤[25-28]. 一项早期的研究表明, 在44例接受阴茎内注射胶原酶治疗Peyronie's病的患者中, 仅有1例患者血清中可检测到胶原酶特异性IgE, 作者推断发生对胶原酶的过敏反应看来是不可能的[29]. 也有早期研究提示胶原酶可引起出血性炎症反应[30]. 我们的结果既没有发现肝脏或肾脏的功能性损害, 也没有发现心、肺、肝、肾和脑的组织学改变. 而且血细胞也没有明显的损伤. 然而, 在我们的实验中有2只兔发生过敏性休克, 其中1只死亡. 据此看来, 即使是首次应用胶原酶, 也可导致少数动物发生严重过敏反应, 因此在给予细菌胶原酶门静脉灌注时, 应该与抗过敏药物联合使用, 以保证用药的安全性. 我们还观察到, 在B组有两只动物死于胶原酶外漏, 这表明如果发生胶原酶外漏, 6 mg胶原酶也是有害的, 可以消化皮下组织, 引起广泛性皮下组织坏死.
一项前期研究表明, 胶原酶门静脉灌注可增强肝细胞对肝细胞生长因子或转化生长因子-α等生长因子的反应性[31]. 这种由胶原酶所诱发和增强的生长因子的有丝分裂原效应, 对于在经过胶原酶治疗, 肝内过多的ECM被降解以后, 硬化肝脏再生和结构重建是有益的. 然而, 如果这种方法用于临床时, 首先应该排除肝脏恶性肿瘤, 以免因胶原酶灌注而加快肿瘤的生长与播散. 与其他报道一致, 我们的结果也表明, 在毒素撤除后3 mo的时间里, 肝脏组织病理学逐步改善, 在3 mo后虽然肝脏羟脯氨酸含量仍然升高, 但组织学上仅遗留菲薄的纤维隔. 尽管在停止应用CCl4后, 肝硬化有缓慢的自发性部分吸收, 但门静脉灌注胶原酶可以加快硬化肝脏内沉积的ECM吸收.
CCl4的肝脏毒性主要是通过其在肝细胞内由细胞色素P-450系统加单氧酶的代谢而发挥的. CCl4的代谢产物为高反应性自由基CCl3或OOCCl4, 这些基团可引起脂质过氧化反应, 影响细胞质膜的功能, 导致肝细胞的病理学变性[32]. 前期研究表明, 应用胶原酶灌注法分离肝细胞后, 肝细胞内细胞色素P-450系统加单氧酶活性降低[33-34]. 但在肝细胞分离时所用的胶原酶剂量远远大于6 mg, 我们实验中所采用的6 mg这样小剂量胶原酶是否会影响肝细胞内细胞色素P-450加单氧酶活性, 还需进一步的验证. 另外, 我们B组的结果表明, 在停止应用CCl4的12 wk内, 胶原酶门静脉灌注可促进肝硬化消退, 而C组动物在停止应用CCl4后应用生理盐水门静脉灌注, 虽然肝硬化有一定程度的消退, 但仍不及B组显著. 这说明胶原酶的抗纤维化作用不是通过抑制CCl4生物代谢来实现的. 为了明确胶原酶抗纤维化作用的机制, 需选用非CCl4诱导的肝硬化模型进行进一步研究.
总之, 我们报道的结果表明, 虽然会发生一些不良反应, 但门静脉胶原酶灌注确实可以促进已形成的兔肝硬化消退. 这些研究结果需要更大量的实验动物来进一步验证, 也需要采用更完善的技术方法来降低外科手术死亡率, 还需采取措施预防发生过敏反应. 如果目前存在的外科技术以及过敏性等问题能够得到解决, 对于严重肝纤维化或肝硬化患者, 门静脉灌注胶原酶会成为一种新的治疗措施.
肝纤维化和肝硬化是各种慢性肝病发展的共同结局, 特征是大量过剩的以胶原为主的细胞外基质沉积于肝内, 肝内胶原降解酶的相对不足不能有效降解过多的细胞外基质, 而导致纤维化不断发展并进展为肝硬化. 目前肝纤维化和肝硬化的逆转治疗是肝病研究的重点和难点, 众多药物抗纤维化的一个重要机制是, 拟通过增加肝组织胶原酶活性, 促进肝内胶原降解而减少在肝脏的沉积, 但临床效果均不理想. 本文采用胶原酶直接门静脉灌注治疗兔肝硬化, 且取得了效果.
本文通过胶原酶灌注门静脉CCl4性肝硬化大白兔, 发现其可以促进已形成的肝硬化向正常组织结构逆转.
本文发现胶原酶门静脉灌注可以在一定程度上逆转兔CCl4性肝硬化, 虽然会发生一些不良反应, 但对于严重肝纤维化或肝硬化患者, 门静脉灌注胶原酶会成为一种新的治疗措施.
选题热门、新颖;实验方法具有创新性, 有一定的学术和实际应用价值.
电编: 张敏 编辑:潘伯荣
| 1. | Friedman SL. Mechanisms of disease: Mechanisms of hepatic fibrosis and therapeutic implications. Nat Clin Pract Gastroenterol Hepatol. 2004;1:98-105. [PubMed] [DOI] |
| 2. | Hammel P, Couvelard A, O'Toole D, Ratouis A, Sauvanet A, Flejou JF, Degott C, Belghiti J, Bernades P, Valla D. Regression of liver fibrosis after biliary drainage in patients with chronic pancreatitis and stenosis of the common bile duct. N Engl J Med. 2001;344:418-423. [PubMed] [DOI] |
| 3. | Wanless IR, Nakashima E, Sherman M. Regression of human cirrhosis. Morphologic features and the genesis of incomplete septal cirrhosis. Arch Pathol Lab Med. 2000;124:1599-1607. [PubMed] |
| 4. | Iredale JP, Benyon RC, Pickering J, McCullen M, Northrop M, Pawley S, Hovell C, Arthur MJ. Mechanisms of spontaneous resolution of rat liver fibrosis. Hepatic stellate cell apoptosis and reduced hepatic expression of metalloproteinase inhibitors. J Clin Invest. 1998;102:538-549. [PubMed] [DOI] |
| 5. | Salgado S, Garcia J, Vera J, Siller F, Bueno M, Miranda A, Segura A, Grijalva G, Segura J, Orozco H. Liver cirrhosis is reverted by urokinase-type plasminogen activator gene therapy. Mol Ther. 2000;2:545-551. [PubMed] [DOI] |
| 6. | Sakaida I, Hironaka K, Terai S, Okita K. Gadolinium chloride reverses dimethylnitrosamine (DMN)-induced rat liver fibrosis with increased matrix metalloproteinases (MMPs) of Kupffer cells. Life Sci. 2003;72:943-959. [PubMed] [DOI] |
| 7. | Kaplan MM, DeLellis RA, Wolfe HJ. Sustained biochemical and histologic remission of primary biliary cirrhosis in response to medical treatment. Ann Intern Med. 1997;126:682-688. [PubMed] [DOI] |
| 8. | Desmet VJ, Roskams T. Cirrhosis reversal: a duel between dogma and myth. J Hepatol. 2004;40:860-867. [DOI] |
| 9. | Iimuro Y, Nishio T, Morimoto T, Nitta T, Stefanovic B, Choi SK, Brenner DA, Yamaoka Y. Delivery of matrix metalloproteinase-1 attenuates established liver fibrosis in the rat. Gastroenterology. 2003;124:445-458. [PubMed] [DOI] |
| 10. | Siller-Lopez F, Sandoval A, Salgado S, Salazar A, Bueno M, Garcia J, Vera J, Galvez J, Hernandez I, Ramos M. Treatment with human metalloproteina-se-8 gene delivery ameliorates experimental rat liver cirrhosis. Gastroenterology. 2004;126:1122-1133. [PubMed] [DOI] |
| 11. | Garcia-Banuelos J, Siller-Lopez F, Miranda A, Aguilar LK, Aguilar-Cordova E, Armendariz-Borunda J. Cirrhotic rat livers with extensive fibro-sis can be safely transduced with clinical-grade ad-enoviral vectors. Evidence of cirrhosis reversion. Gene Ther. 2002;9:127-134. [DOI] |
| 12. | Angleton EL, Van Wart HE. Preparation and recons-titution with divalent metal ions of class I and class II Clostridium histolyticum apocollagenases. Bioch-emistry. 1988;27:7406-7412. [PubMed] [DOI] |
| 13. | Bond MD, Van Wart HE. Purification and separa-tion of individual collagenases of Clostridium histo-lyticum using red dye ligand chromatography. Bio-chemistry. 1984;23:3077-3085. [PubMed] [DOI] |
| 14. | Bond MD, Van Wart HE. Characterization of the individual collagenases from Clostridium histolyti-cum. Biochemistry. 1984;23:3085-3091. [PubMed] [DOI] |
| 15. | Kivirikko KI, Laitinen O, Prockop DJ. Modifications of a specific assay for hydroxyproline in urine. Anal Biochem. 1967;19:249-255. [PubMed] [DOI] |
| 16. | Blumenkrantz N, Asboe-Hansen G. An assay for hydroxyproline and proline on one sample and a simplified method for hydroxyproline. Anal Biochem. 1975;63:331-340. [PubMed] [DOI] |
| 18. | Poynard T, McHutchison J, Manns M, Trepo C, Lindsay K, Goodman Z, Ling MH, Albrecht J. Impact of pegylated interferon alfa-2b and ribavirin on liver fibrosis in patients with chronic hepatitis C. Gastroenterology. 2002;122:1303-1313. [PubMed] [DOI] |
| 19. | Dunn MA, Cheever AW, Paglia LM, Kelly EP, Duvall RH, Andrade ZA, Goldner FH. Reversal of advanced liver fibrosis in rabbits with Schistosomia-sis japonica. Am J Trop Med Hyg. 1994;50:499-505. [PubMed] |
| 20. | Benyon RC, Arthur MJ. Extracellular matrix degra-dation and the role of hepatic stellate cells. Semin Liver Dis. 2001;21:373-384. [PubMed] [DOI] |
| 21. | Perez-Tamayo R, Montfort I, Gonzalez E. Collage-nolytic activity in experimental cirrhosis of the liver. Exp Mol Pathol. 1987;47:300-308. [PubMed] [DOI] |
| 22. | Kossakowska AE, Edwards DR, Lee SS, Urbanski LS, Stabbler AL, Zhang CL, Phillips BW, Zhang Y, Urbanski SJ. Altered balance between matrix metal-loproteinases and their inhibitors in experimental biliary fibrosis. Am J Pathol. 1998;153:1895-1902. [PubMed] [DOI] |
| 23. | Bruck R, Genina O, Aeed H, Alexiev R, Nagler A, Avni Y, Pines M. Halofuginone to prevent and treat thioacetamide-induced liver fibrosis in rats. Hepato-logy. 2001;33:379-386. [PubMed] [DOI] |
| 24. | French MF, Mookhtiar KA, Van Wart HE. Limited proteolysis of type I collagen at hyperreactive sites by class I and II Clostridium histolyticum collagena-ses: complementary digestion patterns. Biochemistry. 1987;26:681-687. [PubMed] [DOI] |
| 25. | Gelbard MK, James K, Riach P, Dorey F. Collagena-se versus placebo in the treatment of Peyronie's dis-ease: a double-blind study. J Urol. 1993;149:56-58. [PubMed] |
| 26. | Eiler H, Hopkins FM. Successful treatment of retained placenta with umbilical cord injections of collagenase in cows. J Am Vet Med Assoc. 1993;203:436-443. [PubMed] |
| 27. | Rydevik B, Brown MD, Ehira T, Nordborg C. Effects of collagenase on nerve tissue. An experimental study on acute and long-term effects in rabbits. Spine. 1985;10:562-566. [PubMed] [DOI] |
| 28. | Rydevik B, Ehira T, Linder L, Olmarker K, Romanus M, Branemark PI. Microvascular response to locally injected collagenase. An experimental investigation in hamsters and rabbits. Scand J Plast Reconstr Surg Hand Surg. 1989;23:17-21. [PubMed] [DOI] |
| 29. | Hamilton RG, Mintz GR, Gelbard MK. Humoral immune responses in Peyronie's disease patients receiving clostridial collagenase therapy. J Urol. 1986;135:641-647. [PubMed] |
| 30. | Vargaftig BB, Lefort J, Giroux EL. Haemorrhagic and inflammatory properties of collagenase from C. histolyticum. Agents Actions. 1976;6:627-635. [PubMed] [DOI] |
| 31. | Liu ML, Mars WM, Zarnegar R, Michalopoulos GK. Collagenase pretreatment and the mitogenic effects of hepatocyte growth factor and transforming growth factor-alpha in adult rat liver. Hepatology. 1994;19:1521-1527. [PubMed] [DOI] |
| 32. | Recknagel RO, Glende EA Jr, Dolak JA, Waller RL. Mechanisms of carbon tetrachloride toxicity. Pharmacol Ther. 1989;43:139-154. [PubMed] [DOI] |
| 33. | Binda D, Lasserre-Bigot D, Bonet A, Thomassin M, Come MP, Guinchard C, Bars R, Jacqueson A, Richert L. Time course of cytochromes P450 decline during rat hepatocyte isolation and culture: effect of L-NAME. Toxicol In Vitro. 2003;17:59-67. [PubMed] [DOI] |
| 34. | Eeckhoutte C, Albo AG, Carletti M, Giaccherino AR, Galtier P, Nebbia C, Dacasto M. Time-dependent variations of drug-metabolising enzyme activities (DMEs) in primary cultures of rabbit hepatocytes. Toxicol In Vitro. 2002;16:375-382. [PubMed] [DOI] |