修回日期: 2006-02-05
接受日期: 2006-02-08
在线出版日期: 2006-03-18
目的: 克隆人核点蛋白自身抗原Sp100基因, 构建重组表达质粒, 获得具有免疫学活性的纯化重组蛋白.
方法: 从人类肝脏cDNA文库中扩增出Sp100的基因片段, 克隆至PEGH表达载体进行诱导表达, 并对表达产物进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和蛋白质印迹法(Western blot)鉴定.
结果: 经重组质粒测序结果证实, Sp100目的基因已正确插入真核表达载体中, 基因序列正确, 符合表达框架; SDS-PAGE检测表达产物分别在53 ku, 55 ku, 52 ku, 37 ku, 42 ku, 47 ku 处有一明显的蛋白表达条带, Western blot分析表明重组蛋白2, 3, 5, 6具有人Sp100抗原反应性.
结论: 本研究成功克隆人核点蛋白自身抗原Sp100基因, 并将其在酵母菌中成功表达.
引文著录: 王雪松, 李永哲, 刘国振. 自身抗原核点蛋白Sp100基因克隆和真核表达. 世界华人消化杂志 2006; 14(8): 758-762
Revised: February 5, 2006
Accepted: February 8, 2006
Published online: March 18, 2006
AIM: To clone and construct the plasmid cont-aining human autoantigene Sp100 gene, and then to identify the immunoreactivity of the purified recombinant protein.
METHODS: The Sp100 gene was amplified from human liver cDNA library, and then was cloned into PEGH vector to induce the Sp100 expression. The obtained products were identified and analyzed by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) and Western blot.
RESULTS: The sequence of Sp100 autoantigene gene was confirmed to be the same as the sequence reported in GenBank. The fusion pro-teins were found at 53-, 55-, 52-, 37-, 42-, and 47-ku strip on SDS-PAGE gel. Western blot analysis showed that the fusion protein with 55, 52, 42 and 47 ku had the same immunoreactivity as human Sp100 autoantigene.
CONCLUSION: Human plasmid containing Sp100 gene is successfully cloned and expressed in yeast Y258.
- Citation: Wang XS, Li YZ, Liu GZ. Gene cloning and fusion expression of human autoantigen Sp100 in yeasts. Shijie Huaren Xiaohua Zazhi 2006; 14(8): 758-762
- URL: https://www.wjgnet.com/1009-3079/full/v14/i8/758.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i8.758
原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)是一种慢性渐进性胆汁淤积性肝脏疾病, 组织学是以破坏小胆管为其特征的非化脓性炎症, 并以血清中出现特征性自身抗体为其主要标志. 抗线粒体抗体(antimitochondrial antibody, AMA)是PBC高敏感性血清学指标[1], 但大约有50% PBC患者血清中有抗核抗体(antinuclear antibody, ANA), 尤其是在抗线粒体抗体呈阴性时可作为其诊断的另一重要标志[2]. 抗核抗体中表现为核点型荧光染色的被称为抗核点抗体[3], 主要包括Sp100(多核点型)和p80(少核点型)两种自身抗体. 其中抗Sp100抗体是PBC的特异性自身抗体, 该抗体在PBC中特异性约为97%, 其靶抗原Sp100为可溶性酸性磷酸化核蛋白, 大约20%-30% PBC患者血清中含有抗Sp100核蛋白[4]. 目前对PBC的诊断常基于免疫荧光(大鼠肝肾冰冻切片)或酶联免疫吸附实验(以牛或猪心线粒体提取物为抗原)的检测结果, 但很难对其分型, 并且费用比较昂贵. 我们首次应用基因工程技术在真核表达系统中成功克隆、表达了Sp100重组蛋白, 为进一步建立新的PBC自身抗体检测方法奠定了基础.
人类肝脏cDNA文库; 表达型质粒PEGH及其纯化系列; 酵母菌Y258; IPTG; 聚合酶链反应(polymerase chain reactin, PCR)引物合成均由中国科学院北京华大基因研究中心提供. Taq DNA聚合酶、限制性内切酶、1 kb DNA标志物、低蛋白质分子质量标准(TaKaRa生物技术有限公司). HRP-羊抗人IgG(华美生物技术公司). 人自身免疫抗原标准血清由德国IMTEC公司Werner SchOBler博士惠赠, 其余试剂为进口、国产分析纯或优级纯. PE2400型DNA扩增仪(美国ABI公司), Trans Blot SD半干式电转印仪(美国Bio-Rad公司).
我们经过软件分析Sp100基因的抗原决定簇位置, 将Sp100基因分为6个片段. 以人肝cDNA文库为模板, 按GenBank中Sp100的cDNA序列设计引物(引物中已包含XbaⅠ, HindⅢ识别位点和保护碱基). 片段1上游引物5'GCATCACCATCACCATCACGGTGGTGGTATGGCAGGTGGGGGCGGCG3', 下游引物5'GCATCACCATCACCATCACGGTGGTGGTATGGCAGGTGGGGGCGGCG3'; 片段2上游引物5'AGGCAGATCGTCAGTCAGTCACGATGAACTAATCTTCTTTACCTGACCCTC3', 下游引物5'AGGCAGATCGTCAGTCAGTCACGATGAACTAATCTTCTTTACCTGACCCTC3'; 片段3上游引物5'GCATCACCATCACCATCACGGTGGTGGTCAAAAGGCTGAGCCAACAGAG3', 下游引物5'AGGCAGATCGTCAGTCAGTCACGATGAATCTTCTTAGGGATGAGCTGCAG3'; 片段4上游引物5'GCATCACCATCACCATCACGGTGGTGGTCAAAAGGCTGAGCCAACAGAG3', 下游引物5'AGGCAGATCGTCAGTCAGTCACGATGAAGGATCCTTCAGAGTCCTCAC3'; 片段5上游引物5'GCATCACCATCACCATCACGGTGGTGGTGGATCCACTGACGTTGATGAG3', 下游引物5'AGGCAGATCGTCAGTCAGTCACGATGAATCTTCTTAGGGATGAGCTGCAG3'; 片段6上游引物5'GCATCACCATCACCATCACGGTGGTGGTATAAAAAAGGAAAAGCCATTTTC3', 下游引物5'AGGCAGATCGTCAGTCAGTCACGATGAACTAATCTTCTTTACCTGACCCTC3'.
按下列条件进行PCR扩增: 94℃预变性4 min, 94℃变性30 s, 55℃退火30 s, 72℃延伸1 min, 共35个循环. 最后于72℃延伸10 min. 取10 mL进行10 g/L琼脂糖凝胶电泳, 紫外灯下观察结果. 使用乙醇沉淀法将PCR产物进行纯化. 将纯化后的PCR产物与含PEGH GST的融合表达载体一同转入酵母菌Y258中, 涂板, 挑取克隆, 分别提取各片段克隆质粒, 经PCR反应筛选阳性克隆. 同时将筛选出的阳性克隆片段的质粒转化感受态大肠杆菌DH5a. 经提取该质粒及酶切鉴定, 进行测序. 由北京华大基因研究中心完成测序. 将转化好的阳性克隆保存菌液均匀涂布于含氨苄的SC-Ura/raffinose平板上, 30℃培养得到2 mm左右的单克隆菌落. 取一个单克隆至10 mL SC-ura/raffinose液体培养基, 30℃振荡培养36 h, 次日下午吸取10 mL菌液加至150 mL SC-ura/raffinose液体培养基, 30℃振荡培养36 h, 然后将150 mL菌液加至1 L SC-ura/raffinose液体培养基, 30℃振荡培养. 次日测A值为0.6-0.8时, 以0.4 mmol/L b-D硫代半乳糖苷于30℃诱导12-16 h. 收集菌体, 用锆珠及裂解液进行剧烈震荡裂解, 离心收集上清液, 进行亲和纯化. 融合蛋白含1个GST的标签, 故表达产物可用GST beads进行纯化. 将上清液与GST beads混合, 4℃翻转3-4 h. 先用洗液Ⅰ(50 mmol/L Tris-HCl, 100 mmol/L NaCl, 1 mmol/L EGTA, 1 g/L TritonX-100)悬浮, 洗5次, 弃上清. 再用洗液Ⅱ(50 mmol/L HEPES, 100 mmol/L NaCl, 100 mL/L Glycerol)悬浮, 洗3次, 弃上清. 最后加入洗脱液1 mL, 用盖子封严, 短暂震荡将beads重悬, 4℃翻转摇过夜. 次日, 2 000 r/m离心2 min, 将上清移至新的1.5 mL管中, 即为纯化后的蛋白液体. 将纯化后的蛋白进行SDS-PAGE, 经2.5 g/L考马斯亮蓝室温染色2 h, 脱色过夜后观察. 取纯化后的蛋白液15 mL与2×上样缓冲液5 mL混合后上样, 同时取10 mL对照上样, 行SDS-PAGE电泳, 考马斯亮蓝R250染色. 利用半干电转移将SDS-PAGE上的蛋白转移至硝酸纤维素膜上, 50 g/L脱脂奶粉溶液封闭1 h后, 加入一抗自身免疫抗原的标准血清振摇1 h, 经缓冲液冲洗膜后, 加二抗1∶5 000稀释的HRP-羊抗人IgG轻摇1 h, 缓冲液洗膜后, 在DAB, H2O2下显色.
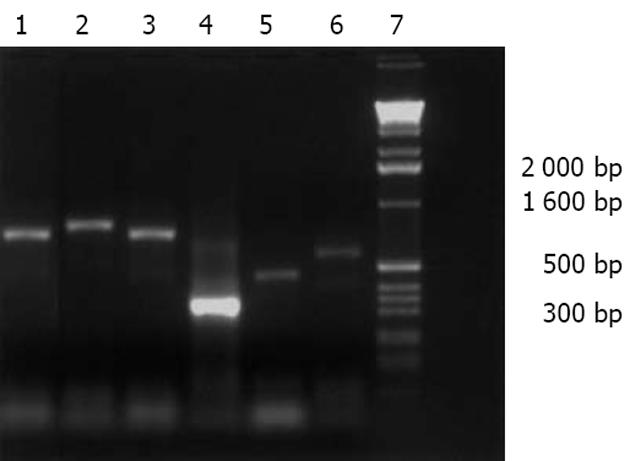
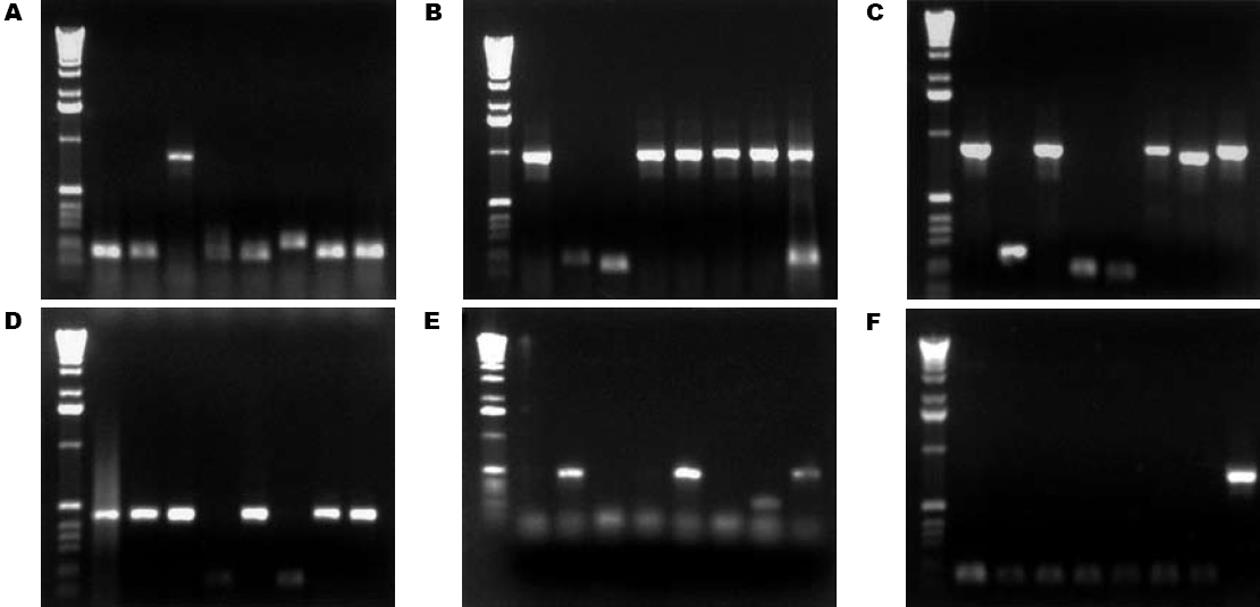
从人类肝脏cDNA文库中扩增出6个包含Sp100基因的DNA片段(图1). 出现清晰的特异性扩增条带. 分别为723 bp, 786 bp, 705 bp, 285 bp, 426 bp, 558 bp大小的片段. 将转化的克隆以PCR的方法进行筛选, 我们选用通用引物PGST2和PEGH3进行扩增, 结果转化成功的阳性克隆可以在相应大小处见到明显扩增条带, 而其他则为空载体(图2).
将筛选出的阳性克隆质粒转化感受态菌大肠杆菌DH5a, 涂板, 提取质粒后进行测序, 结果如下. 与GenBank中Sp100基因序列(编号: M 60618)比较, 克隆的基因1-6核苷酸测序结果同源性分别为: 97.68%; 100%; 99.99%; 99.35%; 96.52%; 99.99%. Sp100基因测序结果与GenBank中Sp100基因序列一致, 而且读码框正确.
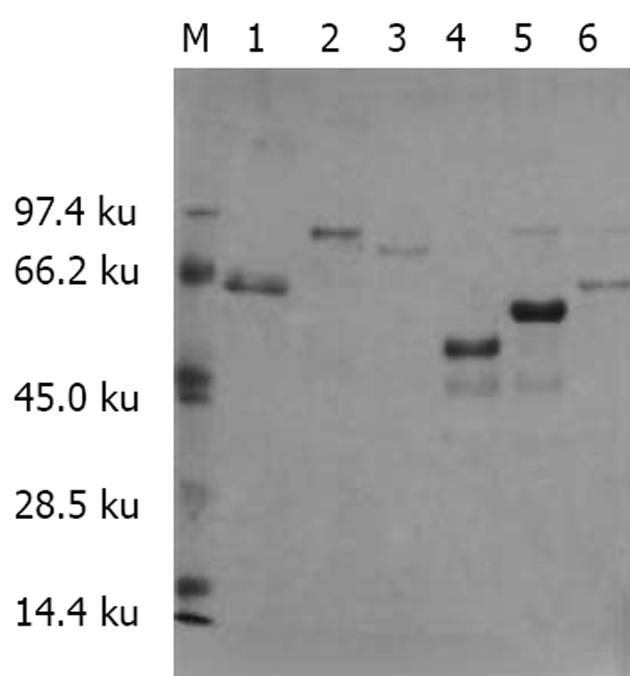
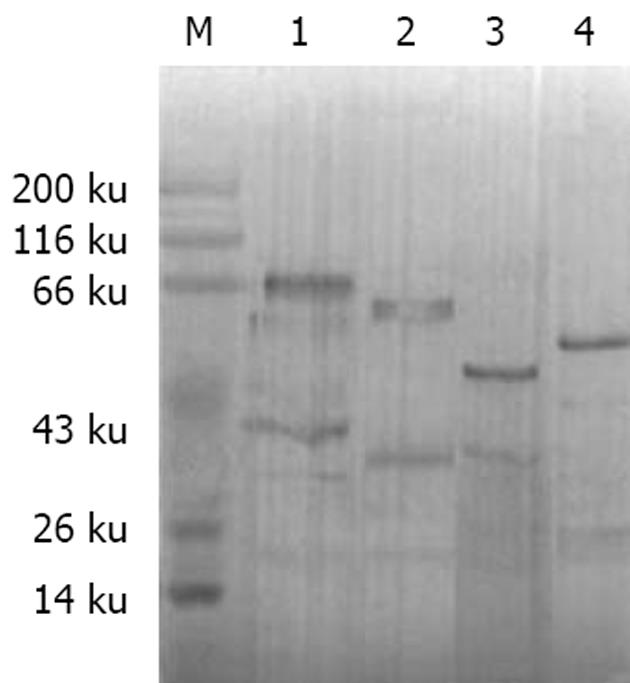
用2种方法对融合蛋白进行分析. 结果显示, PEGH-Sp100重组质粒诱导表达了6个相应大小的蛋白条带, 其表达的蛋白条带仅能被抗Sp100标准血清特异性识别(图3, 4).
自身免疫性肝病是一组以出现自身免疫抗体为特征, 在体内免疫功能异常的基础上发生的炎症性肝胆疾病. 过去认为自身免疫性肝病比较少见, 近年来发现这类疾病的患者人数逐渐增多[5-6], 且其严重的危害程度越来越受到医学界的关注. 由于不同自身免疫肝病具有不同自身免疫抗体谱, 因此自身免疫抗体的检测对自身免疫病的研究、诊断和治疗具有重要意义. 研究已证明, 高滴度AMA是PBC患者的重要血清学标志[1], 抗线粒体抗体M2亚型抗体在PBC中敏感性可达90%以上[7-9]. 但临床应用研究发现, 此项指标对PBC的诊断仍存在局限性, 约有10%以上的PBC患者AMA/AMA-M2阴性[10], 其也可出现于某些结缔组织病(尤其是原发性干燥综合征合并肝脏损伤患者)、感染性疾病患者及某些无肝损伤患者中. AMA-M2可能是诊断PBC高敏感性指标而非特异性指标. 临床上PBC与病毒性肝炎重叠综合征、原发性干燥综合征肝损伤、自身免疫性胆管炎等肝脏疾病的鉴别诊断仍十分困难[11]. 国外对PBC相关自身抗体谱靶抗原性质、临床诊断应用价值与疾病临床表现及疾病活动性的关系等方面研究进展迅速[12-13]. 国内有很多学者正在进行有关该疾病的靶抗原的研究工作[20]. PBC新特异性自身抗体研究主要依靠间接免疫荧光检测, 在抗核抗体中表现为核点型荧光染色型的抗核点蛋白抗体, 如抗Sp100抗体, 该抗体在PBC中特异性约为97%以上[12], 极少出现在其他自身免疫性疾病中. 另一种抗核抗体为抗核膜抗体, 主要包括抗gp210[14-16]、p62[17-19]、LBR[17]和核板层素抗体[18]等. 目前, 国内只有少数医院能开展间接免疫荧光法测定抗核点抗体, 但其不能对抗核点抗体进行分型, 诊断PBC的特异性较差. 由于PBC患者本身的肝脏组织病理, 生物化学指标和临床表现均缺少特异性, 所以血清中抗核点蛋白Sp100的检测, 特别是在这种胆汁淤积性疾病的临床、生物化学、病理表现以及胆管损伤的证据尚未出现之时, 是诊断抗线粒体抗体阴性PBC最为重要的证据.
Sp100为一种可溶性酸性磷酸化核蛋白, 特异性的位于细胞核[21-22]. 大约20%-30% PBC患者血清中含有抗Sp100核蛋白[23]. Sp100基因开放阅读框架为1 443 bp, 编码481个氨基酸, 分子量为53 ku的蛋白, 抗原决定簇主要位于羧基末端. 本研究在国内首次应用基因工程技术在真核表达系统中成功克隆、表达了Sp100基因. 并将Sp100基因分为6个片段, 采用PCR的方法从人肝脏cDNA文库中获得了扩增片段, 选用GAL-1启动翻译起始序列的载体PEGH构建了表达载体PEGH-Sp100, 并转化酵母菌Y258, 获得其克隆. 所克隆的6个Sp100片段核苷酸序列与已报道的序列比较, 同源性分别高达97.68%; 100%; 99.99%; 99.35%; 96.52%; 99.99%, 说明Sp100基因序列与克隆的基因序列完全相同. SDS-PAGE结果表明, 在电泳上可见到清晰的6条蛋白条带, 大小与预期设计相符, 且在酵母菌中获得了高效表达. Western blot实验结果证实, 表达蛋白2, 3, 5, 6能特异性的被抗Sp100抗体标准血清识别, 而蛋白1, 4与其他自身免疫性疾病患者、健康捐献者血清无非特异性的交叉反应, 说明Sp100蛋白的抗原决定簇主要位于羧基末端, 证明与文献报道的抗原决定簇位置相同[24-26], 从而为合成短肽及实验研究奠定了基础.
随着检测手段的不断提高, 越来越多的新的自身抗原被发现, 自身抗体检测的重要性也随之日益体现. 伴随免疫学及分子生物学技术的应用, 以重组蛋白或多肽作为抗原, 应用免疫印迹法或ELISA法检测PBC各种新特异抗体, 在临床上具有广阔的应用前景; 并可利用重组蛋白研究PBC患者的发病机制和构建动物模型; 还可根据不同临床需要, 结合先进精确的蛋白质芯片技术, 为开发多种自身抗原联合检测相应自身抗体试剂盒奠定了基础.
PBC是一种自身免疫介导的慢性胆汁淤积性肝病, 目前诊断依赖于临床表现、病理组织学检查和特异性自身抗体检测. 抗Sp100抗体是PBC的高特异性自身抗体, 对其疾病的诊断具有重要价值.
对该抗体及其靶抗原的研究已成为国内外研究热点.
本研究在国内首次应用基因工程技术在真核表达系统中成功克隆和表达了Sp100基因, 并确定其抗原决定簇位于Sp100蛋白的羧基末端.
本文为今后合成短肽及建立新的PBC自身抗体检测方法奠定了基础.
本研究属国内首次报道应用基因工程技术成功克隆和表达了Sp100基因, 具有创新性, 为今后合成短肽奠定了基础.
电编: 张敏 编辑:潘伯荣
| 1. | Omagari K, Hazama H, Kohno S. Enzyme inhibition assay for pyruvate dehydrogenase complex: clinical utility for the diagnosis of primary biliary cirrhosis. World J Gastroenterol. 2005;11:6735-6739. [PubMed] [DOI] |
| 2. | Muratori P, Muratori L, Ferrari R, Cassani F, Bianchi G, Lenzi M, Rodrigo L, Linares A, Fuentes D, Bianchi FB. Characterization and clinical impact of antinuclear antibodies in primary biliary cirrhosis. Am J Gastroenterol. 2003;98:431-437. [PubMed] [DOI] |
| 3. | Invernizzi P, Selmi C, Ranftler C, Podda M, Wesier-ska-Gadek J. Antinuclear antibodies in primary biliary cirrhosis. Semin Liver Dis. 2005;25:298-310. [PubMed] [DOI] |
| 4. | Worman HJ, Courvalin JC. Antinuclear antibodies specific for primary biliary cirrhosis. Autoimmun Rev. 2003;2:211-217. [PubMed] [DOI] |
| 5. | Feld JJ, Heathcote EJ. Epidemiology of autoimmune liver disease. J Gastroenterol Hepatol. 2003;18:1118-1128. [PubMed] [DOI] |
| 6. | Delgado J, Sperber AD, Novack V, Delgado B, Edel-man L, Gaspar N, Krugliak P, Odes S, Jotkowitz AB, Faszczyk M. The epidemiology of primary biliary cirrhosis in southern Israel. Isr Med Assoc J. 2005;7:717-721. [PubMed] |
| 7. | Leuschner U. Primary biliary cirrhosis--presentation and diagnosis. Clin Liver Dis. 2003;7:741-758. [PubMed] [DOI] |
| 8. | Flisiak R, Pelszynska M, Prokopowicz D, Rogalska M, Grygoruk U. High concentration of antimitocho-ndrial antibodies predicts progressive primary biliary cirrhosis. World J Gastroenterol. 2005;11:5706-5709. [PubMed] [DOI] |
| 9. | Koizumi H, Onozuka Y, Shibata M, Sano K, Ooshi-ma Y, Morizane T, Ueno Y. Positive rate of anti-mitochondrial antibody in Japanese corporate wor-kers. Rinsho Byori. 2000;48:966-970. [PubMed] |
| 10. | Sakauchi F, Mori M, Zeniya M, Toda G. Antimito-chondrial antibody negative primary biliary cirrho-sis in Japan: utilization of clinical data when patien-ts applied to receive public financial aid. J Epidemiol. 2006;16:30-34. [DOI] |
| 11. | Beuers U, Rust C. Overlap syndromes. Semin Liver Dis. 2005;25:311-320. [PubMed] [DOI] |
| 12. | Wichmann I, Montes-Cano MA, Respaldiza N, Alvarez A, Walter K, Franco E, Sanchez-Roman J, Nunez-Roldan A. Clinical significance of anti-multiple nuclear dots/Sp100 autoantibodies. Scand J Gastroenterol. 2003;38:996-999. [PubMed] [DOI] |
| 13. | Shimoda S, Nakamura M, Ishibashi H, Kawano A, Kamihira T, Sakamoto N, Matsushita S, Tanaka A, Worman HJ, Gershwin ME. Molecular mimicry of mitochondrial and nuclear autoantigens in primary biliary cirrhosis. Gastroenterology. 2003;124:1915-1925. [PubMed] [DOI] |
| 14. | Nakamura M, Takii Y, Ito M, Komori A, Yokoyama T, Shimizu-Yoshida Y, Koyabu M, Matsuyama M, Mori T, Kamihira T. Increased expression of nuclear envelope gp210 antigen in small bile ducts in primary biliary cirrhosis. J Autoi-mmun. 2006;26:138-145. [PubMed] [DOI] |
| 15. | Nakamura M. The significance of anti-nuclear envelope (gp210) antibody in primary biliary cirr-hosis. Nihon Rinsho Meneki Gakkai Kaishi. 2005;28:117-122. [PubMed] [DOI] |
| 16. | Nakamura M, Shimizu-Yoshida Y, Takii Y, Komori A, Yokoyama T, Ueki T, Daikoku M, Yano K, Mat-sumoto T, Migita K. Antibody titer to gp210-C terminal peptide as a clinical parameter for monitoring primary biliary cirrhosis. J Hepatol. 2005;42:386-392. [PubMed] [DOI] |
| 17. | Enarson P, Rattner JB, Ou Y, Miyachi K, Horigome T, Fritzler MJ. Autoantigens of the nuclear pore complex. J Mol Med. 2004;82:423-433. [PubMed] [DOI] |
| 18. | Miyachi K, Hankins RW, Matsushima H, Kikuchi F, Inomata T, Horigome T, Shibata M, Onozuka Y, Ueno Y, Hashimoto E. Profile and clinical signifi-cance of anti-nuclear envelope antibodies found in patients with primary biliary cirrhosis: a multicen-ter study. J Autoimmun. 2003;20:247-254. [PubMed] [DOI] |
| 19. | Nesher G, Margalit R, Ashkenazi YJ. Anti-nuclear envelope antibodies: Clinical associations. Semin Arthritis Rheum. 2001;30:313-320. [PubMed] [DOI] |
| 20. | 李 永哲, 刘 镭, 孙 庆国, 曾 常茜, 赵 振国, 佟 大伟, 张 蜀澜, 高 扬, 于 孟学, 朱 立平. 核包膜蛋白gp210、p62和LBR自身抗原基因克隆表达及其抗体诊断原发性胆汁性肝硬化的价值初探. 中华检验医学杂志. 2005;28:1120-1125. |
| 21. | Muratori P, Muratori L, Cassani F, Terlizzi P, Lenzi M, Rodrigo L, Bianchi FB. Anti-multiple nuclear dots (anti-MND) and anti-Sp100 antibodies in hepa-tic and rheumatological disorders. Clin Exp Immunol. 2002;127:172-175. [PubMed] [DOI] |
| 22. | Czaja AJ, Muratori P, Muratori L, Carpenter HA, Bianchi FB. Diagnostic and therapeutic implications of bile duct injury in autoimmune hepatitis. Liver Int. 2004;24:322-329. [PubMed] [DOI] |
| 23. | Janka C, Selmi C, Gershwin ME, Will H, Sternsdorf T. Small ubiquitin-related modifiers: A novel and independent class of autoantigens in primary bilia-ry cirrhosis. Hepatology. 2005;41:609-616. [PubMed] [DOI] |
| 24. | Bluthner M, Schafer C, Schneider C, Bautz FA. Identification of major linear epitopes on the Sp100 nuclear PBC autoantigen by the gene-fragment phage-display technology. Autoimmunity. 1999;29:33-42. [PubMed] [DOI] |
| 25. | Zuchner D, Sternsdorf T, Szostecki C, Heathcote EJ, Cauch-Dudek K, Will H. Prevalence, kinetics, and therapeutic modulation of autoantibodies against Sp100 and promyelocytic leukemia protein in a large cohort of patients with primary biliary cirrhosis. Hepatology. 1997;26:1123-1130. [PubMed] |