修回日期: 2006-01-15
接受日期: 2006-01-25
在线出版日期: 2006-03-18
目的: 研究大鼠脑、小肠肌间神经丛神经元和血浆内Ghrelin的表达, 探讨Ghrelin在水浸加束缚应激性胃溃疡中的作用及机制.
方法: 选择健康♂Wiater大鼠76只, 随机分为6组: 水浸加束缚组(10只); 侧脑室注射Ghrelin组(24只); 皮下注射L-NAME+侧脑室注射Ghrelin组(8只)和相应的3个对照组(正常大鼠组18只, 侧脑室注射生理盐水组8只, 皮下注射L-NAME+侧脑室注射生理盐水组8只). 采用放射免疫分析、荧光免疫组化双染和神经生理学等实验方法, 观察脑、小肠肌间神经丛和血浆内Ghrelin的表达, 探讨Ghrelin对大鼠束缚加水浸诱导的应激性胃溃疡的影响及机制.
结果: 在正常大鼠小肠肌间神经丛内和原代培养的肠肌间神经丛神经元均可见有Ghrelin样免疫反应阳性物(Ghrelin-IR)的表达, 且Ghrelin-IR与胆碱乙酰转移酶(ChAT)共同表达于同一神经元内, 但Ghrelin-IR不与一氧化碳合酶(NOS)和消化道感觉性神经元内特有的钙结合蛋白(Calbindin, Calb)共存. 在大鼠应激性胃溃疡产生的同时, 其血浆内Ghrelin-IR的含量明显减少(198.3±29.6 ng/L vs 141.7±26.5 ng/L, P = 0.026), 而下丘脑、延脑、垂体和肌间神经丛神经元内Ghrelin-IR的含量明显升高(分别为96.2±18.1 pg/mg vs 153.2±11.6 pg/mg, P = 0.006; 89.8±16.5 pg/mg vs 144.4±13.9 pg/mg, P = 0.007; 108.3±11.9 pg/mg vs 198.2±23.3 pg/mg, P = 0.002; 48.8±12.8 pg/mg vs 86.2±21.5 pg/mg, P = 0.02); 侧脑室注射Ghrelin大鼠应激性胃溃疡的产生明显减少, 且呈明显的量效依赖关系(溃疡指数: 生理盐水, 86.7±6.2; 50 ng Ghrelin, 79.3±10.7 P = 2.18; 500 ng Ghrelin, 61.3±11.7, P = 0.04; 5 000 ng Ghrelin, 35.6±10.8, P = 0.005), 经sc一氧化氮合酶抑制剂L-NAME后, Ghrelin的胃黏膜细胞保护作用消失.
结论: Ghrelin与ChAT共存表达于肠肌间神经丛胆碱能神经元; 应激性胃溃疡发生时, 中枢神经系统和血浆内Ghrelin的表达发生变化; 中枢Ghrelin对胃黏膜细胞具有保护作用, 且呈明显的量效依赖关系.
引文著录: 徐珞, 孙向荣, 韩晓华, 钟凤, IngeDepoortere, TheoPeeters. Ghrelin在大鼠神经系统中的表达对胃黏膜的保护作用. 世界华人消化杂志 2006; 14(8): 752-757
Revised: January 15, 2006
Accepted: January 25, 2006
Published online: March 18, 2006
AIM: To investigate the expression of Ghrelin in brain, intestinal myenteric plexus and plasma and study its possible cytoprotective effect and mechanism on gastric mucosa against stress-induced ulcers.
METHODS: Seventy-six healthy male Wistar rats were divided into 6 groups randomly: cold-water restraint group (n = 10); intracerebroventricular (icv) injection of Ghrelin group (n = 24); icv injection of Ghrelin after subcutaneous injection of Nω-Nitro-L-arginine methylester (L-NAME) group (n = 8) and three matched control groups. The expression of Ghrelin in rat brain, intestinal myenteric plexus and plasma were detected by radio-immunoassay (RIA) and double staining of immunofluorescence and immunohistochemistry. The effect and mechanism of Ghrelin on gastric mucosa against stress-induced ulcer were analyzed using neurophysiologic methods.
RESULTS: Ghrelin-positive immunoreaction (IR) was observed in the small intestinal myenteric plexus and primarily cultured myenteric plexus neurons. Ghrelin-IR co-localized with choline acetyl transferase (ChAT), but not with nitric oxide synthase (NOS) or Calbindin (Calb) in the same myenteric plexus neurons. In comparison with that in its matched control group, the content of Ghrelin-IR in plasma was significantly decreased (198.3 ± 29.6 ng/L vs 141.7 ± 26.5 ng/L, P < 0.05), but increased in hypothalamus, medulla oblongata, pituitary and intestinal myenteric plexus (96.2 ± 18.1 pg/mg vs 153.2 ± 11.6 pg/mg, P = 0.006; 89.8 ± 16.5 pg/mg vs 144.4 ± 13.9 pg/mg, P = 0.007; 108.3 ± 11.9 pg/mg vs 198.2 ± 23.3 pg/mg, P = 0.002; 48.8 ± 12.8 pg/mg vs 86.2 ± 21.5 pg/mg, P = 0.02; respectively). The formation of stress ulcers was markedly inhibited by microinjection of Ghrelin into the ventricle with a dose-dependent manner (ulcer index: normal saline 86.7 ± 6.2; 50 ng Ghrelin 79.3 ± 10.7, P = 2.18; 500 ng Ghrelin: 61.3 ± 11.7, P = 0.04; 5 000 ng Ghrelin: 35.6 ± 10.8, P = 0.005). However, after a subcutaneous injection of L-NAME, the cytoprotective effect of Ghrelin disappeared.
CONCLUSION: Ghrelin co-localizes with ChAT in intestinal myenteric plexus neurons. The expression of Ghrelin changes in the central nerves system (CNS) and plasma while stress ulcer happens. Ghrelin in the CNS can protect gastric mucosa with a dose-dependent manner, which is probably related to the synthesis of nitric oxide.
- Citation: Xu L, Sun XR, Han XH, Zhong F, Depoortere I, Peeters T. Expression of Ghrelin in nervous system and its cytoprotective action in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(8): 752-757
- URL: https://www.wjgnet.com/1009-3079/full/v14/i8/752.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i8.752
Ghrelin是1999年由日本科学家Kojima发现的一种由28个氨基酸组成的新的内源性脑肠肽, 是迄今发现的唯一生长激素释放激素受体(growth hormone secretagogue receptor, GHSR)的天然配体. 研究发现, Ghrelin与其受体结合后除了能促进生长激素(growth hormone, GH)的释放外, 还能调节胃肠运动、能量代谢平衡, 并在人类多种疾病或病理状态中发挥重要的作用. 因此, Ghrelin的研究进展是目前人们所关注的一个热点.
应激性溃疡在临床上比较常见, 由他引起的大出血和穿孔, 死亡率很高. 对应激性溃疡发病的机制已有许多研究, 但仍无明确结果. 大量资料表明[1-3], 机体对应激的反应启动于中枢神经系统, 后者的功能改变在应激性溃疡的发病机制中占有重要的地位. Sibilia et al[4]报道, Ghrelin在胃溃疡形成中具有重要的作用. 我们建立了大鼠水浸加束缚产生胃溃疡的模型, 通过采用放射免疫、荧光免疫组化双染和神经生理学等方法, 观察了Ghrelin在中枢神经系统和外周肠肌间神经丛的表达及其与应激性胃溃疡发生的关系, 并进一步探讨了中枢Ghrelin在应激性胃溃疡发生中的作用及其机制, 为以后有关应激条件下Ghrelin的研究提供了理论依据.
♂健康Wistar大鼠76只(由青岛市药检所提供), 体质量200-250 g. 随机分为(1)正常大鼠组(18只); (2)水浸加束缚应激组(10只); (3)侧脑室注射(icv)生理盐水(NS, 5 μL)对照组(8只); (4)icv Ghrelin 5 μL(50, 500, 5 000 ng)组(共24只); (5)sc L-NAME(70 mg/kg)+icv NS(5 μL)对照组(8只); (6)sc L-NAME(70 mg/kg)+icv Ghrelin 5 μL(500 ng)组(8只). Ghrelin免疫吸附试剂盒由军事医学科学院东亚免疫研究所提供; 激光共聚焦显微镜系日本Olympus公司产品; Ghrelin和Ghrelin抗体由比利时鲁汶大学提供. L-NAME为美国Sigma公司产品. ChAT抗体、NOS抗体和Calbindin抗体为美国Chemicon 公司产品. Indocarbocyanin(Cy3)交联的山羊抗小鼠IgG和异硫氰酸荧光素(fluorescein iso-thiocyanate, FITC)交联的山羊抗兔IgG系美国Jackson ImmunoResearch公司产品.
1.2.1 动物头部手术: 动物经乙醚麻醉后, 头部按常规消毒. 头部正中切口, 左侧脑室定位参照Paxions-Watson大鼠脑图谱(Avademic Press, 第四版), 前囱后1.0 mm, 左旁开1.0 mm, 颅骨表面下深3.5 mm, 用微量注射器注入实验用药物. 术后缝合头皮.
1.2.2 应激性胃溃疡模型制备: 动物头部手术结束后15 min, 参照徐叔云et al[5]方法制模. 大鼠空腹48 h(不禁水), 四肢绑扎于铁网上, 浸入20-22℃水中4 h, 水深至大鼠剑突水平. 实验结束后断头, 分别取血、脑、垂体和肠, 并检测胃溃疡产生情况.
1.2.3 血浆、脑、垂体和肠肌间神经丛Ghrelin的提取: 采血管中加入抗凝剂: 10 mL/L肝素(每mL全血10 μL)和抑肽酶(每mL全血500单位), 预冷、采集全血2 mL, 轻缓混匀迅速低温离心(4℃, 2 500 r/min 20 min), 取血浆-70℃保存. 将脑和垂体分别置于煮沸的生理盐水中煮5 min和3 min; 吸干、分离各脑区、称质量, 加1 mol/L盐酸1.0 mL制成匀浆, 室温下静置100 min. 然后加1 mol/L氢氧化钠1 mL中和, 离心(4 000 r/min)20 min, 取上清液待测. 显微镜下将回肠肌间神经丛分离、称质量, 放入含有1 mL浓度为0.1 mol/L的盐酸溶液匀浆器中进行匀浆, 经沸水煮沸10 min, 4℃离心(4 000 r/min)15 min, 取上清放入塑料管冰冻干燥, 浓缩后用PBS定容为0.5 mL待测液, -70℃保存.
1.2.4 胃溃疡的检测: 于腹上部正中切口, 在胃幽门及贲门两处用线结扎, 以4 g/L甲醛注入胃内, 至胃膨胀充盈, 在结扎线的两端切断, 摘下全胃. 30 min后沿胃大弯剖开, 观察病变部位及病变性质. 按文献[5]方法, 解剖显微镜下(10×)计算溃疡指数. 即损伤面的长径小于1 mm记1分, 1-2 mm记2分, 2-3 mm记3分, 3-4 mm记4分, 大于4 mm的将其分割为若干段, 每段按上法计算. 全胃的得分总和即为溃疡指数.
将正常大鼠断头处死(8只), 无菌状态下剖腹取出回肠, 一部分用于免疫组化实验, 另一部分用于肌间神经丛神经元的培养研究.
1.2.5 肠肌间神经丛神经元的培养: 用无菌含有抗生素(青链霉素和庆大霉素)的Krebs培养液冲洗回肠、切成1.0 cm小段. 用小镊子轻轻将浆膜层、纵行平滑肌层和肌间神经丛剥离, 放入含有消化酶(胶原蛋白酶、胰蛋白酶和牛血清白蛋白)的消化液内, 将组织剪碎, 并放入37℃孵育箱孵育30 min, 然后置于冰上, 离心(1 600 r/min) 10 min, 弃上清, 用MEDM培养液冲洗3次, 显微镜下筛选出肠肌间神经丛神经节. 将神经节放入含有神经细胞培养液Medium199(含100 mL/L胎牛血清, 50 μg/L 7 s神经生长因子, 青链霉素和庆大霉素)的培养盘内, 于CO2培养箱37℃孵育. 每隔2 d换一次培养液.
1.2.6 荧光免疫组织化学双染: 将回肠切段(1.5 cm), 显微镜下沿肠系膜剖开肠段, 黏膜向上平铺于装有Krebs培养液的实验盘内, 操作中始终保持通氧(50 mL/L CO2, 950 mL/L O2). 镜下轻轻将肠黏膜、黏膜下层和环形肌层剥离, 暴露肌间神经丛, 用40 g/L聚甲醛固定2 h, 0.01 mol PBS缓冲液漂洗3次, 每次5 min, 将标本贴于载玻片上. 切片在含有5 mL/L Triton X-100, 40 mL/L正常山羊血清的0.1 mol/L PBS溶液中孵育2 h, 将兔抗Ghrelin抗体(1∶400)和小鼠抗ChAT抗体(1∶200)或小鼠抗NOS抗体(1∶250)或小鼠抗Calb抗体(1∶200)混合液滴加到切片上, 将贴片置于湿盒内, 4℃孵育48 h. 之后将贴片用0.01 mol/L PBS漂洗3次, 每次5 min; 加入异硫氰酸荧光素(fluorescein iso thiocyanate, FITC)交联的羊抗兔IgG(1∶50)和Cy3羊抗小鼠 IgG(1∶500)混合液, 置于黑暗湿盒内, 4℃孵育2 h. 用0.01 mol/L PBS漂洗3次, 每次5 min. 最后用防淬灭荧光封片剂(Citifluor, 英国)封片, 激光共聚焦显微镜观察结果. 神经细胞培养7-9 d后, 镜下观察神经细胞, 待神经细胞生长成熟后, 用无菌PBS冲洗3次, 40 g/L多聚甲醛固定2 h后进行荧光双染, 步骤同上. 每次实验均设立空白对照, 同时用正常兔血清或小鼠血清代替本实验中用的一抗, 其他步骤同前, 作为阴性对照
1.2.7 Ghrelin的放射免疫测定: 配制Ghrelin标准液, 1∶8 000抗Ghrelin血清和125I-Ghrelin液. 组织及血浆内Ghrelin的放免检测严格按说明书进行操作. 测定程序: 各管加125I-Ghrelin 100 μL, 抗Ghrelin血清100 μL. 样品管加100 μL(下丘脑)或300 μL(其他组织或血), 标准管加Ghrelin 100 μL, 最后以磷酸缓冲液补足总反应体积为500 μL; 4℃冰箱内孵育24 h; 各管加1∶3羊抗兔血清100 μL, 继续孵育24 h, 离心(4 000 r/min)20 min, 弃上清液. 测沉淀物的每分钟脉冲数(counts per minute, cpm), 根据同批测定管的Ghrelin竞争抑制曲线, 求取每升血浆或每克组织中Ghrelin-IR的含量.
统计学处理 数据均用mean±SD表示. 两样本均数的比较用t检验法, P<0.05为差异有统计学意义.
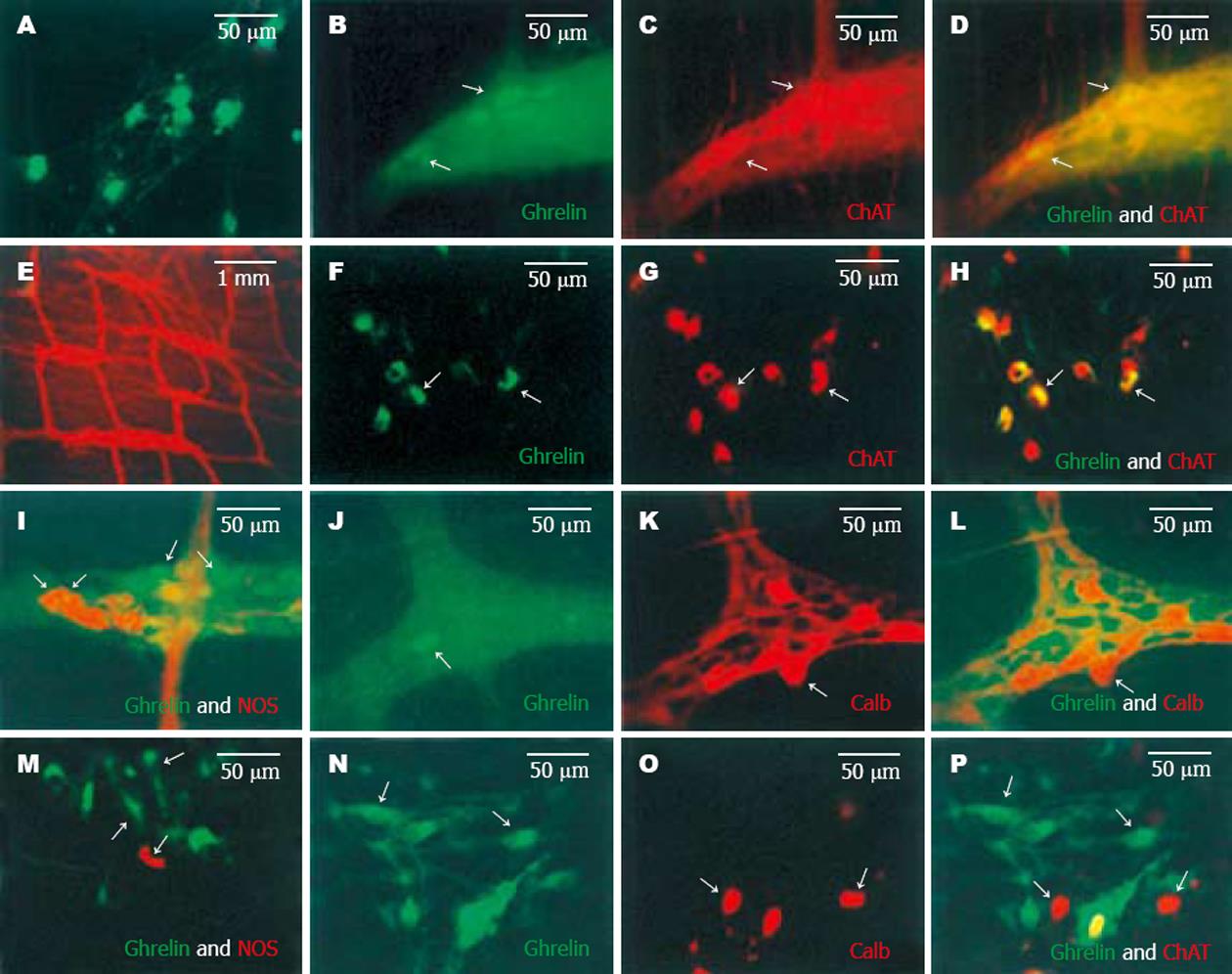
肠肌间神经丛神经元培养5-7 d后, 镜下可见神经元胞体有神经纤维向四周伸长; 当神经元培养7-9 d后, 镜下可见神经元以神经结为中心向四周生长, 胞质饱满, 神经纤维之间形成网络(图1A). 荧光双染结果显示, 正常大鼠肠肌间神经丛内可见有Ghrelin-IR神经元(图1B, J)、ChAT-IR神经元(图1C)和NOS-IR神经元(图1I)的表达. 且Ghrelin-IR与ChAT神经元共存(图1D), 但在nNOS神经元中未发现有Ghrelin的表达(图1I), 该结果进一步在原代培养的肌间神经节细胞得到认可. 镜下可见有大量Ghrelin-IR神经元(图1F), 胞体呈卵圆形或椭圆形, 胞核大而椭圆.
Ghrelin-IR主要分布于胞质和突起. 与肠肌间神经丛组织染色结果相同, Ghrelin-IR与ChAT神经元共存(图1F-H), 但不与NOS神经元共存于同一神经元内(图1M). 采用肠内感觉神经元特异性表达的钙结合蛋白(Calbindin, Calb)抗血清与Ghrelin抗血清双染, 结果显示在肠肌间神经丛和原代培养的肠肌间神经节神经元内Ghrelin-IR与Calb没有共存现象(图1J-L, N-P), 提示Ghrelin样免疫阳性神经元不属于肠感觉神经元.
空腹48 h, 束缚后水浸4 h, 诱导大鼠应激性胃溃疡产生, 大鼠血浆中Ghrelin-IR含量显著低于正常对照组(P<0.05); 下丘脑、延脑及垂体中Ghrelin-IR含量明显增加(P<0.01), 但中脑和桥脑内Ghrelin-IR含量与正常对照组比较无显著改变; 肠肌间神经丛神经元Ghrelin-IR含量也明显高于正常对照组(P<0.05, 表1).
镜下正常大鼠胃黏膜完整无损, 未见有出血点和溃疡形成. 大鼠经束缚加水浸4 h, 镜下见胃黏膜出血, 有大量溃疡形成. 但侧脑室注射不同剂量Ghrelin后(50-5 000 ng), 束缚加水浸, 大鼠应激性胃溃疡的产生显著轻于侧脑室注射生理盐水(NS)后束缚加水浸对照组, 且呈显著的量效依赖关系(50 ng Ghrelin, 溃疡指数: 79.3±10.7, P>0.05; 500 ng Ghrelin, 溃疡指数: 61.3±11.7, P<0.05; 5 000 ng Ghrelin, 溃疡指数: 35.6±10.8, P<0.01). 经sc NOS抑制剂L-NAME(70 mg/kg) 15 min后, 侧脑室注入Ghrelin 5 μL(500 ng), 大鼠应激性胃溃疡的产生与侧脑室注射NS对照组和L-NAME+NS组相比均无显著差异(溃疡指数分别为82.0±12.0; 86.7±6.2; 84.1±11.4, P>0.05), 即Ghrelin对胃黏膜细胞保护作用消失.
急性胃黏膜损害(acute gastric mucosa lesion, AGML)是机体在严重创伤、烧伤、休克、感染以及内脏功能严重受损等多种危重情况下发生的, 以胃黏膜的糜烂、溃疡、出血为主要特征的急性应激性病变. 在严重烧伤、创伤和严重感染患者中, 其发生率可达80%-100%[6-7], 是创伤后最为常见的内脏并发症之一[8]; 一旦合并大出血, 处理困难, 死亡率高, 对这种危重患者有着潜在的致命性威胁. 鉴于AGML在临床上的重要性, 多年来, 国内外学者对其进行了大量的基础和临床研究, 迄今其发病机制尤其中枢机制尚未澄清. 应激性胃黏膜损害或胃溃疡是临床危重疾病的常见并发症, 易并发上消化道出血, 预后凶险. 应激是有害或过强刺激引起的机体非特异性反应, 多种形式的应激可引起体内一些激素水平的变化. 传统观点认为引起应激效应的机制是由于交感神经兴奋和下丘脑-垂体-肾上腺功能反应, 尤其是下丘脑释放促皮质激素释放因子(CRF)的中枢效应所致[9]. 近年来发现, 应激期间中枢的某些神经肽(如P物质、神经降压素、脑啡肽、胃动素和胃动素相关肽 Ghrelin)也参与了应激过程的调控[10-12]. 这些肽类实际上广泛分布于中枢神经和外周神经系统. Ghrelin主要由胃黏膜的A/X细胞产生[13], 中枢神经系统也发现有Ghrelin样免疫活性细胞分布[14], 固称之为脑-肠肽, 他具有调节胃酸分泌、胃肠运动和能量代谢等功能[15-17]. 本研究发现小肠肌间神经丛内有Ghrelin免疫反应阳性神经元的表达, 且Ghrelin免疫阳性细胞与ChAT共存, 提示Ghrelin主要分布在肠肌间神经丛兴奋性运动神经元, 该论点也被原代培养的肠肌间神经节神经元荧光双染实验得到了进一步的证实. 但Ghrelin样免疫反应神经元与肠感觉神经元特有的Calb在同一神经元内无共同表达, 提示Ghrelin样神经元不属于肠感觉性神经元.
目前较为一致的意见认为, 应激性溃疡病的发生、发展取决于有害刺激损伤机制和抗损伤机制的平衡状态, 而神经系统在其中又具有特殊重要的作用. 文献报道, 脑-肠肽参与应激性溃疡的形成和调节[18], 下丘脑和边缘系统的某些部位对胃肠功能起重要调节作用[19]. 本实验观察到, 大鼠空腹48 h后, 束缚后水浸4 h, 血浆中Ghrelin含量比正常对照组大鼠明显减少, 而下丘脑、延脑和垂体和肠肌间神经丛神经元中Ghrelin含量也明显增加, 由此表明中枢和外周神经系统中的Ghrelin均参与了应激性胃溃疡的形成. 应激时血浆内Ghrelin含量的降低可能与应激导致胃肠黏膜溃疡、A/X内分泌细胞损伤和功能降低有关. 下丘脑的分泌功能及其所分泌的各种肽类激素、神经多肽是下丘脑参与调节内脏活动、生理功能及垂体分泌的重要物质基础[20]. 本研究发现, 中枢内下丘脑Ghrelin的含量最高, 当应激性胃溃疡产生时, 下丘脑内Ghrelin的含量变化为最大, 由此证实了下丘脑作为中枢神经系统和内分泌系统的连接点在应激反应中具有举足轻重的作用[21].
Ghrelin作为一种重要的脑-肠肽和胃肠激素对胃肠运动和某些消化液的分泌具有重要的生理意义. 有文献报道, Ghrelin广泛分布于中枢神经系统. 中枢内Ghrelin参与胃肠功能的调控[22-24]. 本研究发现侧脑室内注射Ghrelin可明显减轻束缚加水浸诱导的胃溃疡的产生, 且呈明显的量效依赖关系, 提示中枢Ghrelin可能参与了胃黏膜细胞保护作用的调控, 但Ghrelin通过何种途径尚不清楚, 有待于进一步深入探讨. 有资料表明, 某些神经肽增加胃酸分泌而加强溃疡的形成. 但许多抗胃酸分泌的神经肽, 是通过某些化学因子或神经调制而抵抗胃肠溃疡的发生[25]. 一氧化氮(nitric oxide, NO)是新近发现的一种胃黏膜保护因子, 对酒精、缺血-再灌注等诱发的胃黏膜损伤具有保护作用[26]. 本实验发现, 先经皮下注射一氧化氮合酶抑制剂L-NAME, 再给侧脑室注射Ghrelin, 则Ghrelin对胃黏膜的细胞保护作用消失, 但经皮下注射L-NAME, 侧脑室注射生理盐水, 胃溃疡的产生与对照组相比无显著差异. 该研究结果提示, Ghrelin对胃黏膜的细胞保护作用可能与NO的合成有关. 但Ghrelin如何调控NO的释放、在中枢通过何种途径起作用,尚待于今后进一步探讨. 随着对Ghrelin结构和功能研究的深入, Ghrelin的生理作用机制及其可能的临床意义将逐渐被阐明.
应激性溃疡在临床上比较常见, 由他引起的大出血和穿孔, 死亡率很高. 大量资料表明, 机体对应激的反应启动于中枢神经系统, 后者的功能改变在应激性溃疡的发病机制中占有重要的地位. Ghrelin研究进展是目前人们所关注的一个热点. 有文献报道Ghrelin在胃溃疡形成中具有重要的作用.
Ghrelin是1999年发现的脑肠肽. Ghrelin调节胃肠功能的中枢机制及其临床应用研究是人们所关注的一个热点.
目前关于Ghrelin对消化系统活动的影响主要集中在摄食量、体质量和胃黏膜细胞保护作用等外周机制研究. 我们的研究着重从中枢神经系统入手, 并结合外周胃肠神经系统Ghrelin表达的改变, 由此开辟了更深层次的研究领域.
本研究将为临床上Ghrelin及其拟似剂对应激性胃溃疡的治疗提供有价值的实验依据.
1 Ghrelin: 1999年由日本科学家Koji-ma发现的一种由28个氨基酸组成的新的内源性脑肠肽, 是迄今发现的唯一生长激素释放激素受体(growth hormonesecretagogue receptor, GHSR)的天然配体. Ghrelin与其受体结合后除了能促进生长激素的释放外, 还能调节胃肠运动、能量代谢平衡, 并在人类多种疾病或病理状态中发挥重要的作用. 2 应激性溃疡: 应激性溃疡又称急性胃黏膜病变、急性出血性胃炎, 是指机体在应激状态下胃和十二指肠出现急性糜烂和溃疡.
本实验设计严密, 对于内源性的Gherlin分布, 外源性的Gherlin的体内作用及其机制通过相关的实验分组对照, 实验内容丰富, 科学结论较明确, 实验证据充足, 结果让人信服.
电编: 张敏 编辑:潘伯荣
| 1. | Ghizoni DM, Pavanati KC, Arent AM, Machado C, Faria MS, Pinto CM, Gasparotto OC, Goncalves S, Dafre AL. Alterations in glutathione levels of brain structures caused by acute restraint stress and by nitric oxide synthase inhibition but not by intraspecific agonistic interaction. Behav Brain Res. 2006;166:71-77. [PubMed] [DOI] |
| 2. | Kiyatkin EA. Brain hyperthermia as physiological and pathological phenomena. Brain Res Brain Res Rev. 2005;50:27-56. [PubMed] [DOI] |
| 3. | Wright RJ. Stress and atopic disorders. J Allergy Clin Immunol. 2005;116:1301-1306. [PubMed] [DOI] |
| 4. | Sibilia V, Rindi G, Pagani F, Rapetti D, Locatelli V, Torsello A, Campanini N, Deghenghi R, Netti C. Ghrelin protects against ethanol-induced gastric ulcers in rats: studies on the mechanisms of action. Endocrinology. 2003;144:353-359. [PubMed] [DOI] |
| 5. | 徐 叔云, 卞 如濂, 陈 修主编. 药理实验方法学. 第1版. 北京: 人民卫生出版社 1991; 1158-1162. |
| 6. | Navab F, Steingrub J. Stress ulcer: is routine pro-phylaxis necessary? Am J Gastroenterol. 1995;90:708-712. [PubMed] |
| 7. | Miller TA, Tornwall MS, Moody FG. Stress erosive gastritis. Curr Probl Surg. 1991;28:453-509. [PubMed] [DOI] |
| 8. | Cook D, Heyland D, Griffith L, Cook R, Marshall J, Pagliarello J. Risk factors for clinically important upper gastrointestinal bleeding in patients requiring mechanical ventilation. Canadian Critical Care Trials Group. Crit Care Med. 1999;27:2812-2817. [PubMed] [DOI] |
| 9. | Mastorakos G, Pavlatou M. Exercise as a stress model and the interplay between the hypothalamus-pituitary-adrenal and the hypothalamus-pituitary-thyroid axes. Horm Metab Res. 2005;37:577-584. [PubMed] [DOI] |
| 12. | Suematsu M, Katsuki A, Sumida Y, Gabazza EC, Murashima S, Matsumoto K, Kitagawa N, Akatsuka H, Hori Y, Nakatani K. Decreased circulating levels of active ghrelin are associated with increased oxidative stress in obese subjects. Eur J Endocrinol. 2005;153:403-407. [PubMed] [DOI] |
| 13. | Ueno H, Yamaguchi H, Kangawa K, Nakazato M. Ghrelin: a gastric peptide that regulates food intake and energy homeostasis. Regul Pept. 2005;126:11-19. [PubMed] [DOI] |
| 14. | Guan JL, Wang QP, Kageyama H, Takenoya F, Kita T, Matsuoka T, Funahashi H, Shioda S. Synaptic interactions between ghrelin- and neuropeptide Y-containing neurons in the rat arcuate nucleus. Peptides. 2003;24:1921-1928. [PubMed] [DOI] |
| 15. | Asakawa A, Inui A, Yuzuriha H, Ueno N, Katsuura G, Fujimiya M, Fujino MA, Niijima A, Meguid MM, Kasuga M. Characterization of the effects of pancreatic polypeptide in the regulation of energy balance. Gastroenterology. 2003;124:1325-1336. [PubMed] [DOI] |
| 16. | Otukonyong EE, Dube MG, Torto R, Kalra PS, Kalra SP. Central leptin differentially modulates ultradian secretory patterns of insulin, leptin and ghrelin independent of effects on food intake and body weight. Peptides. 2005;26:2559-2566. [PubMed] [DOI] |
| 17. | De Smet B, Depoortere I, Moechars D, Swennen Q, Moreaux B, Cryns K, Tack J, Buyse J, Coulie B, Peeters TL. Energy homeostasis and gastric empty-ing in ghrelin knockout mice. J Pharmacol Exp Ther. 2006;316:431-439. [PubMed] [DOI] |
| 18. | Funk D, Li Z, Le AD. Effects of environmental and pharmacological stressors on c-fos and corti-cotropin-releasing factor mRNA in rat brain: Rela-tionship to the reinstatement of alcohol seeking. Neuroscience. 2006;138:235-243. [PubMed] [DOI] |
| 19. | Stanley S, Wynne K, McGowan B, Bloom S. Horm-onal regulation of food intake. Physiol Rev. 2005;85:1131-1158. [PubMed] [DOI] |
| 20. | 吴 丽颖, 王 福庄, 范 明. 下丘脑中某些激素在低氧应激时的变化. 中国神经免疫学和神经病学杂志. 2004;11:50-54. |
| 21. | Herman JP, Ostrander MM, Mueller NK, Figueiredo H. Limbic system mechanisms of stress regulation: hypothalamo-pituitary-adrenocortical axis. Prog Neuropsychopharmacol Biol Psychiatry. 2005;29:1201-1213. [PubMed] [DOI] |
| 22. | Levin F, Edholm T, Ehrstrom M, Wallin B, Schmidt PT, Kirchgessner AM, Hilsted LM, Hellstrom PM, Naslund E. Effect of peripherally administered ghrelin on gastric emptying and acid secretion in the rat. Regul Pept. 2005;131:59-65. [PubMed] [DOI] |
| 23. | Locatelli V, Bresciani E, Bulgarelli I, Rapetti D, Torsello A, Rindi G, Sibilia V, Netti C. Ghrelin in gastroenteric pathophysiology. J Endocrinol Invest. 2005;28:843-848. [PubMed] [DOI] |
| 24. | Tack J, Depoortere I, Bisschops R, Verbeke K, Janssens J, Peeters T. Influence of ghrelin on gastric emptying and meal-related symptoms in idiopathic gastroparesis. Aliment Pharmacol Ther. 2005;22:847-853. [PubMed] [DOI] |
| 25. | Fujimoto K, Fujimoto H, Ohata M. Changes of serum calcitonin in stress load. J Bone Miner Metab. 2000;18:22-26. [PubMed] |