修回日期: 2006-01-05
接受日期: 2006-02-11
在线出版日期: 2006-03-08
目的: 观察氢溴酸槟榔碱(Ah)促进培养的结肠平滑肌细胞收缩作用及对胞内游离Ca2+浓度的影响.
方法: 培养大鼠结肠平滑肌细胞, 分为4组: 正常对照组、Ah刺激组、乙酰胆碱(Ach)刺激组、阿托品预处理组. 应用特异性Ca2+荧光批示剂Fluo-3/AM负载细胞, 激光共聚焦显微镜检测游离Ca2+浓度和细胞收缩率.
结果: 正常对照组细胞未发生自主性收缩, 因指示剂的衰减, 荧光强度(FI)有递减的趋势; Ah刺激组在加药后短时间内胞内钙离子浓度迅速升高, 出现一个波峰, FI平均基础值与峰值有差异(P<0.05), 而后胞内钙离子浓度再缓慢攀升, 在484.0±47.6 s达到高峰, 而后有一个较长时间的平台期, 在1 400 s左右恢复至静息水平, FI基础值与峰值有显著差异(P<0.01), 细胞收缩百分数为20.70%±0.07%; Ach刺激组在加药后胞内钙离子浓度升高, 形成一个小波峰, FI基础值和峰值差异有显著性(P<0.01). 随后胞内钙离子浓度缓慢攀升, 在600 s左右达到高峰, 而后有一个较长时间的平台期. FI基础值与峰值差异有显著性(P<0.001); 经阿托品预孵育处理后的细胞, 加入Ah后, 其收缩效应被完全抑制.
结论: Ah可引起结肠平滑肌细胞收缩, 升高细胞内游离Ca2+浓度. 其收缩效应可以被M受体阻断剂阿托品所抑制.
引文著录: 梁宁霞, 衣兰娟, 田琳, 胡凡, 刘翠萍, 魏睦新. 槟榔碱促结肠平滑肌细胞收缩及对胞内钙离子浓度的影响. 世界华人消化杂志 2006; 14(7): 676-681
Revised: January 5, 2006
Accepted: February 11, 2006
Published online: March 8, 2006
AIM: To explore the possible role of Arecolinehy-drobromide (Ah) in the dynamics of digestive tract and the effects of Ah on the contraction of colon smooth muscle cells (SMCs) and the con-centration of intracellular [Ca2+]i.
METHODS: SMCs from colon of mice were cultured in vitro. Based on different treatment methods, four groups were divided into as follows: Ah group in which cultured SMCs were stimulated by Ah; control group in which there was no additional treatment on cultured SMCs; Acetylcholine (Ach) group in which cultured SMCs were stimulated by Ach; Atropine group in which cultured SMCs were pretreated with atropine before Ah was added. Laser scanning confocal microscope (LSCM) was used to measure the concentration of intracellular [Ca2+]i and the contraction of colon SMCs in the above four groups.
RESULTS: No spontaneous cellular contraction took place in control group in which there was a tendency of decrease in fluorescent intensity because of attenuation of the indicator. In Ah group, a rapid elevation in the concentration of intracellular [Ca2+]i occurred shortly after Ah was added, which was recorded as a pulse wave. Then there was a gradual and slow increase in intracellular [Ca2+]i which reached its peak at 484.0 ± 47.6 s. The peak was followed by a quite long plateau and afterward returned to the resting level at 1 400 s. The percentage of cellular contraction was 20.70% ± 0.07%. In Ah and Ach groups, a tendency of SMCs contraction in accordance with elevation of intracellular [Ca2+]i was observed following Ah or Ach was added. However, the effect was faster and shorter in Ah group than that in Ach group. The contractive effect of Ah was completely inhibited in SMCs pretreated by atropine.
CONCLUSION: Ah can cause contraction of SMCs of colon and increase of intracellular [Ca2+]i. The contractive effect of Ah can be effectively inhibited by atropine. Ah may be promising for improving dynamics of digestive tract.
- Citation: Liang NX, Yi LJ, Tian L, Hu F, Liu CP, Wei MX. Effects of Arecolinehydrobromide on contraction and intracellular free Ca2+ concentrations of colonic smooth muscle cells. Shijie Huaren Xiaohua Zazhi 2006; 14(7): 676-681
- URL: https://www.wjgnet.com/1009-3079/full/v14/i7/676.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i7.676
氢溴酸槟榔碱(arecoline hydrobromide, Ah)是从槟榔中分离得到的一种生物碱, 作为槟榔的有效成分, 槟榔碱近些年来主要被用于防治钉螺, 在促胃肠动力作用方面的研究不多[1]. 我们采用了离体结肠单个平滑肌细胞制备及其运动记录技术观察了不同浓度的Ah对大鼠急性分离结肠平滑肌细胞的直接作用, 证实了Ah可使游离的单个结肠平滑肌细胞收缩[2]. 细胞内游离钙在细胞信息传递过程中起着重要作用. 钙离子作为细胞内第二信使, 在细胞兴奋、增殖及收缩等细胞反应中起重要作用, 游离钙离子浓度, 能反映细胞的状态、药物和环境等对细胞的影响[3]. 目前, Ah对培养的结肠平滑肌细胞收缩及胞内钙离子浓度的影响未见报道. 我们采用激光共聚焦显微镜技术, 观察加入Ah后细胞的收缩反应及测定和分析Ah对培养的结肠平滑肌细胞内钙离子的动态变化.
SD大鼠, 雌雄不拘, 体质量250 g左右. 由南京医科大学医学实验动物中心提供. 胎牛血清, DMEM培养基, Gibco公司产品. Ⅱ型胶原酶、大豆胰蛋白酶抑制剂, 槟榔碱, Sigma公司产品. N-2羟乙基哌嗪-N-2'-乙烷磺酸(HE-ES), BSA, Amerseco公司产品. Fluo-3/AM乙酰甲酯: Calbiochem公司产品. 谷氨酸钠: 中国医药集团上海化学试剂产品. Trypan蓝: 北京有机化工厂产品. 其他均为国产分析纯试剂. Hepes Ringer缓冲液的配制(mmol/L): HEPES 24.5, NaCl 101, KCl 13, NaH2PO4 2.5, CaCl2 21.8, MgCl2 21.2, 谷氨酸钠5, 谷氨酰胺2, 葡萄糖11.5, BSA 1 g/L. pH值用70 g/L NaHCO3调至7.2. PBS液的配制(0.01 mol/L): NaCl 2 g, KCl 0.05 g, NaH2PO4 0.287 5 g, KH2PO4 0.05 g, 双蒸水加至200 mL. 超净工作台(苏州净化设备厂); 24孔细胞培养板(丹麦Nunc); 25 cm2细胞培养瓶(丹麦Nunc); Beckman离心机(美国Beckman公司); TH-C型恒温震荡器(江苏太仓实验设备厂); 体视显微镜; 倒置显微镜(Olympus); 动物手术器械; 细胞计数板(上海光学仪器厂); 尼龙筛网(100目); CO2细胞培养箱(Type4, 德国Heraeus); 激光扫描共聚焦显微镜(Carl Zeiss公司, 德国).
结肠平滑肌细胞培养见参考文献[4]. 每次取正常大鼠一只, 实验时断椎处死, 在无菌条件下快速自肛门上2 cm取结肠10-15 cm, 生理盐水中反复灌肠冲洗, 移入含青链霉素的Hepes Ringer缓冲液中浸泡. 超净工作台上在体视显微镜下仔细刮去黏膜及浆膜层, 将肌层组织剪碎成匀浆状, 加入到4 mL含1 g/L Ⅱ胶元酶和0.1 g/L大豆胰蛋白酶抑制剂的消化液中, 30℃恒温水浴20 min, 离心, 弃消化液. 再加入6 mL消化液中, 30℃震荡30 min. 消化后再对倍缓冲液稀释以中止消化, 用滴管反复轻柔吹打, 1 000 r/min离心3 min, 用10 mL DMEM培养液重悬细胞, 过100目筛网, 取细胞滤液用Trypan蓝染色检查细胞活性, 确认活细胞在90%以上. 用DMEM培养液将细胞浓度调整至5×107/L, 接种至培养瓶中, 放入培养箱内, 37℃, 950 mL/L O2和50 mL/L CO2条件下培养. 细胞培养24 h后换液, 弃去未贴壁细胞, 加入培养液继续培养, 以后每3-4 d换液1次, 期间用倒置显微镜观察细胞生长情况. 7-9 d, 细胞长满后用胰酶传代. 取第2代培养细胞观察. 培养的结肠平滑肌细胞分为1: 正常对照组; 2: Ah刺激组: 即时加入1×10-5 mol/L的Ah刺激结肠平滑肌细胞; 3: Ach刺激组: 即时加入1×10-3 mol/L的Ach刺激结肠平滑肌细胞; 4: 阿托品组: 以0.5 g/L阿托品处理5 min, 再用1×10-5 mol/L的Ah刺激平滑肌细胞.
1.2.1 胞内钙离子浓度变化: Fluo-3/AM用纯二甲基亚砜(DMSO)配成1 mol/L的储备液, 低温保存备用, 实验前Fluo-3/AM用PBS液稀释10倍. 将培养的细胞标本内培养液弃去, 用PBS液冲洗细胞3次, 加入探针, 放入37℃孵箱中约20 min, 于荧光显微镜下观察负载情况, 如荧光强度较低, 可适当延长5-10 min, 然后用PBS洗去细胞外残余染料. 将探针孵育好的细胞, 置于200倍光学显微镜下, 选择单个或两个细胞及其层面, 再在激光显微镜下进行连续动态扫描. 与钙离子结合的Fluo-3在波长488 nm处激发, 发射波长526 nm, 计算机记录结肠平滑肌细胞的钙离子荧光强度并储存结果. 细胞内荧光强度变化可指示细胞内游离钙离子浓度的变化. 实验结果以给药前后单个细胞的荧光强度(fluorescent intensity, FI)及幅度的变化表示细胞内游离钙离子浓度的相对变化.
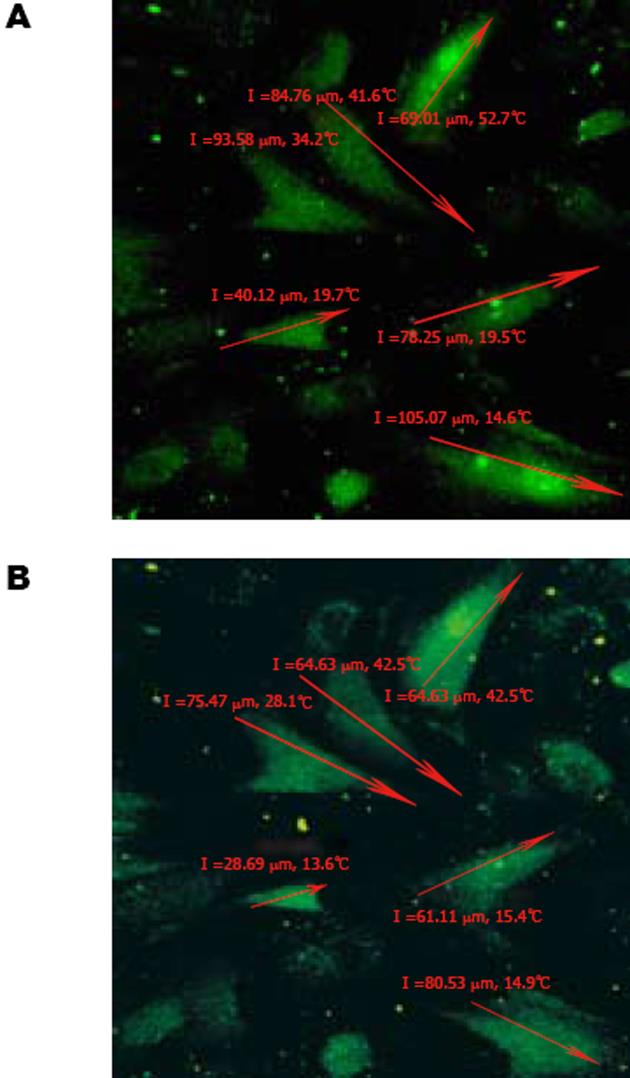
1.2.2 细胞收缩反应的测量: 在激光共聚焦显微镜下连续动态扫描的荧光图像中, 随机抽取6个细胞, 测量加药前后细胞的长度. 细胞收缩反应以给药前后细胞平均长度下降百分数表示.
公式为: 细胞收缩百分数 = (给药前平均细胞长度-给药后平均细胞长度)/给药前平均细胞长度×100%[2].
统计学处理 数据经计算机系统对图形及时间进行实时测量而获得. 使用软件为LSM510自带软件. 实验结果均以mean±SD表示. 统计处理采用SPSS软件.
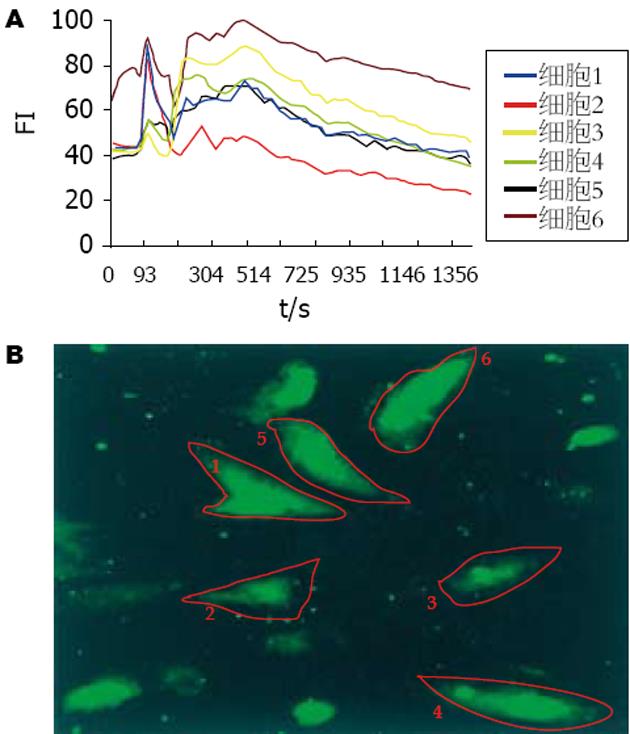
结肠平滑肌细胞以Fluo-3/AM负载后, 在激光共聚焦显微镜下观察, 呈规则的梭形或多边形, 轮廓清晰. 胞核荧光较强, 胞质较弱. 由于细胞所处状态不同, 各细胞荧光强度有差异, 有的细胞荧光强度强, 有的细胞荧光强度弱(图1A). 用Fluo-3/AM负载结肠平滑肌细胞荧光图像清晰, 强弱变化, 可较好地显示细胞内游离钙离子浓度的变化过程. 在加药后细胞荧光强度增强, 后逐渐变弱, 再渐渐由弱变强, 最后再由强变弱, 在1 400 s左右恢复至原荧光强度(图1B-E).
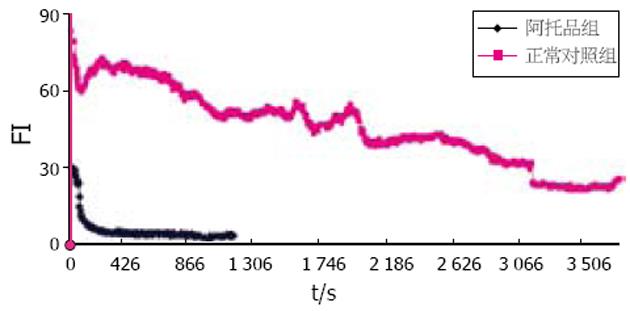
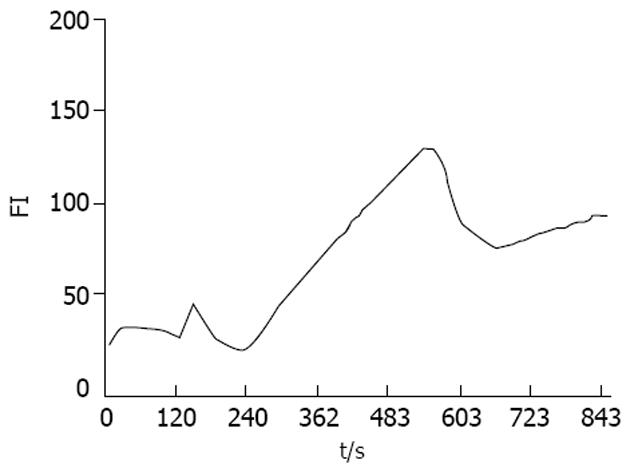
Time course所示动态曲线表明细胞内标记区域荧光强度(FI)的变化. FI与钙离子浓度呈正比, 因此在本实验中以FI表示钙离子浓度的变化. 加药后短时间内胞内钙离子浓度迅速升高, 出现第一个波峰(图2), FI平均基础值与峰值有差异(P<0.05), 随后胞内钙离子浓度再缓慢攀升, 出现第二个波峰, 在484.01±47.55 s时达到高峰, FI基础值与峰值有显著差异(P<0.01, 表1). 而后有一个较长时间的平台期, 在1 400 s左右恢复至静息水平. 正常对照组结肠平滑肌细胞游离钙离子浓度变化曲线较为平坦, 没有出现较大的波动(图3), 因为观察时间较长, 荧光指示剂衰减, 曲线出现下降趋势. FI基础值与峰值差异无显著性(P>0.05, 表1). 1×10-3 mol/L Ach能引起胞内钙离子浓度迅速升高, 出现第一个波峰(图4), FI基础值和峰值差异有显著性(P<0.01). 随后胞内钙离子浓度缓慢攀升, 出现第二个波峰, 在600 s左右达到高峰, FI基础值与峰值差异有显著性(P<0.001, 表1). 而后有个较长时间的平台期. 经过阿托品孵育5 min后, 1×10-5 mol/L Ah升高胞内钙离子浓度的作用被抑制(图3). FI基础值与峰值差异无显著性(P>0.05, 表1).
1×10-5 mol/L的Ah对结肠平滑肌细胞具有显著的收缩作用(图5), 其细胞收缩百分数为20.70%±0.07%.
当前, 结肠动力障碍性疾病(如慢性传输性便秘等)在我国的发病率较高, 其病理生理主要表现为结肠运动功能的减退, 促进结肠动力是治疗此类疾病的主要手段. 而目前临床上常用的促结肠动力药物较少, 且大多数具有不同的副作用, 如5-HT4受体激动剂西沙比利, 经研究证实对结肠有一定的兴奋作用[6], 但由于心脏和其他方面的毒副作用[7-8]近年来人们就中药对胃肠动力的影响及其调节机制作了一些探索, 并提出了"胃肠动力中药"这概念[9], 其中槟榔被认为是具有开发前景的促胃肠动力中药, 其主要有效成分槟榔碱为M受体激动剂[10-11], 通过激动M2受体, 槟榔碱可兴奋神经元[12], 增加细胞内钙离子浓度[13].
目前, 激光共聚焦图像系统结合新一代荧光染料的使用, 已广泛应用于精确分析活细胞内钙离子的动态变化. 脂溶性钙荧光指示剂Fluo-3/AM可穿越细胞膜进入细胞内, 被活细胞内的非特异酯酶水解后, 与细胞内游离钙呈高度特异性结合, 并在一定波长激发光激发后产生荧光. 由于Fluo-3/AM是一种单波长的发光基团, 其荧光强度与[Ca2+]i成正比, 因而可精密观察分析细胞内[Ca2+]i的动态变化. 本实验中以荧光强度(FI)表示浓度的变化. 与以往的细胞内[Ca2+]i的测定方法比较, 此项技术以激光为光源, 结果准确, 背景噪音小, 对细胞损伤小[14]. Fluo-3/AM为新型、可激发出可见光的钙荧光指示剂, 较易负载染色至细胞内, 对游离钙离子敏感性高, 可连续动态监测钙离子浓度的变化[15].
由于胃肠道平滑细胞膜上的钙通道远比骨骼肌细胞膜上的钙通道多, 而钠通道又比骨骼肌少许多, 所以钙离子和钙通道在胃肠平滑肌动作电位产生中居主导地位[16]. 现在一般认为, 平滑肌收缩活动与胞内钙离子浓度变化密切相关. 高浓度Ca2+引起平滑肌收缩, 低浓度Ca2+引起平滑肌舒张. 平滑肌收缩时的钙离子来源于细胞外液Ca2+内流和细胞内钙库Ca2+释放(主要是肌质网, SR)[17]. 胞外Ca2+内流是通过质膜钙离子通道来控制的. 质膜钙离子通道分为两类: 电压门控钙通道和配体门控钙通道. 电压门控通道是主要通道[18], 他又可分为T型和L型通道. 肌质网的Ca2+释放调节机制至少有两种: 一是三磷酸肌醇[inositol(1, 4, 5)-friphosphate, IP3]与其受体(IP3R)结合后, 引起钙通道开放; 二是ryanodine受体(RyR)钙通道. IP3介导的Ca2+释放是量子化, 具有"全或无"的特性. 在无Ca2+条件下IP3几乎不能诱导其受体开放, 当细胞内Ca2+浓度升高时, IP3R释放Ca2+增加, 构成正反馈; 如果Ca P<浓度升高超过300 nmol/L时, IP3R对IP3变得不敏感, Ca2+释放被抑制, 此属负反馈[18]. 现在认为与钙离子诱导的钙离子释放(calcium induced calcium release, CICR)有关, 并有四步模型可以解释CICR: (1)胞外钙离子进入细胞内钙库; (2)充满钙离子的钙库被少量钙离子通过IP3R和RyR释放钙离子到胞质; (3)钙离子作为信使导致周围钙库释放钙离子并产生钙波; (4)钙离子释放通过负反馈效应而停止. 钙泵使胞质钙离子排出胞外或进入胞内钙库而恢复静止态, 并准备进入下一个反应循环.
在消化道平滑肌收缩过程中[Ca2+]i增加的两种动员途径存在器官和种属的特异性, 并与引起收缩的激动剂有关. 猫食管环形平滑肌细胞收缩时[Ca2+]i增加主要通过细胞外Ca2+内流, 而下食管括约肌及基底部细胞则通过肌质网IP3敏感地贮存Ca2+释放[19]. 狗结肠平滑肌细胞收缩时Ca2+动员通过细胞外Ca2+内流和肌质网IP3、RyR敏感地贮存Ca23释放[20]. 招明高 et al[5]研究认为, 在培养的胃底平滑肌细胞5-羟色胺可引起[Ca2+]i的迅速升高, 然后是一个持续的、升高的、稳定的平台期. [Ca2+]i的迅速升高依赖于胞外Ca2+的流入和胞内Ca2+的释放, 而平台期依赖于Ca2+的内流.
目前采用激光共聚焦技术观察药物对结肠平滑肌细胞钙离子影响的报道不多, 国内只有天津总医院Ma et al[21]有报道. 他们认为, 在急性分离的结肠平滑肌细胞大黄素引起[Ca2+]i短暂的升高后下降到一个持续的、稳定的、比静息状态稍高[Ca2+]i的平台期, 他认为[Ca2+]i的迅速升高依赖于肌质网IP3、RyR敏感地贮存Ca2+释放, 而平台期是胞外钙离子内流而引起的.
本研究采用Fluo-3/AM荧光指示剂对培养的结肠平滑肌细胞钙离子变化进行观察, 显示1×10-5 mol/L Ah刺激可使结肠平滑肌细胞内在短时间内钙离子浓度有个迅速、显著增加, 而后钙离子出现缓慢、更高幅度的升高, 随之下降到一个持续的、稳定的、比静息状态稍高的、较长时间的平台期. 同时平滑肌细胞产生收缩效应.
我们与Ma et al的研究结果相比, 有一定的差异. Ma et al观察的细胞钙离子变化图只出现了一个波峰, 而我们观察的细胞钙离子变化图出现了两个波峰. 这个图形是否符合CICR的四步模型[18], 即Ah引起胞内钙离子出现的第一个快速升高的波峰是由胞外钙离子的迅速内流后进入胞内钙库而引起的, 第二个缓慢升高的波峰是由钙库被少量钙离子通过IP3R和RyR释放钙离子到胞质和钙离子作为信使导致周围钙库释放钙离子而产生的, 可以通过从钙离子释放的各个途径选择相应的拮抗剂来进一步证实.
Ah和Ach组结肠平滑肌细胞内游离钙离子变化升高趋势一致, 但Ah组作用时间短, 效应更快, 说明Ah促结肠动力作用更加明显. 预先用M受体阻断剂阿托品处理后, Ah上述作用被抑制, 证明Ah是通过激动M受体而产生效应的.
本研究旨在为筛选中药的活性成分建立起在细胞水平层面上更可行、结果更可靠的实验方法. 通过激光共聚焦显微镜离子通道观察技术, 能够证实中药槟榔胃肠活性的部分机制, 为筛选中药的活性成分的研究搭建了高通量、高度可靠的细胞学实验平台.
结肠动力障碍性疾病(如慢性传输性便秘等)在我国发病率较高, 促结肠动力是治疗此类疾病的主要手段. 而目前临床常用的促结肠动力药物较少, 且大多具有不同的副作用, 如西沙比利, 由于心脏和其他方面的毒副作用, 使其应用受到限制. 因此, 研究和开发高效、低毒的促结肠动力新药具有重要意义. 临床和实验证实, 很多种类中药具有不同程度的促结肠动力作用, 其中槟榔被认为是具有开发前景的促胃肠动力中药. 槟榔碱是从槟榔中分离得到的一种生物碱, 近年来主要被用于防治钉螺, 在促胃肠动力作用方面研究不多.
以现代科学技术为依托, 胃肠动力中药研究方法学上呈现出从整体水平到细胞水平乃至分子水平不断深入、从单味药向药物单体成分上发展的趋势. 最常采用的两种实验方法是生理仪测定肌条张力变化、急性分离或体外培养的胃肠平滑肌细胞结合共聚焦技术测定胞内钙离子浓度.
体外培养细胞影响因素单一, 是激光共聚焦显微镜观察的最适宜的细胞, 但可能是因为结肠的生物学特性和采集环境的特殊性而造成细胞培养难度大. 本研究在国内首次报道了大鼠结肠平滑肌细胞培养, 并在此基础上结合共聚焦技术, 探讨了槟榔碱对结肠平滑肌细胞内钙离子的影响.
本文为筛选中药的活性成分建立起在细胞水平层面上更可行、结果更可靠的实验方法. 通过激光共聚焦显微镜离子通道观察技术, 能够证实中药促胃肠动力作用的部分机制, 为筛选中药的活性成分的研究搭建了高通量、高度可靠的细胞学实验平台.
选题科研方向明确, 科研设计详细, 技术路线可行, 内容新颖, 结论有说服力, 研究结果有一定学术价值.
电编: 张敏 编辑:潘伯荣
| 3. | 戴 芸, 刘 新光. 钙离子在胃肠平滑肌收缩机制中的作用. 国外医学·消化系疾病分册. 2002;22:17-20. |
| 6. | Syed M, Tokuno H, Tomita T. Effects of cisapride on isolated guinea pig colon. Jpn J Pharmacol. 1989;51:47-56. [PubMed] [DOI] |
| 7. | Benatar A, Feenstra A, Decraene T, Vandenplas Y. Effects of cisapride on corrected QT interval, heart rate, and rhythm in infants undergoing polysom-nography. Pediatrics. 2000;106:E85. [PubMed] [DOI] |
| 8. | Enger C, Cali C, Walker AM. Serious ventricular arrhythmias among users of cisapride and other QT-prolonging agents in the United States. Pharma-coepidemiol Drug Saf. 2002;11:477-486. [PubMed] [DOI] |
| 10. | Soncrant TT, Holloway HW, Greig NH, Rapoport SI. Regional brain metabolic responsivity to the muscarinic cholinergic agonist arecoline is similar in young and aged Fischer-344 rats. Brain Res. 1989;487:255-266. [PubMed] [DOI] |
| 11. | Vanderheyden P, Gies JP, Ebinger G, De Keyser J, Landry Y, Vauquelin G. Human M1-, M2- and M3-muscarinic cholinergic receptors: binding characte-ristics of agonists and antagonists. J Neurol Sci. 1990;97:67-80. [PubMed] [DOI] |
| 12. | Yang YR, Chang KC, Chen CL, Chiu TH. Arecoline excites rat locus coeruleus neurons by activating the M2-muscarinic receptor. Chin J Physiol. 2000;43:23-28. [PubMed] |
| 13. | Leonard A, Cuq P, Magous R, Bali JP. M3-subtype muscarinic receptor that controls intracellular calcium release and inositol phosphate accumulati-on in gastric parietal cells. Biochem Pharmacol. 1991;42:839-845. [PubMed] [DOI] |
| 14. | Qiao GF, Zhou H, Li BY, Li WH. Antagonistic effects of berbamine on [Ca2+]i mobilization by KCl, norepinephrine, and caffeine in newborn rat cardiomyocytes. Zhongguo Yaoli Xuebao. 1999;20:292-296. [PubMed] |
| 15. | 耿 东进, 苏 敏, 王 君, 蔡 琰. 活性细胞内钙检测方法研究进展. 国外医学生理、病理科学与临床分册. 1994;14:24-263. |
| 16. | 陈 哲宇, 齐 清会. 胃肠平滑肌运动的细胞信号转导机制. 国外医学·消化系疾病分册. 2003;23:138-141. |
| 17. | Somlyo AP, Somlyo AV. Signal transduction and regulation in smooth muscle. Nature. 1994;372:231-236. [PubMed] [DOI] |
| 18. | Cannell MB, Cheng H, Lederer WJ. The control of calcium release in heart muscle. Science. 1995;268:1045-1049. [PubMed] [DOI] |
| 19. | Mittal RK, Frank EB, Lange RC, McCallum RW. Effects of morphine and naloxone on esophageal motility and gastric emptying in man. Dig Dis Sci. 1986;31:936-942. [PubMed] [DOI] |
| 20. | Mollereau C, Simons MJ, Soularue P, Liners F, Vassart G, Meunier JC, Parmentier M. Structure, tissue distribution, and chromosomal localization of the prepronociceptin gene. Proc Natl Acad Sci USA. 1996;93:8666-8670. [PubMed] [DOI] |
| 21. | Ma T, Qi QH, Yang WX, Xu J, Dong ZL. Contractile effects and intracellular Ca2+ signalling induced by emodin in circular smooth muscle cells of rat colon. World J Gastroenterol. 2003;9:1804-1807. [PubMed] [DOI] |