修回日期: 2006-01-05
接受日期: 2006-02-11
在线出版日期: 2006-03-08
目的: 探讨RhoC蛋白表达和肝细胞癌(hepatocellular carcinoma, HCC)临床病理的关系及其和微血管生成之间的联系.
方法: 应用免疫组织化学法, 检测49例HCC、22例肝癌转移灶组织、9例正常肝组织内RhoC蛋白表达和微血管密度(microvessel density, MVD), 并将检测结果与患者的临床资料进行统计分析.
结果: RhoC蛋白在9例正常肝组织中有1例呈阳性表达, 占11.1%, 而在49例HCC中有36例阳性表达, 占73.5%, 22例肝癌转移灶中有18例呈阳性表达, 占81.8%, 正常肝组织组与另两组比较有显著性差异(P<0.01); RhoC蛋白表达强度与年龄、性别、肝癌大小、AFP表达量、HBsAg是否阳性及有无包膜无关(P>0.05), 而与肝癌分化程度、有无侵袭转移有显著关系(χ2 = 8.037, P = 0.005; χ2 = 7.335, P = 0.007). 肝癌、肝癌转移灶中MVD显著高于正常肝组织(H = 4.564, P<0.01; H = 4.442, P<0.01). RhoC阳性表达的肝癌MVD值为93.3±25.0/mm3, 阴性表达的肝癌MVD值为55.7±23.4/mm3, 前者明显高于后者(t = 4.715, P<0.01).
结论: RhoC在HCC组织中的表达上调与其血管生成和侵袭转移有关.
引文著录: 邱兴烽, 王效民, 殷平, 陈守惠, 纪毅馨. 肝癌组织RhoC蛋白表达与微血管密度的关系. 世界华人消化杂志 2006; 14(7): 671-675
Revised: January 5, 2006
Accepted: February 11, 2006
Published online: March 8, 2006
AIM: To explore the expression of RhoC protein and its relations with microvessel density (MVD) in hepatocellular carcinoma (HCC).
METHODS: Immunohistochemical staining was used to detect the expression of RhoC protein and MVD in the tissues from HCC (n = 49), metastatic focus of HCC and normal liver (n = 9). The relationship between the RhoC expression and pathological features as well as MVD was evaluated.
RESULTS: The positive rate of RhoC expression was 73.5% (36/49) in HCC, 81.8% (18/22) in the metastatic focus of HCC and 11.1% (1/9) in normal liver tissues, and there was significant difference between the former two and the latter (P < 0.01). The expression of RhoC protein in HCC was not correlated with the age, gender of patients, tumor size, α-fetoprotein expression, HBsAg and tumor encapsulation (P > 0.05), but significantly correlated with the Edmondson grading (χ2 = 8.037, P = 0.005) and tumor metastasis (χ2 = 7.335, P = 0.007). The value of MVD in HCC, metastatic focus of HCC was markedly higher than that in the normal tissues (H = 4.564, P < 0.01; H = 4.442, P < 0.01). Meanwhile, the value of MVD in HCC with positive and negative expression of RhoC was 93.3 ± 25.0/mm3 and 55.7 ± 23.4/mm3, respectively, and there was notable difference between them (P < 0.01).
CONCLUSION: RhoC expression may be a good marker in the identification of HCC patients with high risks in the angiogenesis, invasion and metastasis.
- Citation: Qiu XF, Wang XM, Yin P, Chen SH, Ji YX. Expression of RhoC protein and its relationship with microvessel density in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(7): 671-675
- URL: https://www.wjgnet.com/1009-3079/full/v14/i7/671.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i7.671
近年来研究表明, RhoC GTP酶的过量表达与肿瘤的侵袭转移密切相关[1-2]. 我们通过分析RhoC在肝细胞癌组织内的表达及与肝癌微血管密度和临床病理学征象之间的关系, 探讨RhoC在肝癌侵袭转移和血管生成中的作用.
厦门大学附属中山医院2002-01/2004-12肝癌手术切除标本49例, 肝癌转移灶标本22例(含门静脉、胆管癌栓、肝内转移灶、腹壁、腹腔、脑、牙龈等远处转移灶), 另外选取9例肝外伤患者肝脏标本作为对照组. 肝癌患者中男39例, 女10例, 年龄25-75(平均47)岁, 均经手术后病理切片证实为HCC, HCC病理分级采用Edmondson 4级法: Ⅰ-Ⅱ级29例, Ⅲ-Ⅳ级20例; 肿瘤直径≤5 cm的25例, >5 cm的24例; AFP≤7.02 µg/L 9例, >7.02 µg/L 40例; HBsAg(+)33例, HBsAg(-)16例; 具有包膜的28例, 无包膜21例; 有脉管癌栓或远处转移灶的27例, 镜下无脉管侵袭或转移的22例. 所有组织均经40 g/L甲醛固定, 常规石蜡包埋, 厚4 µm连续切片, 分别作苏木精-伊红(HE)和免疫组织化学染色.
所有标本均行RhoC和CD34免疫组织化学染色, 分别采用链霉素抗生物素蛋白-过氧化物酶(S-P)方法和Envision法检测RhoC和CD34的表达. 羊抗人RhoC多克隆抗体(美国Santa Cruz公司产品)工作浓度1∶100; 鼠抗人CD34单克隆抗体及Envision plus试剂盒(美国Neomarkers公司产品)购自福州迈新生物公司. 操作步骤按试剂盒说明书进行. 用PBS替代一抗作阴性对照. RhoC免疫组化染色位于细胞质和胞膜, 染色强度为黄色、棕黄色或棕褐色. 根据瘤组织或非瘤肝组织中染色程度分为4个等级: 缺乏细胞质染色或弱染的评分为0-+, 判定为阴性细胞; 弥漫的, 中到强细胞质染色评分为++-+++("0"未染色;"+"呈黄色;"++"呈棕黄色;"+++"呈棕褐色), 判定为阳性细胞[3]. 阳性细胞数≥30%者为阳性, <30%为阴性. 微血管密度测定参照Weidner方法, 即先在低倍镜(×40)下扫视整个切片, 选取血管密度最高的5个区域, 再在高倍镜(×200, 0.74 mm3/视野)下计数被染成棕黄色的血管数目, 共记录5个视野中的MVD值, 取其平均数作为该切片的MVD值. 由于观察中发现一种特殊类型的血管, 其管腔很大, 单位面积内的血管数目相对较少, 因此采用Tanigawa et al[4]报道的改良法计数, 即每40 µm长度的此类血管计数为1个MVD值. 以上均请两位专职病理科医师以双盲法分别进行评估, 两者意见不统一时, 由两位医师讨论后作出结论.
统计学处理 利用SPSS 11.5统计分析软件包处理. 统计分析方法为χ2检验和t检验(方差不齐时采用两独立样本非参数检验Mann-Whitney U检验).
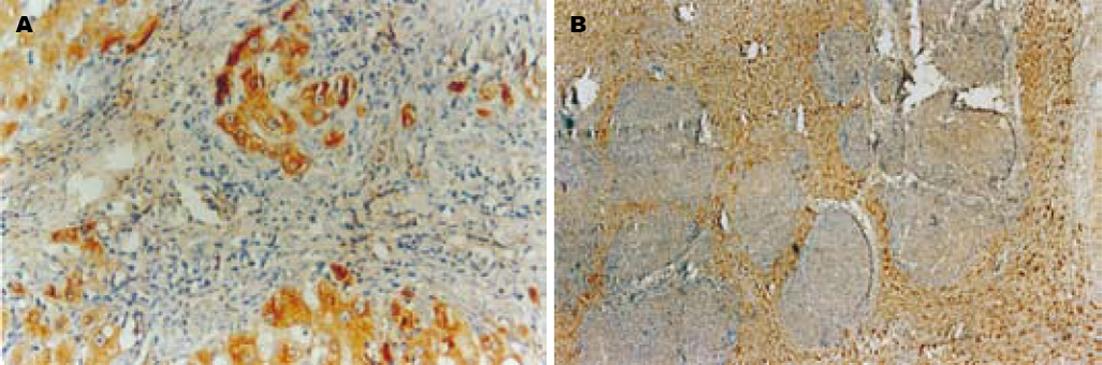
肝癌及肝癌转移灶组织阳性表达率明显高于正常肝组织(36/49, 18/22 vs 1/9, χ2 = 16.174, P<0.01), 而肝癌和肝癌转移灶组织阳性表达率无差别(χ2 = 0.581, P>0.05). RhoC主要表达于癌细胞胞质和胞膜中, 呈棕黄至棕褐色(图1A). 染色强弱与细胞分化程度相关, 腺样多角形癌细胞分化程度相对较高, 呈巢样结构, 相对局限化, 侵袭能力较低, RhoC染色较弱; 梭形样癌细胞异型性明显, 分化程度较低, RhoC染色强, 呈条索状分布, 并与肿瘤的侵袭性生长相一致(图1B).
RhoC表达阳性率与肝癌患者的病理分级和有无侵袭转移相关(P<0.01, 表1), 而且表达水平与肝癌患者的病理分级和有无侵袭转移也密切相关(P<0.05, 表2), 但与患者性别、年龄、肿瘤大小、胞膜有无、AFP水平及是否合并乙肝无关(P>0.05, 表1).
| 临床病理特征 | n | RhoC+ | χ2值 | P值 |
| 年龄 | 0.000 | 1.000 | ||
| >40岁 | 31 | 23 | ||
| ≤40岁 | 18 | 13 | ||
| 性别 | 0.015 | 0.902 | ||
| 男 | 39 | 28 | ||
| 女 | 10 | 8 | ||
| 肿瘤大小 | 0.168 | 0.682 | ||
| >5 cm | 24 | 17 | ||
| ≤5 cm | 25 | 19 | ||
| 包膜 | 0.790 | 0.779 | ||
| 无 | 21 | 15 | ||
| 有 | 28 | 21 | ||
| AFP | 0.009 | 0.925 | ||
| + | 40 | 30 | ||
| - | 9 | 6 | ||
| HBsAg | 0.031 | 0.860 | ||
| + | 33 | 25 | ||
| - | 16 | 11 | ||
| 病理分级 | 8.037 | 0.005 | ||
| Ⅰ-Ⅱ | 29 | 17 | ||
| Ⅲ-IV | 20 | 19 | ||
| 转移 | 7.335 | 0.007 | ||
| 无 | 22 | 12 | ||
| 有 | 27 | 24 |
| 病理特征 | n | +~+++ | +++ |
| 病理分级 | |||
| Ⅰ-Ⅱ | 29 | 17 | 7 |
| Ⅲ-IV | 20 | 19b | 14a |
| 转移 | |||
| 无 | 22 | 12 | 4 |
| 有 | 27 | 24b | 17a |
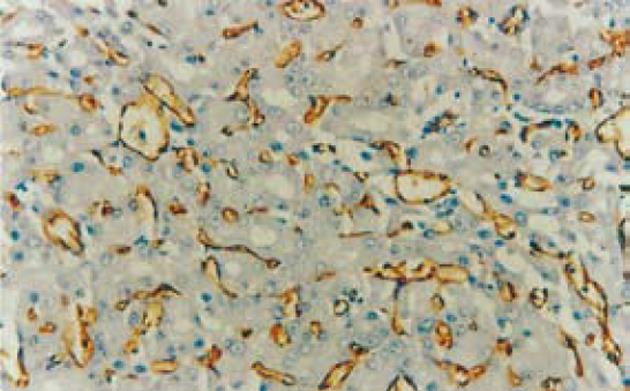
CD34标记血管内皮, 阳性染色局限于血管内皮细胞的胞质和胞膜, 呈棕褐色, 形成条状(纵切面)或环状(横切面), 在肝癌组织中多为弥漫性分布(图2), MVD值为61.7±11.9, 而在正常肝组织中MVD值为11.3±6.9, 两者有显著差异(H = 4.564, P<0.01); 在侵袭转移肝癌组中MVD值74.4±12.2; 无转移肝癌组MVD46.0±11.1, 前者高于后者, 具显著意义(H = 4.442, P<0.01). MVD值与患者年龄、性别、AFP水平、肿瘤大小及病理分级间无统计学意义(P>0.05). RhoC阳性表达的肝癌MVD值为93.3±25.0/mm3, 阴性表达的肝癌MVD值为55.7±23.4/mm3, 前者明显高于后者(t = 4.715, P<0.01).
Rho GTP酶是Ras超家族小分子G蛋白的成员, 包括Rho(RhoA, RhoB, RhoC), Rac, cdc42, Rnd, RhoD, TTF等6个亚家族共22种成员蛋白[5], 其中的RhoC基因定位于1p13-p21, RhoC蛋白含193个氨基酸. 肿瘤细胞的运动能力是肿瘤侵袭的先决条件, 是肿瘤转移扩散的关键. 肿瘤细胞的移动包括细胞前进端质膜的突起; 前进端与胞外基质新的黏附位点的形成; 尾端与旧黏附点的脱离; 最后以细胞内肌动球蛋白为基础的细胞骨架收缩促使细胞整体向前移动. 研究表明, Rho刺激、调节纤维母细胞及其他一些黏附细胞的肌动蛋白张力纤维和局灶性黏附, 介导肌动蛋白结构重组, 通过调节肌球蛋白轻链磷酸化, 使肌球蛋白和肌动蛋白丝相互作用, 形成收缩性的肌动-球蛋白束, 最终导致癌细胞极性消失及促进细胞运动. RhoC则能通过调节细胞骨架蛋白来加快细胞迁移的这些步骤[1,6], 例如在黑色素瘤细胞的转移和扩散中RhoC蛋白是必需的[1]; Ikoma et al[7]在对鼠的肺癌模型进行基因转导研究时发现, 过度表达RhoC组能显著增加纵隔淋巴结转移, 相反, 过表达显性失活Rho组纵隔淋巴结转移的大小明显减少, 质量也明显减轻. 同样在体外迁移和侵袭实验中, RhoC的过表达提高了迁移和侵袭能力(后者比前者明显), 而过表达显性失活Rho能同时抑制迁移和侵袭. 这些结果表明RhoC可能通过调节细胞移动来促进肺癌的转移. 另外Ikoma et al[7]还发现过度表达RhoC能导致MMP-2, MMP-9, MT1-MMP和TIMP-2等mRNA表达的显著升高, 反之过表达显性失活Rho能降低上述MMP的mRNA表达水平. 运用酶谱分析法也证实了过度表达RhoC不但明显上调MMP-2和MMP-9的前体(失活状态), 还明显上调活性状态的MMP-2, 从而首次揭示了RhoC和MMPs在癌中的关系, 并提出了RhoC作用新机制: RhoC不但能明显上调MMPs的表达水平, 同时也能增加MMPs的活性, 使降解胞外基质能力增强, 从而导致肿瘤侵袭活性的增强.
和Ras超家族的所有成员一样, RhoC在非活性GDP结合形式和活性GTP结合形式之间循环, 与GDP结合游离于胞质中, 与GTP结合作用于细胞内的效应分子. 但和Ras不同的是RhoC极少突变[8], 更多的是表达水平上的异常. 如通过使用基因芯片技术对比高转移性和低转移性黑色素瘤细胞, 发现前者RhoC明显升高[1]; Kleer et al[9]也发现RhoC的表达水平与乳腺癌侵袭转移特性密切相关. 研究显示在恶性肿瘤的转变中, Rho蛋白与GTP或GDP结合形式的转换起着重要作用, 而RhoC的过量表达则可能加快GTP与GDP的循环转换过程. 近年来, RhoC的表达与肿瘤侵袭转移的关系成为研究热点, 已有大量资料发现肿瘤组织中异常表达RhoC与其侵袭转移相关[1-2,7,9-24]. 我们通过免疫组织化学法检测了RhoC蛋白在正常肝、肝癌及其转移灶中的表达. 结果表明, RhoC蛋白表达水平在伴有侵袭转移的肝癌中明显高于无侵袭转移的肝癌, 而无论在伴有转移还是在不伴有转移的肝癌以及肝癌转移灶中, RhoC的表达水平都明显高于正常肝组织, 且肝癌恶性程度越高, RhoC表达越强. 此外, 我们还观察到, 强RhoC染色的肝癌细胞分布呈条索状, 与肿瘤细胞的侵袭性生长相一致. 因此我们推测, RhoC基因与肝癌的侵袭转移密切相关, 可能是通过调控癌细胞的运动促进肿瘤的侵袭转移.
肝癌的侵袭转移大多是通过血管途径转移. 本研究显示, RhoC的表达强度与新生血管数量有关, 表明两者之间存在密切的关系. 在研究乳癌中发现, RhoC GTP酶的过量表达能特异而直接的通过炎性乳癌细胞来控制血管生成因子的合成[25-26], 因此我们推测, RhoC也能促进肝癌血管生成, 增加肝癌细胞进入血管的可能性, 促进肝癌的扩散转移. 然而, 其中具体机制尚不完全清楚, 需要进一步研究. 本研究结果提示, RhoC基因的表达与HCC分化程度、侵袭转移能力密切相关. RhoC有可能成为判断HCC侵袭转移能力及肝癌患者预后的一个新指标.
RhoC基因作为肿瘤转移相关基因近年来得到广泛关注, 当前众多研究表明RhoC的过量表达与肺癌、乳腺癌、胃癌、胰腺癌、膀胱癌、卵巢癌、黑色素瘤等恶性肿瘤的侵袭转移密切相关. 一些研究利用分子生物学方法表明RhoC与肝癌的关系, 而本研究则利用免疫组化方法证实了RhoC在HCC组织中的表达上调与HCC分化程度、侵袭转移能力密切相关, 推测RhoC基因可能是通过调控肝癌细胞运动和促进肝癌血管生成来促进肝癌的侵袭转移. 相信RhoC有可能成为判断HCC侵袭转移能力及肝癌患者预后的一个新指标.
一些研究利用分子生物学方法表明RhoC与肝癌的关系, 而本研究则利用免疫组化方法证实了RhoC在HCC组织中的表达上调与HCC分化程度、侵袭转移能力密切相关, 推测RhoC基因可能是通过调控肝癌细胞运动和促进肝癌血管生成来促进肝癌的侵袭转移.
RhoC有可能成为判断HCC侵袭转移能力及肝癌患者预后的一个新指标.
本文层次结构清楚, 推论合理. 具有一定的科学性和临床实用价值.
电编: 张敏 编辑:潘伯荣
| 1. | Clark EA, Golub TR, Lander ES, Hynes RO. Geno-mic analysis of metastasis reveals an essential role for RhoC. Nature. 2000;406:532-535. [PubMed] [DOI] |
| 2. | 邱 兴烽, 王 效民, 殷 平. RhoC与恶性肿瘤的侵袭转移. 国外医学·生理病理科学与临床分册. 2005;25:136-139. |
| 3. | Kleer CG, van Golen KL, Zhang Y, Wu ZF, Rubin MA, Merajver SD. Characterization of RhoC expression in benign and malignant breast disease: a potential new marker for small breast carcinomas with metastatic ability. Am J Pathol. 2002;160:579-584. [PubMed] [DOI] |
| 4. | Tanigawa N, Lu C, Mitsui T, Miura S. Quantitation of sinusoid-like vessels in hepatocellular carcinoma: its clinical and prognostic significance. Hepatology. 1997;26:1216-1223. [PubMed] |
| 5. | Aspenstrom P, Fransson A, Saras J. Rho GTPases have diverse effects on the organization of the actin filament system. Biochem J. 2004;377:327-337. [PubMed] [DOI] |
| 6. | Ridley AJ. Rho GTPases and cell migration. J Cell Sci. 2001;114:2713-2722. [PubMed] |
| 7. | Ikoma T, Takahashi T, Nagano S, Li YM, Ohno Y, Ando K, Fujiwara T, Fujiwara H, Kosai K. A defini-tive role of RhoC in metastasis of orthotopic lung cancer in mice. Clin Cancer Res. 2004;10:1192-1200. [PubMed] [DOI] |
| 8. | Oxford G, Theodorescu D. Ras superfamily mono-meric G proteins in carcinoma cell motility. Cancer Lett. 2003;189:117-128. [PubMed] [DOI] |
| 9. | Kleer CG, Griffith KA, Sabel MS, Gallagher G, van Golen KL, Wu ZF, Merajver SD. RhoC-GTPase is a novel tissue biomarker associated with biologically aggressive carcinomas of the breast. Breast Cancer Res Treat. 2005;93:101-110. [PubMed] [DOI] |
| 10. | Shikada Y, Yoshino I, Okamoto T, Fukuyama S, Kameyama T, Maehara Y. Higher expression of RhoC is related to invasiveness in non-small cell lung carcinoma. Clin Cancer Res. 2003;9:5282-5286. [PubMed] |
| 11. | Kondo T, Sentani K, Oue N, Yoshida K, Nakayama H, Yasui W. Expression of RHOC is associated with metastasis of gastric carcinomas. Pathobiology. 2004;71:19-25. [PubMed] [DOI] |
| 12. | Wang W, Yang LY, Yang ZL, Huang GW, Lu WQ. Expression and significance of RhoC gene in hepa-tocellular carcinoma. World J Gastroenterol. 2003;9:1950-1953. [PubMed] [DOI] |
| 13. | Wang W, Yang LY, Huang GW, Lu WQ, Yang ZL, Yang JQ, Liu HL. Genomic analysis reveals RhoC as a potential marker in hepatocellular carcinoma with poor prognosis. Br J Cancer. 2004;90:2349-2355. [PubMed] [DOI] |
| 14. | Takamura M, Sakamoto M, Genda T, Ichida T, Asakura H, Hirohashi S. Inhibition of intrahepatic metastasis of human hepatocellular carcinoma by Rho-associated protein kinase inhibitor Y-27632. Hepatology. 2001;33:577-581. [PubMed] [DOI] |
| 15. | Okabe H, Satoh S, Kato T, Kitahara O, Yanagawa R, Yamaoka Y, Tsunoda T, Furukawa Y, Nakamura Y. Genome-wide analysis of gene expression in human hepatocellular carcinomas using cDNA microarray: identification of genes involved in viral carcinogenesis and tumor progression. Cancer Res. 2001;61:2129-2137. [PubMed] |
| 16. | Kamai T, Tsujii T, Arai K, Takagi K, Asami H, Ito Y, Oshima H. Significant association of Rho/ROCK pathway with invasion and metastasis of bladder cancer. Clin Cancer Res. 2003;9:2632-2641. [PubMed] |
| 17. | Horiuchi A, Imai T, Wang C, Ohira S, Feng Y, Nikaido T, Konishi I. Up-regulation of small GTPases, RhoA and RhoC, is associated with tumor progression in ovarian carcinoma. Lab Invest. 2003;83:861-870. [PubMed] [DOI] |
| 18. | Hakem A, Sanchez-Sweatman O, You-Ten A, Duncan G, Wakeham A, Khokha R, Mak TW. RhoC is dispensable for embryogenesis and tumor initiation but essential for metastasis. Genes Dev. 2005;19:1974-1979. [PubMed] [DOI] |
| 19. | Crnogorac-Jurcevic T, Efthimiou E, Nielsen T, Loader J, Terris B, Stamp G, Baron A, Scarpa A, Lemoine NR. Expression profiling of microdissected pancreatic adenocarcinomas. Oncogene. 2002;21:4587-4594. [PubMed] [DOI] |
| 20. | Collisson EA, Kleer C, Wu M, De A, Gambhir SS, Merajver SD, Kolodney MS. Atorvastatin prevents RhoC isoprenylation, invasion, and metastasis in human melanoma cells. Mol Cancer Ther. 2003;2:941-948. [PubMed] |
| 21. | Carr KM, Bittner M, Trent JM. Gene-expression profiling in human cutaneous melanoma. Oncogene. 2003;22:3076-3080. [DOI] |
| 22. | Fritz G, Brachetti C, Bahlmann F, Schmidt M, Kaina B. Rho GTPases in human breast tumours: expression and mutation analyses and correlation with clinical parameters. Br J Cancer. 2002;87:635-644. [PubMed] [DOI] |
| 23. | van Golen KL, Wu ZF, Qiao XT, Bao LW, Merajver SD. RhoC GTPase, a novel transforming oncogene for human mammary epithelial cells that partially recapitulates the inflammatory breast cancer pheno-type. Cancer Res. 2000;60:5832-5838. [PubMed] |
| 24. | Suwa H, Ohshio G, Imamura T, Watanabe G, Arii S, Imamura M, Narumiya S, Hiai H, Fukumoto M. Overexpression of the rhoC gene correlates with progression of ductal adenocarcinoma of the pancreas. Br J Cancer. 1998;77:147-152. [PubMed] [DOI] |
| 25. | Van den Eynden GG, Van der Auwera I, Van Laere S, Colpaert CG, van Dam P, Merajver S, Kleer CG, Harris AL, Van Marck EA, Dirix LY. Validation of a tissue microarray to study differ-ential protein expression in inflammatory and non-inflammatory breast cancer. Breast Cancer Res Treat. 2004;85:13-22. [PubMed] [DOI] |