修回日期: 2005-09-29
接受日期: 2005-09-30
在线出版日期: 2006-02-28
目的: 研究叶酸干预萎缩性胃炎后的黏膜改变、P16蛋白表达变化及p16基因甲基化状态.
方法: 根据胃镜及病理结果确诊为萎缩性胃炎的患者56例, 随机分为叶酸治疗组(n = 28)和非叶酸治疗组(n = 28), 治疗前后观察临床症状、血浆叶酸水平、黏膜病理、P16蛋白表达变化, 并采用甲基化敏感的内切酶酶切后PCR法检测p16基因甲基化状态.
结果: 叶酸治疗组临床症状缓解快而持久, 患者血浆叶酸水平升高(47.98±2.68 µg/L vs 14.37±3.56 µg/L, P<0.01), 病理改变逆转(有效率: 80.8% vs 39.3%, P<0.01), P16蛋白表达增强, 有效率达61.6%(P<0.01), 而p16基因甲基化状态两组在治疗前后均正常.
结论: 萎缩性胃炎的发生与叶酸缺乏有关, 叶酸治疗可以提高血浆叶酸水平, 有效改善临床症状, 一定程度上逆转胃黏膜的萎缩、肠化和不典型增生, 能提高P16蛋白表达. 萎缩性胃炎中不存在甲基化异常.
引文著录: 刘丽华, 吴汉平, 张方信, 刘斌, 董亮, 钱震. 叶酸治疗萎缩性胃炎并改变P16蛋白表达. 世界华人消化杂志 2006; 14(6): 630-633
Revised: September 29, 2005
Accepted: September 30, 2005
Published online: February 28, 2006
AIM: To study the mucosal changes, P16 protein expression and p16 gene methylation status in atrophic gastritis after treatment of folic acid (FA).
METHODS: Fifty-six patients, who were diagnosed with gastroendoscopy and pathological examination, were randomly assigned into FA and non-FA treatment group (control). Before and after treatment, the clinical symptoms of the patients, the levels of plasma FA, and the expression of P16 protein were observed. Meanwhile, the methylation status of p16 gene was detected by methylation specific polymerase chain reaction (MSP).
RESULTS: After treatment with FA, The clinical symptoms of patients alleviated rapidly and lasted a longer period in FA group. Meanwhile, the level of plasma FA was significantly increased (47.98 ± 2.68 µg/L vs 14.37 ± 3.56 µg/L, P < 0.01). The pathological changes were notably improved and the efficacy rate was 80.8% in FA group, which was markedly higher than that in the controls (39.3%, P < 0.01). The expression of P16 protein was increased with a rate of 61.6% (P < 0.01) in comparison with that of control group. The methlytion status of p16 gene was normal in both groups before and after treatment.
CONCLUSION: Lack of FA plays an important role in the pathogenesis of atrophic gastritis. FA treatment can elevate the plasma FA level, improve the clinical symptoms, and reverse the pathological changes to some extent. No aberrant methylation exists in atrophic gastritis.
- Citation: Liu LH, Wu HP, Zhang FX, Liu B, Dong L, Qian Z. Effect of folic acid on atrophic gastritis and expression of P16 protein. Shijie Huaren Xiaohua Zazhi 2006; 14(6): 630-633
- URL: https://www.wjgnet.com/1009-3079/full/v14/i6/630.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i6.630
萎缩性胃炎是胃黏膜癌前病变之一, 如何使其逆转已成为目前研究热点. 目前, 国内外研究发现, DNA甲基化异常与衰老和癌症的发生关系密切[1]. 流行病学研究已证实, 低叶酸饮食人群患食管癌、贲门癌、胃癌的相对危险性明显增高[2]. 动物实验证明, 叶酸摄入充足可有效预防胃癌的发生[3]. 萎缩性胃炎通常被看作胃黏膜的老化现象, 在此过程中可能存在叶酸缺乏导致的DNA甲基丢失、DNA修复能力降低. 因此, 本研究旨在观察叶酸干预萎缩性胃炎后的黏膜改变及P16蛋白表达及p16基因甲基化状态.
2003-02/2005-02, 我院门诊就诊患者中有食欲减退、恶心、呕吐、腹胀、腹泻、舌质红、舌面光滑等消化道症状的患者, 进一步胃镜检查, 根据2000-05全国井冈山会议制定的慢性萎缩性胃炎诊断标准而确定为慢性萎缩性胃炎, 伴有肠化或(和)中、重度不典型增生的患者56例, 年龄50-72岁, 平均54岁, 男35例, 女21例. 随机分为叶酸治疗组和对照组. 叶酸组28例, 其中病理结果根据异型程度分级[4]轻度9例, 中度15例, 重度4例. 对照组28例, 其中病理分级轻度11例, 中度14例, 重度3例. 两组年龄、性别、病情、病程无明显差异. 以上病例标本在离体后一部分固定后石蜡包埋, 另一部分常规酚-氯仿提取DNA, -20 ℃保存.
1.2.1 干预方法: 两组患者均在必要时间断给予抑酸、或促动力、或助消化药物的对症治疗. 叶酸组自实验开始给予叶酸10 mg, 3次/d, 疗程为6 mo, 治疗过程中不坚持服药者, 退出实验. 对照组仅仅常规的间断给予抑酸、或促动力、或助消化药物必要的对症治疗. 两组均不给予胃黏膜保护剂治疗. 治疗过程中每月随访1次.
1.2.2 血浆叶酸测定: 治疗前后空腹采外周静脉血8 mL, 分离血浆以美国DPC公司叶酸单标记试剂盒行放射免疫测定.
1.2.3 胃镜和病理组织学检查: 每个患者治疗前后由同一消化内镜医师检查及同一病理医师阅片. 疗效观察指标: 减二级或以上为"显效"; 减一级为"有效"; 无变化甚至加重为"无效".
1.2.4 两组治疗前后均进行免疫组化检测P16蛋白表达: 采用ABC法, P16单克隆抗体生物素化的兔抗鼠IgG和ABC复合物均来自迈新公司. 结果判断: P16染色阳性者可见胞质或细胞膜呈棕黄色, 根据切片中阳性细胞占全部细胞数的百分数, P16的染色结果判断以(+)表示, 表达强度分4级: (±)阳性细胞数<10; (+)阳性细胞数10-30; (++)阳性细胞数31-50; (+++)阳性细胞数>50. (±)(+)为弱表达, (++)(+++)为强表达.
1.2.5 两组治疗前后均采用酶切后PCR法检测DNA甲基化状态: 治疗前后取大致相同部位黏膜提取DNA, 用甲基化敏感的MspⅠ、HapⅡ内切酶(中山公司)孵育后进行PCR扩增, 对p16基因外显子2区域的甲基化状态进行测定, 此区域有1个MspⅠ酶切位点, 3个HapⅡ酶切位点, 如这些位点未被甲基化或甲基化发生异常, 就能被MspⅠ、HapⅡ内切酶切开, 所提取的DNA就不能扩增. p16引物(上海生工生物工程公司)P1: 5'-CTGCTTGGCGGTGAGGGGG-3', P2: 5'-GGAAGGTCCCTCAGGTGAGG-3', 反应体系为: 总体积为25 µL, dNTP 0.2 mmol, 上下游引物各1 µmol/L, MgCL2 1.5 mmol, Taq酶1.25 U, 1×反应缓冲液. 扩增条件为: 94 ℃, 2 min→94 ℃, 1 min→57 ℃, 1 min; 72 ℃, 1.5 min; 40个循环→72 ℃, 5 min. 扩增片段长度为402 bp, 取扩增产物10 µL行2 g/L琼脂糖凝胶电泳, 紫外灯下观察. GAPDH作为外参照, 引物为P1: 5'-CCACCCATGGCAAATTCCATGGCA-3', P2: 5'-TCTAGACGGCAGGTCAGGTCCAC-3', 扩增片段长度为598 bp.
统计学处理 采用t检验及χ2检验.
叶酸治疗组有2例患者因其他疾病中途退出治疗, 对照组无患者退出. 叶酸治疗组患者食欲减退、恶心、呕吐、腹胀、腹泻、舌质红、舌面光滑等症状体征明显改善, 发作频次明显少于对照组.
叶酸治疗组患者血浆叶酸含量明显上升, 与对照组比较差异显著(采用t检验,P<0.01).
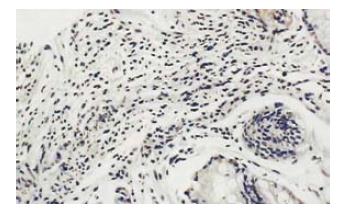
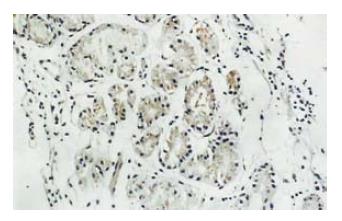
叶酸治疗组胃黏膜萎缩、肠化及不典型增生有明显的改善(图1, 2), 总有效率80.8%, 对照组总有效率39.3%, 两组差异显著(采用χ2检验, P<0.01).
叶酸治疗组治疗前P16蛋白表达为强阳性者8例, 弱阳性者16例, 2例重度萎缩性胃炎的患者P16蛋白表达为阴性. 治疗后P16蛋白表达强阳性者15例, 弱阳性者11例, P16蛋白表达均为阳性. 16例P16蛋白表达为非强阳性患者的P16蛋白表达均有变化, 变化率或者说有效率达61.6%(图1, 图2). 而对照组治疗前P16蛋白表达为强阳性者7例, 弱阳性者19例, 1例重度萎缩性胃炎的患者P16蛋白表达为阴性. 对照组治疗后P16蛋白表达强阳性者8例, 弱阳性者18例, 1例重度萎缩性胃炎的患者P16蛋白表达仍为阴性. 患者的P16蛋白表达无明显变化.
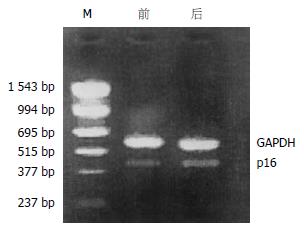
叶酸治疗组和对照组在治疗前后取大致相同部位黏膜提取DNA, 用甲基化敏感的MspⅠ、HapⅡ内切酶孵育后进行PCR扩增, 所有标本均能扩增, 在2 g/L琼脂糖凝胶上观察到电泳带, 说明p16基因外显子2区域的甲基化状态正常(图3).
本次研究结果显示, 胃黏膜癌前病变萎缩性胃炎患者的血浆中叶酸水平下降, 口服叶酸治疗, 可使患者的临床症状好转, 提高患者血浆叶酸水平, 使胃黏膜病理改善, 能增强P16蛋白表达, 但是p16基因启动子区域均未发生高甲基化. 以上结果使我们得出如下结论: 叶酸缺乏是萎缩性胃炎形成原因之一; 叶酸缺乏可能导致萎缩性胃炎胃黏膜细胞中P16蛋白表达下降; 补充叶酸治疗可使萎缩性胃炎胃黏膜细胞中P16蛋白表达增强, 黏膜损伤得以修复, 病理改善; 在萎缩性胃炎形成和逆转过程中p16基因的甲基化状态并未发生变化.
在萎缩性胃炎的发生、发展中叶酸缺乏起了怎样的作用呢? 叶酸为B族维生素, 主要存在于蔬菜和水果, 人体自身不能合成叶酸, 必须从膳食获取. 研究表明, 在人体细胞中, 为消除因体内、外各种因素导致的DNA损伤, 修复机制必不可少, 叶酸缺乏导致DNA甲基化的紊乱和DNA修复机制效率的减弱. 朱舜时 et al[5-6]就叶酸对胃癌和其他胃肠道癌发生的干预作用进行了7 a随访, 证实叶酸对胃肠道癌的发生有干预作用, 叶酸可治疗萎缩性胃炎, 改善胃黏膜病理. 他认为补充叶酸可以影响胃黏膜基因调控, 减轻损伤, 抑制增殖, 使萎缩、肠化及异型增生明显改善, 从而阻断胃癌前病变的进展. 本研究结果与上述研究结果相同. 因此, 叶酸缺乏可能是胃黏膜老化、损伤不能及时得以修复, 进而萎缩、肠化及异型增生发生并不断加重的可能原因之一. 那么, 叶酸到底是如何促使黏膜修复的呢?
叶酸是甲基的重要提供者[5-6], DNA甲基化是最常见的复制后及转录后修饰方式之一, 在基因表达、调控、发育调节、基因组印迹等方面发挥重要作用[7]. 因此, 要想知道叶酸如何促使黏膜修复, 就必须知道在萎缩性胃炎中黏膜细胞DNA甲基化异常发生在复制后, 还是转录后? 当甲基缺乏时, DNA复制后不能得到准确的修饰, 在DNA进一步的复制过程中, 抑癌基因等这样的调控基因不断的丢失. Jang et al[8]研究证明p16启动子区域出现甲基化异常, 是胃癌发生早期的频繁事件. 关志宇 et al[9]报道胃癌患者p16启动子区域出现甲基化异常而不表达P16蛋白者占22%, 但在胃炎中该基因启动子未发生甲基化异常, 而43%的胃癌和59%的癌组织附近的癌前病变组织中出现p16启动子甲基化异常现象, 说明该基因启动子甲基化异常发生在胃癌形成的早期, 而且频率很高, 可成为胃癌危险性的预测性生物标记. 本研究结果显示萎缩性胃炎中p16基因启动子未发生甲基化异常. 既然p16复制后未发生甲基化异常, 那么, 推测P16蛋白表达异常可能是p16基因转录后的甲基化修饰过程中发生了异常.
甲基化不仅是复制后修饰方式之一, 也是转录后修饰方式之一. Jang et al[8]认为在mRNA的加工过程中, 常有甲基化修饰, 这种修饰主要形成6-甲基腺嘌呤(6 mA). 修饰过的碱基存在于5' Apm6ApC 3'和5' Gpm6ApC 3'这两种序列中. 哺乳动物mRNA中每100-400个腺嘌呤中就有一个是甲基化的, 这种甲基化修饰可能发生在mRNA剪接之前, 目前还不清楚其发生的确切时间和意义. 推测叶酸缺乏时首先造成基因转录后甲基化修饰减少, 使mRNA链转录合成后在拼接、末端修饰和内部修饰等过程中出现错误, 不能生成成熟的mRNA、rRNA、tRNA, 进一步将mRNA翻译为蛋白质的一级结构中由于携带信息的不足, 造成部分基因蛋白表达的下降或丢失. 在萎缩性胃炎中可能发生了p16基因转录后的不当修饰或未被修饰, 导致其不能表达或表达降低.
另外, 推测叶酸缺乏可能导致了萎缩性胃炎黏膜细胞中p16转录后基因沉默. 近年来人们提出基因沉默现象[10]. 尽管转录后水平的基因沉默是指转基因在细胞核里能稳定转录, 细胞质里却无相应的稳定态mRNA存在的现象, 且由于转录出的mRNA降解, 不能正常地翻译成蛋白质造成的. 关于转录后基因沉默的发生机制, 人们提出了一系列的假说, 如转基因的甲基化、重复拷贝以及与内源基因的同源序列等都可以引起转基因的沉默. 尽管其确切机制还不清楚, 但科学家们认为基因沉默是自然界中一个非常复杂和普遍的现象. 因而推测, 萎缩性胃炎这一胃黏膜的老化过程中首先发生的是基因转录后沉默, 当这种情况得不到及时恰当的更正后, 细胞过度凋亡, 老化加速, 或进一步出现DNA复制过程中的紊乱, 导致癌变. 这种推理尚需在以后的研究中得到证实.
DNA甲基化异常是胃癌发生的重要机制之一, 为了能尽早发现并纠正, 胃黏膜癌前病变中DNA甲基化状态的研究日益受到重视. 研究表明, 胃黏膜癌前病变中多种基因存在甲基化异常, 而且其程度与年龄、性别、活动性炎症、肠化及幽门螺杆菌感染有关; 叶酸缺乏可导致DNA甲基化的紊乱和DNA修复机制效率的减弱, 为了明确叶酸缺乏的胃黏膜癌前病变中是否存在DNA甲基化异常, 经叶酸治疗能否纠正这种异常, 我们不仅观察了叶酸干预萎缩性胃炎黏膜病理改变、P16蛋白表达变化, 也观察了p16基因甲基化状态的变化.
叶酸治疗可以一定程度上逆转胃黏膜的萎缩、肠上皮化生和不典型增生, 提高P16蛋白表达.
电编: 张敏 编辑:张海宁
| 1. | 刘 光谱, 曾 昭贤. DNA甲基化、衰老和癌. 国外医学 老年医学分册. 1994;15:101-103. |
| 2. | Mayne ST, Risch HA, Dubrow R, Chow WH, Gammon MD, Vaughan TL, Farrow DC, Schoen-berg JB, Stanford JL, Ahsan H. Nutrient intake and risk of subtypes of esophageal and gastric cancer. Cancer Epidemiol Biomarkers Prev. 2001;10:1055-1062. [PubMed] |
| 3. | Xiao SD, Meng XJ, Shi Y, Hu YB, Zhu SS, Wang CW. Interventional study of high dose folic acid in gastric carcinogenesis in beagles. Gut. 2002;50:61-64. [PubMed] |
| 4. | 林 三仁. 消化系统疾病电子内镜图谱. 北京: 北京大学医学出版社. 2003;34-35. |
| 5. | 朱舜时, Joel Mason, 施尧, 胡运彪, 李蓉蓉, 汪敏, 周怡和, 金冠球, 谢宇野, 邬桂泉, 夏德凰, 钱珍华, 宋海连, 屠伯强, 张丽冬, RobertRussell, 萧树东. 叶酸对胃癌和其他胃肠道癌发生的干预作用-临床试验七年随访. 胃肠病学. 2002;7:73-78. |
| 7. | Monk M. Epigenetic programming of differential gene expression in development and evolution. Dev Genet. 1995;17:188-197. [PubMed] |
| 8. | Jang TJ, Kim DI, Shin YM, Chang HK, Yang CH. p16(INK4a) Promoter hypermethylation of non-tumorous tissue adjacent to gastric cancer is correlated with glandular atrophy and chronic inflammation. Int J Cancer. 2001;93:629-634. [PubMed] |