修回日期: 2005-09-01
接受日期: 2005-09-06
在线出版日期: 2006-02-28
目的: 探讨胰岛细胞移植中冷缺血时间、组织相容性对于胰岛细胞活性的影响.
方法: 采用脑死亡自愿捐赠器官的供者胰腺(已知血型和HLA配型); 高渗枸橼酸盐嘌呤溶液经过经主动脉原位灌注后, 肝、肾、胰腺联合及分别切取, 测定不同的冷却血时间条件下胰岛细胞活性的变化. 测定胰岛细胞和血液组织相容性, 分析供受者的组织相容性和胰岛细胞存活的关系.
结果: 肝脏、胰腺、肾脏联合切取及各器官的单独切取顺利, 在冷却血5 h以内胰岛细胞活性率都在80%以上, 用于胰岛细胞移植的胰腺和其他器官的切取不会影响胰岛细胞的活性; 人类胰岛暴露于未经抗凝的人类血中, 胰岛将诱发一个迅速血细胞消耗. 进行血小板激、中性粒细胞和单核细胞计数, HLA错配组分别为(1.0±0.72)×109/L, (0.54±0.24)×109/L, (0.01±0.00)×109/L, HLA匹配组为(6.0±0.27×109/L, (0.63±0.19)×109/L, (0.03±0.01)×109/L, 无论HLA错配还是匹配血细胞都发生明显的消耗; 加入肝素后血细胞计数HLA错配组分别为(57.2±21.10)×109/L, (1.74±0.87)×109/L, (0.75±0.24)×109/L, HLA匹配组为(67.9±19.0)×109/L, (3.42±0.61)×109/L, (0.47±0.08)×109/L, 与对照组比较反应明显减轻(P<0.05); 胰岛细胞体外培养24 h后, 匹配组活性胰岛细胞数量分别为(1.085±0.167)×105/L, 错配组为(0.697±0.193)×105/L, 具有显著性差异(P<0.05).
结论: 把握胰岛细胞移植过程中冷缺血时间及组织相容性关系能够提高胰岛细胞的存活.
引文著录: 高宏君, 徐达传, 赵明, 李民, 范礼佩, 李留洋, 钱俊, 蔡德鸿. 冷缺血时间及组织相容性对胰岛细胞活性的影响. 世界华人消化杂志 2006; 14(6): 588-593
Revised: September 1, 2005
Accepted: September 6, 2005
Published online: February 28, 2006
AIM: To investigate the impacts of cold ischemia preservation time and histocompatibility on the activity of islet cells during the islet transplan-tation.
METHODS: Pancreas was obtained from brain-dead donors, whose blood and HLA types were known. After in situ perfusion with hypertonic citrate adenine solution (HC-A) via aorta, the liver, kidney, and pancreas were resected in combination or separately. The changes of islet cell activity under different time of cold ischemia preservation were observed. The compatibility of islet cells with recipients was detected and the relationship between the histocompatibility and islet cell survival were analyzed.
RESULTS: Resection in combination or alone was successfully performed, and the rate of islet cell activity was all above 80% after cold ischemia for 5 h. Resection style in the purpose of transplantation had no impact on the activity of islet cells, while the cold ischemia preservation time was in negative correlation with it. When presented in blood, human islets induced a rapid consumption of blood cells. Both in HLA incompatibility and compatibility groups, the numbers of platelets, neutrophils, and monocytes were notably reduced [(1.0 ± 0.72) × 109/L, (0.54 ± 0.24) × 109/L, (0.01 ± 0.00) × 109/L); (6.0 ± 0.27) × 109/L, (0.63 ± 0.19) × 109/L, (0.03 ± 0.01) × 109/L]. When heparin was used, these events were obviously avoided. The numbers of platelets, neutrophils, and monocytes were significantly increased in HLA incompatibility [(57.2 ± 21.10) × 109/L, (1.74 ± 0.87) × 109/L, (0.75 ± 0.24) × 109/L] and compatibility group [(67.9 ± 19.0) × 109/L, (3.42 ± 0.61) × 109/L, (0.47 ± 0.08) × 109/L] in comparison with those in control group (P < 0.05). After cultivates 24 hours, HLA typing compatible groups (1.085±0.167×105/L), HLA typing incompatibility groups (0.697 ± 0.193×105/L), the quantity of living islets in HLA typing compatible groups is more than the groups which HLA typing is incompatibility (P < 0.05). After cultured for 24 h in vitro, the number of active islet cells in HLA compatibility group was significantly larger than that in HLA incompatibility group [(1.085 ± 0.167) × 105/L vs (0.697 ± 0.193)×105/L, P < 0.05].
CONCLUSION: The survival rate of islet cells during transplantation can be enhanced by reducing cold ischemia preservation time and using HLA compatible donors.
- Citation: Gao HJ, Xu DC, Zhao M, Li M, Fan LP, Li LY, Qian J, Cai DH. Influence of cold ischemia preservation time and histocompatibility on activity of islet cells. Shijie Huaren Xiaohua Zazhi 2006; 14(6): 588-593
- URL: https://www.wjgnet.com/1009-3079/full/v14/i6/588.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i6.588
胰岛细胞移植中足量活性良好胰岛细胞数量及其存活是胰岛细胞移植成功的关键, 我们采用高渗枸橼酸盐嘌呤溶液原位灌注, 进行人的胰腺保存和分离, 并探讨其及冷缺血时间对于胰岛细胞活性影响. 移植中组织相容性和细胞的存活及功能密切相关[1]. 胰岛移植后, 即可能发生有害的组织不相容性反应. 故我们根据美国国立器官移植分配中心(UNOS)制定的HLA交叉反应组(CREG)的配型原则来进行胰岛细胞体外和血液的组织相容性测试.
采用脑死亡自愿捐赠者的器官(已知血型和HLA配型), 在其他器官切取后或同时进行胰腺的获取; 血型相同, HLA配型相符的血液、HLA配型高致敏(错配3个以上位点)或PRA>50%或淋巴毒阳性受者的血液; 分离纯化后的胰岛细胞悬浊液, 经过70 μm的筛网滤过后, 保留直径大于70 μm的胰岛细胞, 配置成浓度1.20×105/L左右活性胰岛细胞悬浊液.
1.2.1 胰腺的获取: 采用胰腺、肾脏的联合切取, 肝脏、胰腺、肾脏的单独切取及联合切取[2].
1.2.2 胰岛的分离: 采用胶原霉P进行消化分离[3].
1.2.3 胰岛细胞活性测定及胰岛细胞与冷缺时间的关系: 双硫腙(DTZ)、丫腚橙(AO)染色判定活性胰岛细胞活性, 制备胰岛细胞团的电镜标本送透射电镜观察[3].
1.2.4 胰岛细胞和血液组织相容性测定: 根据血液和胰岛细胞的HLA配型情况分为: HLA匹配组: 受者全血+胰岛细胞, 受者全血+胰岛细胞+肝素; 错配组: 受者全血+胰岛细胞, 受者全血+胰岛细胞+肝素; 对照组: 受者全血+RPMI 1640[4].
1.2.5 计算方法: 根据70-350 μm各个数量级胰岛细胞的分布, 参照Ricordi的换算[5,17], 得出每克湿质量胰腺直径150 μm的胰岛换算值(IEQ, 150 μm islet equivalent), 冷保存指数(或输注指数)=收获的胰岛数量(IEQ)×10-3/冷缺血时间.
统计学处理 定量实验数据以mean±SD表示, 统计分析以SPSS10.0软件, 组间用t检验作显著性判断, 处理方法为配伍组方差分析并作两两比较.
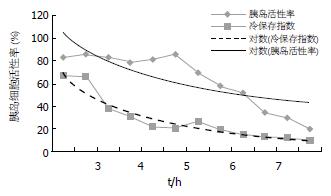
切取器官无污染, 效果满意. 用于切取的时间: 胰腺肾脏的联合切取、肝脏胰腺肾脏的联合切取方法平均需15 min, 肝脏、胰腺、肾脏的单独切取平均需20 min, 用于胰岛分离的胰腺12份, 冷缺血时间2.5-8 h. 冷缺血时间在5 h以内的9份, 温缺血时间0-3 min, 消化时间15±2.4 min. 胰岛收获量2.38±0.67(103 IEQ/g). 纯化后胰岛细胞的活性: 19%-83%. 冷保存指数(或输注指数): 9.8-66.4. 缺血时间在5 h以内的胰岛细胞的活性都在80%以上, 3, 4, 5 h分别是84.4%, 82.3%, 82.4%(图1).
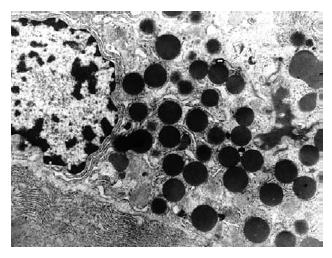
透射电镜下观察: β细胞膜完整, 细胞质内的高尔基体及线粒体丰富, 内质网清晰可见, 胞质内充满核心颗粒, 细胞核居中, 核膜完整(图2).
当胰岛细胞加入血液当中后, 胰岛细胞诱发了血细胞类似炎症反应, 血小板在数量上迅速减少和随后的单核细胞、巨噬细胞减少. 围绕胰岛细胞出现了血细胞的聚集, 胰岛细胞被包裹在当中. HLA匹配组和错配组之间没有显著性差别(P>0.05). 加入肝素后抑制了血细胞凝集, 并且二者在统计学上没有差别(表1, 2).
HLA匹配组中, 肝素的加入经1 h的培养, 没有改变活性胰岛细胞数量. 错配组中, 加入肝素后经1 h的培养(淋巴毒阳性的除外), 明显提高了活性胰岛细胞数量. 24 h培养后, HLA匹配组的活性胰岛细胞数量和HLA错配组的活性胰岛细胞数量出现了明显的差异(P<0.05); HLA匹配组中, 有无添加肝素对1 h和24 h培养后的活性胰岛细胞数量影响不大(P>0.05); HLA错配组中肝素的加入对培养1 h后的活性胰岛细胞数量影响较大(P<0.05)(表3).
| 肝素组 | 对照组 | ||
| 匹配组 | 1.079±0.142 | 1.085±0.167 | |
| 错配组 | 1.001±0.240 | 0.697±0.193 | |
Edmonton研究表明, 胰岛细胞移植可以成功的治愈糖尿病[6]. 这种成功是建立在多因素联合的基础之上的, 如减少冷缺血时间, 足量的胰岛细胞及合理的免疫抑制方案. 1992年Hessellj发现经原位灌注胰腺的胰岛细胞活性和产量明显高于未经原位灌注胰腺. 因为原位灌注可显著的减少热缺血时间, 使要切取器官迅速降低温度. 在胰岛移植中, 胰腺的整体灌注更能起到良好的作用[7]: 第一, 整体灌注可以使胰腺组织迅速降温, 保证胰腺组织功能的良好性; 第二, 整体灌注可以冲洗掉胰腺组织内的血细胞, 使在消化后的胰腺组织更加有利于胰岛的分离纯化; 第三, 减少在转运过程中胰管内的胰液对组织的消化, 在相同的保存条件下, 使胰岛细胞的活性保持的更好[5]. 采用高渗枸橼酸盐嘌呤溶液1 500-2 000 mL, 对腹腔器官进行原位灌注, 我们在胰岛的制备过程中发现5 h以内的胰腺所制备胰岛活性和数量上并没有显著的差异. 可以看出, 高渗枸橼酸盐嘌呤溶液原位灌注的胰腺其胰岛细胞的活性和数量均可以满足移植的要求, 美中不足就是对于冷缺血时间要求比较高.
本试验中单位时间内(5 h以内)的冷保存指数与胰岛活性率的变化率相近. 在冷缺血时间小于5 h的情况下获取的胰腺, 均可以用于临床胰岛细胞移植的胰腺获取. 超过7 h, 胰岛细胞活性明显下降, 超过8 h, 胰岛细胞的活性率只有19%, 甚至更低, 而其活性的胰岛细胞的质量也不能满足临床移植的要求. 高渗枸橼酸盐嘌呤溶液原位整体灌注情况下, 用于胰岛移植的胰腺的冷缺血时间不宜超过5-6 h. 如何延长胰腺的保存时间[8-9]及冷缺血对于胰岛细胞损伤机制有待于进一步研究[10]. 实验结果分析后发现: 活性胰岛收获量的评估=收获的胰岛数量(IEQ)×ln[log(收获的胰岛数量(IEQ)×10-3/冷缺血时间)+G]. 将能够更加准确的评估胰岛的质量和数量(G是每一种保存液所特有的系数).
胰岛细胞经门静脉移植入血流丰富的肝脏, 保证胰岛细胞能够获得充足的养分[11]. 胰岛细胞一旦移植入血, 就引起血液中类似炎症的反应. 本研究中无论HLA配型的结果如何, 在数分钟之内都发生了这种凝集反应, 血细胞凝集在胰岛细胞的表面. 血小板在血液中迅速消耗, 是由于b-TG和P选择素同时诱发了血小板的活性, 在胰岛细胞的表面形成纤维蛋白包裹. 目前对胰岛细胞表面的血小板黏附配合体还没有定论, 虽然发现人的胰岛细胞表面有Ⅰ、Ⅲ、Ⅳ、Ⅴ胶原存在, 但却是胶原蛋白介导了血小板的黏附和活动[12-13]. CD36和P65都可能作为血小板胶原的受体, 当胰岛细胞暴露在血中时其他蛋白像血小板配合体一样开始黏附激活[14], 血小板在数量上首先迅速减少, 随后的单核细胞、巨噬细胞减少. 伴随着单核细胞、巨噬细胞围绕在已经黏附血小板胰岛细胞周围, 胰岛细胞周围黏附的血小板开始溶解, 说明了这一过程是由血小板激活的. 关于单核细胞、巨噬细胞对胰岛细胞的黏附一种解释是由lex(乳酸提取物)介导的, 由血小板表面的P选择素黏附于胰岛细胞表面[15]. 另一种解释是CD11b+淋巴细胞减少, CD11b+被纤维网所捕捉后由CD11b/CD18介导的黏附过程. 胰岛细胞移植后15-30 min, 胰岛细胞核染色加重, 周围黏连大量的CD11b+[16]. 单核细胞和中性粒细胞消耗的同时, 胰岛细胞内低水平的消化酶也造成胰岛细胞的损伤. 一个70 kg的患者需要移植的胰岛细胞数量600 000 IEQ, 胰岛细胞总表面积可能达到400 cm2, 这样大的面积在低压、流速缓慢的门静脉中很容易出现凝集的现象. 为了克服这种类似炎症的损伤, 目前很多移植中心在进行同种胰岛细胞移植的时候都使用一定数量的肝素, 一般肝素的剂量为75 IE/kg, 相对应的来说, 一个70 kg的人达到肝素浓度1 IE/mL将需要5 000 IE的肝素[17].
由于移植器官持续的表达同种异体的HLA抗原, 因而可以在移植后的任何时期诱导排斥反应. 早期很多移植中心在临床移植过程中, 没有进行HLA的配型, 除了血型相同, 少数仅有交叉配型[18], 所以临床结果并不理想. 群体反应性抗体(PRA)是患者HLA抗原体液致敏的结果, 是造成排斥的主要危险因素[1,18-19]. 临床移植中, 对于PRA高的, 特别是>50%, 应当严格按照HLA配型, 尽量选择与受者HLA表现型完全相容的供体, 或者相容程度高且没有与受者预致敏的HLA抗体特异性所对应抗原的供体, 移植的结果将提高. 本文对照组中PRA>50%的培养后胰岛细胞比匹配组出现了更大量的死亡. 形态学的观察中, 匹配组1 h培养血细胞对胰岛细胞凝集没有明显变化, 这说明供者的HLA分子可能没有激活T细胞, 没有诱发对于胰岛细胞的毒性反应和过敏反应[18,20]. 对照组1 h观察中, 血细胞大量的凝集在胰岛细胞的周围, 淋巴毒阳性的已经出现胰岛细胞的大量死亡, 血细胞对于胰岛细胞的侵害明显高于匹配组. 不仅如此, 破坏的胰岛细胞内分泌酶释放, 也造成血细胞的破坏, 进而加速了血细胞和胰岛细胞之间的相互破坏[21]. 对照组血细胞的凝集在胰岛细胞周围可能如同血管内皮细胞缺损一样, 引起胰岛细胞周围一个类似炎症的损害, 这种损害可能比较轻, 并不是造成胰岛细胞死亡实质损害原因. 错配组不仅发生这种类似炎症的反应, 而且进一步出现了细胞毒性反应或过敏反应, 从而造成移植胰岛细胞的排斥反应, 胰岛细胞大量的死亡[19,22].
在胰岛移植过程中, 胰岛细胞的数量和胰岛细胞的活性是非常重要的, 对于60 kg人至少需要360 000个胰岛细胞[23]. 埃德蒙顿的患者平均需要移植857 318个胰岛细胞[24], 从胰岛细胞的数量上每位患者需要移植至少2个胰腺的胰岛细胞, 使用单一胰腺使移植获得成功成为探索的方向[25], 获得足量胰岛细胞及其存活数量将是移植成功的关键所在[26]. 组织相容性对于胰岛细胞长期存活有着重要意义[27], 随着干细胞、基因学及转基因研究的深入[28-30], 也必将为解决胰岛细胞移植提供新思路、新方法.
加拿大埃德蒙顿阿尔波特大学在2000年左右成功的进行了7例胰岛细胞移植, 和以往不同的是此种移植后患者的血糖完全控制在正常范围内, 经过随访表明移植效果满意. 本文目的在于探讨冷缺血时间及组织相容性对胰岛细胞活性的影响.
胰岛细胞移植需要移植的胰岛细胞数量很多, 至少要2-3个供体的胰腺, 目前随着技术成熟逐渐向单一供体的胰岛细胞移植发展, 要实现单一供体移植成功, 如何保证获得足量活性良好的胰岛细胞是关键.
活性胰岛收获量的评估=收获的胰岛数量(IEQ)×ln[log(收获的胰岛数量(IEQ)×10-3/冷缺血时间)+G], 将能够更加准确的评估胰岛的质量和数量(G是每一种保存液所特有的系数), 第一次将组织配型学引进胰岛细胞移植中, 证实在胰岛细胞的移植中应当考虑组织相容性对其的影响.
高渗枸橼酸盐嘌呤溶液是国内目前应用最多的器官保存液, 本文证实其对于胰腺的保存时间最多超过5-6 h, 否则会影响胰岛细胞活性率. 本文将组织配型引入胰岛细胞的移植中, 为胰岛细胞的长期存活提供了依据.
IEQ: 150 μm的胰岛换算值, 因为胰岛是由细胞团构成, 所以细胞团直径差距很大, 50-350 μm各个数量级胰岛细胞的分布, 参照Ricordi的换算得出不同直径胰岛细胞相当于150 μm直径胰岛细胞的数量.
胰岛移植作为治疗糖尿病并阻止糖尿病并发症的发生、发展的新方法, 日益受到重视. 但在胰腺的保存, 胰岛的分离、纯化及移植后的活性保持等方面仍有许多未知的东西需要不断深入研究. 本文选择了其中关于切除、保存及移植的并发症进行研究和探讨, 内容较新, 研究方法较先进, 结果可信, 结论恰当, 具有一定的科学意义.
电编: 李琪 编辑:张海宁
| 1. | Bouwman LH, Ling Z, Duinkerken G, Pipeleers DG, Roep BO. HLA incompatibility and immunogenicity of human pancreatic islet preparations cocultured with blood cells of healthy donors. Hum Immunol. 2005;66:494-500. [PubMed] |
| 5. | Murdoch TB, McGhee-Wilson D, Shapiro AM, Lakey JR. Methods of human islet culture for transplantation. Cell Transplant. 2004;13:605-617. [PubMed] |
| 6. | Hesse UJ, Meyer GP, Weyer J, Schmitz-Rode M, Danis J, Tunggal B. In situ intraductal collagenase injection for preparation of islets of Langerhans in the pig. Transplant Proc. 1992;24:1007-1009. [PubMed] |
| 7. | Rose NL, Palcic MM, Shapiro AM, Lakey JR. Endogenous pancreatic enzyme activity levels show no significant effect on human islet isolation yield. Cell Transplant. 2004;13:153-160. [PubMed] |
| 8. | Carter J, Karmiol S, Nagy M, McElreath R, Calloway C, Motley A, Neill A, Jang HJ, Posselt A, Stock P. Pretransplant islet culture: a comparison of four serum-free media using a murine model of islet transplantation. Transplant Proc. 2005;37:3446-3449. [PubMed] |
| 9. | Barnett MJ, McGhee-Wilson D, Shapiro AM, Lakey JR. Variation in human islet viability based on different membrane integrity stains. Cell Transplant. 2004;13:481-488. [PubMed] |
| 10. | Stagner JI, Parthasarathy SN, Wyler K, Parthasarathy RN. Protection from ischemic cell death by the induction of cytoglobin. Transplant Proc. 2005;37:3452-3453. [PubMed] |
| 11. | Froud T, Ricordi C, Baidal DA, Hafiz MM, Ponte G, Cure P, Pileggi A, Poggioli R, Ichii H, Khan A. Islet transplantation in type 1 diabetes mellitus using cultured islets and steroid- free immunosuppression: Miami experience. Am J Transplant. 2005;5:2037-2046. [PubMed] |
| 12. | Van Deijnen JH, Van Suylichem PT, Wolters GH, Van Schilfgaarde R. Distribution of collagens type I, type III and type V in the pancreas of rat, dog, pig and man. Cell Tissue Res. 1994;277:115-121. [PubMed] |
| 13. | van Suylichem PT, van Deijnen JE, Wolters GH, van Schilfgaarde R. Amount and distribution of collagen in pancreatic tissue of different species in the perspective of islet isolation procedures. Cell Transplant. 1995;4:609-614. [PubMed] |
| 14. | Kehrel B, Wierwille S, Clemetson KJ, Anders O, Steiner M, Knight CG, Farndale RW, Okuma M, Barnes MJ. Glycoprotein VI is a major collagen receptor for platelet activation: it recognizes the platelet-activating quaternary structure of collagen, whereas CD36, glycoprotein IIb/IIIa, and von Willebrand factor do not. Blood. 1998;91:491-499. [PubMed] |
| 15. | Kirchhofer D, Riederer MA, Baumgartner HR. Specific accumulation of circulating monocytes and polymorphonuclear leukocytes on platelet thrombi in a vascular injury model. Blood. 1997;89:1270-1278. [PubMed] |
| 16. | Pinkse GG, Tysma OH, Bergen CA, Kester MG, Ossendorp F, van Veelen PA, Keymeulen B, Pipeleers D, Drijfhout JW, Roep BO. Autoreactive CD8 T cells associated with beta cell destruction in type 1 diabetes. Proc Natl Acad Sci USA. 2005;102:18425-18430. [PubMed] |
| 17. | Ricordi C, Tzakis AG, Carroll PB, Zeng YJ, Rilo HL, Alejandro R, Shapiro A, Fung JJ, Demetris AJ, Mintz DH. Human islet isolation and allotransplantation in 22 consecutive cases. Transplantation. 1992;53:407-414. [PubMed] |
| 18. | Bennet W, Sundberg B, Groth CG, Brendel MD, Brandhorst D, Brandhorst H, Bretzel RG, Elgue G, Larsson R, Nilsson B. Incompatibility between human blood and isolated islets of Langerhans: a finding with implications for clinical intraportal islet transplantation? Diabetes. 1999;48:1907-1914. [PubMed] |
| 19. | Speiser DE, Jeannet M. Renal transplantation to sensitized patients: decreased graft survival probability associated with a positive historical crossmatch. Transpl Immunol. 1995;3:330-334. [PubMed] |
| 20. | White SA, Davies JE, Pollard C, Swift SM, Clayton HA, Sutton CD, Weymss-Holden S, Musto PP, Berry DP, Dennison AR. Pancreas resection and islet autotransplantation for end-stage chronic pancreatitis. Ann Surg. 2001;233:423-431. [PubMed] |
| 21. | Eckhoff DE, Smyth CA, Eckstein C, Bilbao G, Young CJ, Thompson JA, Contreras JL. Suppression of the c-Jun N-terminal kinase pathway by 17beta-estradiol can preserve human islet functional mass from proinflammatory cytokine-induced destruction. Surgery. 2003;134:169-179. [PubMed] |
| 22. | Sutton VR, Estella E, Li C, Chen M, Thomas HE, Kay TW, Trapani JA. A critical role for granzyme B, in addition to perforin and TNFalpha, in alloreactive CTL-induced mouse pancreatic beta cell death. Transplantation. 2006;81:146-154. [PubMed] |
| 23. | Warnock GL, Rajotte RV. Critical mass of purified islets that induce normoglycemia after implantation into dogs. Diabetes. 1988;37:467-470. [PubMed] |
| 24. | Ryan EA, Lakey JR, Paty BW, Imes S, Korbutt GS, Kneteman NM, Bigam D, Rajotte RV, Shapiro AM. Successful islet transplantation: continued insulin reserve provides long-term glycemic control. Diabetes. 2002;51:2148-2157. [PubMed] |
| 25. | Hering BJ, Kandaswamy R, Ansite JD, Eckman PM, Nakano M, Sawada T, Matsumoto I, Ihm SH, Zhang HJ, Parkey J. Single-donor, marginal-dose islet transplantation in patients with type 1 diabetes. JAMA. 2005;293:830-835. [PubMed] |
| 26. | Ryan EA, Lakey JR, Rajotte RV, Korbutt GS, Kin T, Imes S, Rabinovitch A, Elliott JF, Bigam D, Kneteman NM. Clinical outcomes and insulin secretion after islet transplantation with the Edmonton Protocol. Diabets. 2001;50:710-719. [PubMed] |
| 27. | Biancone L, Cantaluppi V, Romanazzi GM, Russo S, Figliolini F, Beltramo S, Scalabrino E, Deregibus MC, Romagnoli R, Franchello A. Platelet-activating factor synthesis and response on pancreatic islet endothelial cells: relevance for islet transplantation. Transplantation. 2006;81:511-518. [PubMed] |
| 28. | Roche E, Reig JA, Campos A, Paredes B, Isaac JR, Lim S, Calne RY, Soria B. Insulin-secreting cells derived from stem cells: clinical perspectives, hypes and hopes. Transpl Immunol. 2005;15:113-129. [PubMed] |
| 29. | Deng S, Vatamaniuk M, Lian MM, Doliba N, Wang J, Bell E, Wolf B, Raper S, Matschinsky FM, Markmann JF. Insulin gene transfer enhances the function of human islet grafts. Diabetologia. 2003;46:386-393. [PubMed] |
| 30. | Wang H, Lee SS, Dell'Agnello C, Tchipashvili V, D'Avilla J, Czismadia E, Chin BY, Bach FH. Bilirubin can induce tolerance to islet allografts. Endocrinology. 2006;147:762-768. [PubMed] |