修回日期: 2005-11-18
接受日期: 2005-11-24
在线出版日期: 2006-02-18
目的: 探讨核转移因子-κB(NF-κB)在肠缺血再灌注肝损伤发病机制中的作用及其对P-选择素(P-selectin)表达和中性粒细胞浸润的影响.
方法: Wistar大鼠24只随机分成对照(Control组)、肠缺血再灌注(I/R组)和脯氨酸二硫代氨基甲酸酯(PDTC)治疗组(PDTC组), 每组8只. I/R和PDTC组大鼠行肠系膜上动脉夹闭1 h再灌注2 h. PDTC组于手术前1 h给予20 g/L PDTC 100 mg/kg ip. 观察肝组织病理学及其肝功能变化, 检测血清IL-6, 肝组织匀浆超氧化物歧化酶(SOD)和髓过氧化物酶(MPO)水平. 免疫组化法观察肝组织P-selectin和NF-κB表达并采用Western blot法检测肝NF-κB的水平.
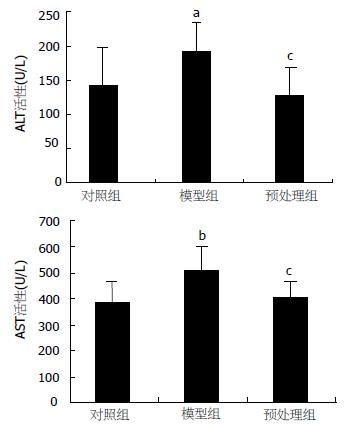
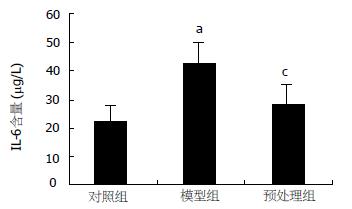
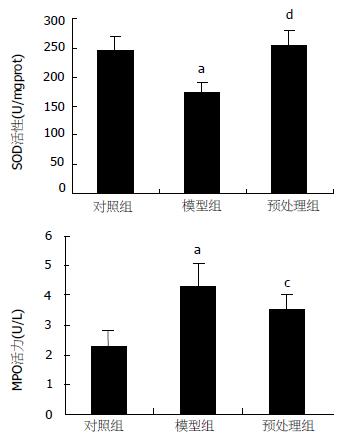
结果: 肠缺血再灌注诱发了肝损伤, 表现为肝水肿、出血和炎性粒细胞浸润. 与对照组相比, I/R组血清ALT、AST、IL-6水平明显升高(143.16±53.02至192.31±42.09 U/L, P<0.05; 387.46±78.74至507.56±96.26 U/L, P<0.01; 22.51±6.10至42.85±7.35 ng/L, P<0.01). 肝组织SOD活性降低、MPO含量明显升高(244.87±25.11至173.21±16.60 U/mgprot, P<0.01; 2.36±0.56至4.32±0.77 U/g, P<0.01); 肝组织的P-selectin和NF-κB表达增强. 采用PDTC预处理, 与I/R组相比, 肝损伤程度减轻, 血清ALT(128.63±38.94 U/L)、AST(462.86±60.84 U/L)以及IL-6(28.08±7.55 ng/L)水平明显降低(P<0.01, P<0.05,P<0.05); 肝脏氧化损伤及白细胞浸润减弱, 表现为肝组织SOD活性升高(253.45±25.21 U/mgprot, P<0.01)、MPO含量降低(3.58±0.49 U/g, P<0.05), 同时伴有肝组织中的P-selectin和NF-κB表达减弱.
结论: 肠缺血再灌注诱发肝损伤, 伴有明显的中性粒细胞浸润和肝组织P-selectin的表达增强, NF-κB的活化在此损伤过程中起重要作用. PDTC通过抑制NF-κB活性对肠缺血再灌注肝损伤起保护作用.
引文著录: 李英华, 田晓峰, 王真真, 张雪松, 张峰, 金松, 姚继红. NF-κB对肠缺血再灌注肝损伤P-选择素表达和中性粒细胞浸润的作用. 世界华人消化杂志 2006; 14(5): 486-490
Revised: November 18, 2005
Accepted: November 24, 2005
Published online: February 18, 2006
AIM: To investigate the effect of nuclear factor-κB (NF-κB) on P-selectin expression and neutro-phil accumulation in liver injury induced by intestinal ischemia/reperfusion (I/R) in rats.
METHODS: Twenty-four Wistar rats were randomly assigned into sham operation (control, n = 8), intestinal I/R (n= 8), and pyrrolidine dithiocarbamate (PDTC) treatment (n = 8). The rats in I/R and PDTC group received 1 h SMA occlusion and 2 h reperfusion, and those in PDTC group was also intraperitoneally injected with 20 g/L PDTC (100 mg/kg) 1 h before operation. Liver histology was observed under light microscope. The level of serum alanine aminotransferase (ALT), aspartate aminotransferase (AST) and interleukin-6 (IL-6), and liver tissue superoxide dismutase (SOD), myeloperoxidase (MPO) contents were measured. The immunohistochemical expression of liver NF-κB and P-selectin as well as Western blot analysis of liver NF-κB were assayed.
RESULTS: Liver injury was induced by intestinal I/R, characterized as histological damage of edema, hemorrhage and polymorphonuclear infiltration as well as the significant rise of serum ALT (from 143.16 ± 53.02 to 192.31 ± 42.09 U/L, P < 0.05) and AST level (from 387.46 ± 78.74 to 507.56 ± 96.26 U/L, P < 0.01). In comparison with that in control group, the level of serum IL-6 increased significantly (from 22.51 ± 6.10 to 42.85 ± 7.35 ng/L, P < 0.01) in I/R group, and tissue SOD decreased (from 244.87 ± 25.11 to 173.21 ± 16.60 U/mgprot, P < 0.01) while MPO increased (from 2.36 ± 0.56 to 4.32 ± 0.77 U/g, P < 0.01) significantly. Strong positive expression of NF-κB p65 and P-selectin were observed. After PDTC administration, the level of serum IL-6, tissue SOD and MPO were improved markedly (28.08 ± 7.55 ng/L, P < 0.05; 253.45 ± 25.21 U/mgprot, P < 0.01; 3.58 ± 0.49 U/g, P < 0.05) as compared with those in I/R group, and the expression of NF-κB and P-selectin were weakened markedly.
CONCLUSION: The activation of NF-κB plays an important role in the pathogenesis of liver injury induced by intestinal through up-regulating the neutrophil infiltration and liver P-selectin expression. PDTC as an inhibitor of NF-κB can prevent this injury through inhibiting NF-κB activity.
- Citation: Li YH, Tian XF, Wang ZZ, Zhang XS, Zhang F, Jin S, Yao JH. Effect of nuclear factor-kB on P-selectin expression and neutrophil infiltration in liver injury induced by intestinal ischemia/reperfusion in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(5): 486-490
- URL: https://www.wjgnet.com/1009-3079/full/v14/i5/486.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i5.486
肠缺血再灌注(intestinal ischemia/reperfusion, IIR)造成的损伤不仅局限于肠道本身, 含有大量毒素的血液还可引起远隔脏器的严重损伤. 通常认为, IIR是造成MODS和SIRS的始动因素, 其引发的MODS是临床上常见的并发症和重要的死亡原因[1-3]. 肝脏做为肠缺血再灌注后接受含有毒素血液的最直接器官, 其不仅分解和代谢这些毒素, 同时也受这些毒素的损伤并产生新的炎症因子, 研究肠缺血再灌注肝脏损伤机制及其保护预处理十分必要.
IIR肝损伤的机制较复杂. 早期研究认为, 再灌注血液中的毒性氧化物质、细胞炎症因子和化学因子直接作用到靶器官细胞是造成损伤的主要原因, 细胞间黏附因子和中性粒细胞浸润在IIR肝损伤中起重要作用[4-7]. 但新近研究表明, 这些介质是通过基因诱导完成的, 核转录因子κB(NF-κB)可上调这些炎症介质的表达[8-11]. 我们探讨NF-κB在IIR肝损伤中的作用以及NF-κB抑制剂脯氨酸二硫代氨基甲酸酯(PDTC)预处理对IIR肝损伤P选择素(P-selectin)的表达和中性粒细胞浸润的影响.
♂Wistar大鼠24只, 体质量200-260 g, 由大连医科大学动物中心提供. 随机分为3组(n = 8): 对照组, 模型组(I/R组), PDTC预处理组. 大鼠10%水合氯醛350 mg/kg ip麻醉后, 上腹正中切口入腹, 对照组大鼠剖腹后分离肠系膜上动脉但不结扎; I/R组采用Megison法[12]制作肠缺血再灌注模型, 分离并结扎肠系膜上动脉1 h再灌注2 h; PDTC预处理组手术操作同I/R组, 术前1 h 给予20 g/L PDTC 100 mg/kg ip. 对照组和I/R组给予等量生理盐水. 再灌注2 h后处死动物, 取血及肝组织.
肝组织经40 g/L中性甲醛固定后作4 mm石蜡切片, HE染色, 光镜下观察肝脏组织形态学改变. 分离的血清采用OLYMPUS AU1000生化自动分析仪进行ALT, AST活性测定. 血清IL-6的检测采用放免试剂盒(解放军总医院科技开发中心放免所)进行检测. 肝组织超氧化物歧化酶(SOD)和髓过氧化物酶(MPO)的测定分别采用硫代巴比妥酸法和过氧化氢还原法(试剂盒均为南京建成生物公司产品). 肝组织NF-κB p65和P-selectin的免疫组化检测采用SP免疫组化法, 5 mm石蜡切片置二甲苯中脱蜡, 30 mL/L过氧化氢孵育消除内源性过氧化物酶, 正常非免疫动物血清封阻30 min, 分别滴加多克隆兔抗鼠NF-κB p65和P-selectin一抗(分别为NeoMarkers和博士德生物工程公司产品)4 ℃过夜. 再加入生物素标记的二抗(羊抗兔IgG抗体)和链霉素抗生物素蛋白. DAB显色, 苏木精复染. NF-κB的Western blot分析, 按蛋白提取试剂盒(Pierce, Meridian Road, Rockford)说明书提取肝组织核蛋白, 用考马斯亮蓝法(南京建成生物技术公司产品)测定蛋白浓度. 蛋白于10%聚丙烯酰胺凝胶电泳分离后转膜, 加入NF-κB p65(NeoMarkers公司产品)兔抗大鼠多克隆抗体(1:1 000稀释)4 ℃过夜, 加辣根过氧化酶标记的二抗(1:2 000稀释)37 ℃孵育1 h, DAB显色3-10 min, 照片采用凝胶成像系统进行密度分析(Kodak system EDAS120).
统计学处理 数据以均数±标准差表示, 采用F检验和q检验进行统计学分析, P<0.05为差异有显著性.
光镜下可见I/R组肝脏组织水肿、少量出血和大量炎性细胞浸润. PDTC预处理组肝组织充血、水肿减轻, 仅见少量炎细胞浸润. 肠缺血1 h再灌注2 h可引起血清ALT、AST水平明显升高, 和对照组相比有显著差异(P<0.05,P<0.01). PDTC预处理组肝组织损伤明显改善, 血清ALT、AST水平低于I/R组(P<0.01, P<0.05, 图1). I/R组的血清IL-6水平明显升高, 与对照组相比差异显著(P<0.01). 与I/R组比较, PDTC预处理组血清IL-6活性明显下降(P<0.05, 图2).
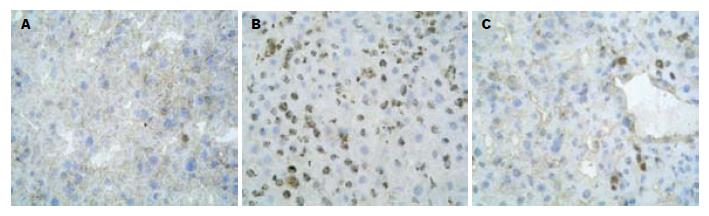
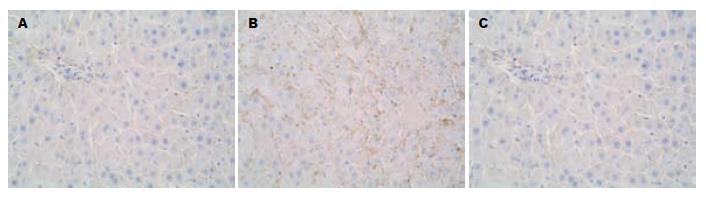
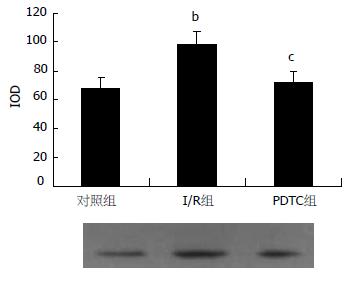
I/R组SOD及MPO水平分别出现明显下降和升高, 与对照组相比有显著差异(P<0.01, P<0.01), 采用PDTC预处理后其水平分别较I/R组明显升高和下降(P<0.01, P<0.05, 图3). 结果表明, PDTC可显著抑制肠缺血再灌注时远隔器官肝组织的白细胞浸润趋化和肝组织的ROS生成及脂质过氧化损伤. 肝组织NF-κB p65和P-selectin的表达在对照组中呈浅棕色, 弱阳性表达, 主要集中于胞质中. 而模型组二者的表达不仅分布在胞质中, 在细胞核中也呈较强棕色表达. PDTC预处理组与模型组相比, NF-κB p65和P-selectin的表达明显减弱(图4, 5). 对照组NF-κB p65 Western blot分析的阳性信号较弱, 而在I/R组其表达明显增强(P<0.01). 与I/R组相比, PDTC预处理组NF-κB p65表达明显减弱(P<0.05, 图6).
肠缺血再灌注损伤是严重创伤、休克等疾病治疗过程中经常发生的病理生理过程, 是多脏器功能衰竭发生、发展的重要原因. 肝脏是受肠缺血再灌注损伤影响最直接的器官. IIR肝损伤的机制复杂, 早期研究认为许多损伤介质直接参与了IIR肝损伤的发病过程, 如ROS、NO、TNF-α、细胞黏附因子及中性粒细胞浸润等直接对肝脏组织产生损伤[5-7,13]. 近期研究表明, 这些介质的作用可受转录因子NF-κB的调节[8,14,15]. NF-κB是与免疫球蛋白κ轻链基因增强子κB序列特异结合的核因子, 存在于细胞中. 由Mr50 000和Mr65 000两个亚单位组成, 二者通常与抑制蛋白IκB结合, 这个磷酸化抑制体可被继发的泛素化(ubiquitin)而蛋白水解, NF-κB被活化并转入细胞核, 进而转录激活目的基因. 激活的多形核白细胞和炎症因子被释放入血循环中, 与远隔脏器内的血管内皮细胞作用, 造成系统的炎症反应[16-18]. 缺血再灌注后细胞黏附因子在白细胞所致的器官损伤中发挥重要的作用. 选择素是细胞黏附因子的一种, P-selectin的上调表达与损伤部位的白细胞黏附和浸润有关[19-21]. 有研究表明, 严重的损伤可引起P-选择素转录水平的上调, 在P-selectin启动区其受NF-κB反应因子调控, NF-κB活化可使P-selectin表达增加[22]. 而MPO则主要存在于PMN中, 组织MPO活力可反映组织PMN的积聚量, 其活性可说明PMN在组织中聚集情况[23,24].
PDTC是一种抗氧化剂, 其可通过选择性抑制核因子-κB的活化, 使致炎细胞因子基因表达受到抑制, 进而减少致炎细胞因子的释放[25-27]. 我们发现, 肠缺血1 h再灌注2 h可引起肝损伤, 表现为血清ALT、AST水平升高并出现组织病理学改变如肝水肿、出血和白细胞浸润, 肝组织SOD活性下降、MPO水平明显升高, 血清IL-6含量明显高于对照组. 这些改变与肝组织中NF-κB p65和P-selectin的高表达相平行, 这表明NF-κB的活化上调中性粒细胞浸润和P-selectin的表达参与了IIR肝损伤的病理过程. PDTC预处理后, NF-κB p65的表达水平明显下降, 肝组织损伤减轻, 血清ALT和AST、组织病理学、IL-6、PMNs浸润等均明显改善, P-selectin的表达水平也明显下降. 说明PDTC作为NF-κB的抑制剂, 通过抑制NF-κB的活化, 降低肝组织P-selectin和炎性细胞因子IL-6的表达, 减轻了肝组织中性粒细胞的浸润, 对肠缺血再灌注肝组织损伤具有明显的保护作用.
肠缺血再灌注损伤(IIR)是严重创伤、休克等疾病治疗过程中经常发生的病理生理过程, 其造成的损伤不仅局限于肠道本身, 并且含有大量毒素的血液还可引起远隔脏器的严重损伤. 早期研究认为许多损伤介质直接参与了IIR肝损伤的发病过程. 近期研究表明, 这些介质的作用可受转录因子NF-kB的调节.
研究和探讨NF-kB在IIR肝损伤中的作用以及NF-kB抑制剂脯氨酸二硫代氨基甲酸酯(PDTC)预处理对IIR肝损伤P-选择素(P-selectin)的表达和中性粒细胞浸润的影响有较大意义.
近年, 对肠缺血再灌注远隔器官的损伤中NF-kB的作用研究越来越多. 研究表明, 缺血再灌注损伤后的炎症介质和毒素受到NF-kB的调控, 对其机制的研究是目前关注的热点.
本文首先针对肠缺血再灌注肝损伤中NF-kB对P-选择素表达和中性粒细胞浸润进行了研究, 发现肠缺血再灌注诱发肝损伤, 伴有明显的中性粒细胞浸润和肝组织P-selectin的表达增强, NF-kB的活化在此损伤过程中起重要作用.
1 NF-κB: 核转移因子κB, 是与免疫球蛋白κ轻链基因增强子κB序列特异结合的核因子, 存在于细胞中. 其被活化后转入细胞核, 进而转录激活目的基因.
2 PDTC: 脯氨酸二硫代氨基甲酸酯, 是一种抗氧化剂, 其可通过选择性抑制核因子-κB的活化, 使致炎细胞因子基因表达受到抑制.
本文对大鼠肠缺血再灌注进行了研究, 发现经PDTC预注射后可减弱此过程对肝脏的病理损伤, 同时伴有P-selectin的表达增强及血清某些生化指标和细胞因子的变化. 研究方法科学, 结论正确, 对肠缺血再灌注器官损伤的保护有指导意义.
电编: 张敏 编辑:潘伯荣 审读:张海宁
| 1. | Nussler NC, Muller AR, Weidenbach H, Vergopou-los A, Platz KP, Volk HD, Neuhaus P, Nussler AK. IL-10 increases tissue injury after selective intestinal ischemia/reperfusion. Ann Surg. 2003;238:49-58. [PubMed] |
| 2. | Pierro A, Eaton S. Intestinal ischemia reperfusion injury and multisystem organ failure. Semin Pediatr Surg. 2004;13:11-17. [PubMed] |
| 3. | Hassoun HT, Kone BC, Mercer DW, Moody FG, Weisbrodt NW, Moore FA. Post-injury multiple organ failure: the role of the gut. Shock. 2001;15:1-10. [PubMed] |
| 4. | Horie Y, Wolf R, Miyasaka M, Anderson DC, Granger DN. Leukocyte adhesion and hepatic micro-vascular responses to intestinal ischemia/reperfusion in rats. Gastroenterology. 1996;111:666-673. [PubMed] |
| 5. | Chen JL, Zhou T, Chen WX, Zhu JS, Chen NW, Zhang MJ, Wu YL. Effect of tetramethylpyrazine on P-selectin and hepatic/renal ischemia and reperfusion injury in rats. World J Gastroenterol. 2003;9:1563-1566. [PubMed] |
| 6. | Poggetti RS, Moore EE, Moore FA, Koike K, Baner-jee A. Gut ischemia/reperfusion-induced liver dys-function occurs despite sustained oxygen consump-tion. J Surg Res. 1992;52:436-442. [PubMed] |
| 7. | Leister I, Mbachu EM, Post S, Samel ST, Stojanovic T, Gutt CN, Becker H, Markus PM. Vasoactive intestinal polypeptide and gastrin-releasing peptide attenuate hepatic microvasculatory disturbances following intestinal ischemia and reperfusion. Digestion. 2002;66:186-192. [PubMed] |
| 8. | Sun Z, Andersson R. NF-kappaB activation and inhibition: a review. Shock. 2002;18:99-106. [PubMed] |
| 9. | Lee JI, Burckart GJ. Nuclear factor kappa B: impor-tant transcription factor and therapeutic target. J Clin Pharmacol. 1998;38:981-993. [PubMed] |
| 10. | Bowie A, O'Neill LA. Oxidative stress and nuclear factor-kappaB activation: a reassessment of the evidence in the light of recent discoveries. Biochem Pharmacol. 2000;59:13-23. [PubMed] |
| 11. | Takahashi Y, Ganster RW, Gambotto A, Shao L, Kaizu T, Wu T, Yagnik GP, Nakao A, Tsoulfas G, Ishikawa T. Role of NF-kappaB on liver cold ischemia-reperfusion injury. Am J Physiol Gastrointest Liver Physiol. 2002;283:G1175-G1184. [PubMed] |
| 12. | Megison SM, Horton JW, Chao H, Walker PB. A new model for intestinal ischemia in the rat. J Surg Res. 1990;49:168-173. [PubMed] |
| 13. | Kawamoto S, Tashiro S, Miyauchi Y, Inoue M. Cha-nges in circulatory status and transport function of the liver induced by reactive oxygen species. Am J Physiol. 1995;268:G47-G53. [PubMed] |
| 14. | Orfila C, Lepert JC, Alric L, Carrera G, Beraud M, Pipy B. Immunohistochemical distribution of activated nuclear factor kappaB and peroxisome proliferator-activated receptors in carbon tetrachlo-ride-induced chronic liver injury in rats. Histochem Cell Biol. 2005;123:585-593. [PubMed] |
| 15. | Karin M. How NF-kappaB is activated: the role of the IkappaB kinase (IKK) complex. Oncogene. 1999;18:6867-6874. [PubMed] |
| 16. | Karin M. The beginning of the end: IkappaB kinase (IKK) and NF-kappaB activation. J Biol Chem. 1999;274:27339-27342. [PubMed] |
| 17. | Karin M, Delhase M. The I kappa B kinase (IKK) and NF-kappa B: key elements of proinflammatory signalling. Semin Immunol. 2000;12:85-98. [PubMed] |
| 18. | Souza DG, Vieira AT, Pinho V, Sousa LP, Andrade AA, Bonjardim CA, McMillan M, Kahn M, Teixeira MM. NF-kappaB plays a major role during the systemic and local acute inflammatory response fol-lowing intestinal reperfusion injury. Br J Pharmacol. 2005;145:246-254. [PubMed] |
| 19. | Ley K. The role of selectins in inflammation and disease. Trends Mol Med. 2003;9:263-268. [PubMed] |
| 20. | Ley K. Functions of selectins. Results Probl Cell Differ. 2001;33:177-200. [PubMed] |
| 21. | Mulligan MS, Paulson JC, De Frees S, Zheng ZL, Lowe JB, Ward PA. Protective effects of oligosac-charides in P-selectin-dependent lung injury. Nature. 1993;364:149-151. [PubMed] |
| 22. | Armstead VE, Minchenko AG, Campbell B, Lefer AM. P-selectin is up-regulated in vital organs during murine traumatic shock. FASEB J. 1997;11:1271-1279. [PubMed] |
| 23. | Meng Y, Zhang M, Xu J, Liu XM, Ma QY. Effect of resveratrol on microcirculation disorder and lung injury following severe acute pancreatitis in rats. World J Gastroenterol. 2005;11:433-435. [PubMed] |
| 24. | Olanders K, Borjesson A, Zhao X, Andersson R. Effects of anticoagulant treatment on intestinal ischaemia and reperfusion injury in rats. Acta Anaesthesiol Scand. 2005;49:517-524. [PubMed] |
| 25. | Liu SF, Ye X, Malik AB. Inhibition of NF-kappaB activation by pyrrolidine dithiocarbamate prevents In vivo expression of proinflammatory genes. Circulation. 1999;100:1330-1337. [PubMed] |
| 26. | Si X, McManus BM, Zhang J, Yuan J, Cheung C, Esfandiarei M, Suarez A, Morgan A, Luo H. Pyrrolidine dithiocarbamate reduces coxsackievirus B3 replication through inhibition of the ubiquitin-proteasome pathway. J Virol. 2005;79:8014-8023. [PubMed] |
| 27. | Ha T, Li Y, Gao X, McMullen JR, Shioi T, Izumo S, Kelley JL, Zhao A, Haddad GE, Williams DL. Attenuation of cardiac hypertrophy by inhibiting both mTOR and NF-kappaB activation in vivo. Free Radic Biol Med. 2005;39:1570-1580. [PubMed] |