修回日期: 2005-11-20
接受日期: 2005-11-24
在线出版日期: 2006-02-18
目的: 通过原代培养人肝癌细胞、克隆分离异质性亚群细胞, 探讨肝癌异质性机制.
方法: 原代培养人肝细胞癌细胞, 应用有限稀释法对培养的肝癌细胞进行单细胞克隆分离异质性亚群, 并应用细胞计数法测定其细胞倍增时间及倍增数, 流式细胞仪检测其DNA含量确定细胞周期分布, 裸鼠异体移植检测其成瘤能力.
结果: 分离到LCSC-1及LCSC-2两个细胞亚群. LCSC-1亚群细胞呈长梭形, 裸鼠异体移植不能成瘤(0/8); LCSC-2亚群细胞呈多角形、多突起, 裸鼠异体移植可成瘤(8/8). LCSC-1与LCSC-2相比, 体外增殖能力强, 倍增时间(18.6±3.2 h vs 25.9±4.7 h)和最大倍增倍数(16.1±1.4 vs 12.2±1.6)有显著差异(均P<0.01); 而且LCSC-1处于细胞周期S(28.4%±3.3% vs 20.2%±1.9%,P<0.01)和G2M(25.0%±6.3% vs 16.6%±4.7%, P<0.05)的比例明显高于LCSC-2.
结论: 原发性肝细胞癌中存在着异质性的肿瘤细胞亚群, 可能来源于肿瘤干细胞的分化.
引文著录: 颜政, 方驰华. 人肝细胞癌细胞亚群的克隆分离及异质性机制的初步研究. 世界华人消化杂志 2006; 14(5): 481-485
Revised: November 20, 2005
Accepted: November 24, 2005
Published online: February 18, 2006
AIM: To isolate and characterize the heterogene-ous subpopulation cells from human hepatocel-lular carcinoma (HCC), and to explore the mech-anism of HCC heterogeneity.
METHODS: Tumor samples were obtained from 1 patient with HCC after surgery, and then HCC cells were cultured in vitro by primary tissue culture technique. Heterogeneous subpopulations were isolated by limiting dilution and their growths were observed with the help of cell counts. The cycle and DNA content of tumor cells were investigated with flow cytometry. Each subpopulation was implanted in nude mice subcutaneously to measure the tumor forming ability.
RESULTS: Two subpopulations of HCC cells, LCSC-1 and LCSC-2, were derived from primary tumor tissues. LCSC-1 cells show a sharp and spindle feature, and could not form new tumor when implanted in nude mice (0/8). However, LCSC-2 cells were multangular in shape, with protuberances, and could produce new tumor (8/8). In comparison with LCSC-2 cells, LCSC-1 had stronger proliferation ability, and the double time (18.6 ± 3.2 h vs 25.9 ± 4.7 h) and maximum multiples (16.1 ± 1.4 vs 12.2 ± 1.6) were markedly different between the two (P < 0.01). Furthermore, the ratio of cells in S and G2M phase was significantly higher for LCSC-1 than those for LCSC-2 (S phase: 28.4% ± 3.3% vs 20.2% ± 1.9%, P < 0.01; G2M phase: 25.0% ± 6.3% vs 16.6% ± 4.7%, P < 0.05).
CONCLUSION: HCC cells are heterogeneous with respect to characteristics on morphology, proliferation and tumorigenesis potentiality. The heterogeneity of HCC may arise from the differentiation of tumor stem cells.
- Citation: Yan Z, Fang CH. Elementary study on subpopulation cell isolation and tumor heterogeneity of human hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(5): 481-485
- URL: https://www.wjgnet.com/1009-3079/full/v14/i5/481.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i5.481
在原发肿瘤组织中存在着不同的肿瘤细胞亚群, 这些亚群细胞具有不同的形态、表型和功能的特征. 在所有亚群中, 只有个别的亚群细胞具有肿瘤起始能力称为肿瘤起始细胞或肿瘤干细胞(tumor stem cells, TSC). 正是肿瘤干细胞的存在, 才可能是肝细胞癌复发、转移及产生耐药性的根本原因. 因此探讨其异质性机制具有重要的理论和实践意义. 我们原代培养人肝细胞癌细胞, 单细胞克隆分离肝癌细胞亚群, 并对分离到的细胞亚群进行形态学、增殖、成瘤及自我更新能力的观察, 探讨肝细胞癌异质性机制.
裸小鼠(BALB/c), 雌雄兼用, 4-6周龄, 体质量10-17 g, 由南方医科大学动物实验中心提供. 主要试剂: DMEM、胎牛血清(FBS)、谷氨酰胺、青霉素/链霉素为美国Gibco公司产品; 胰蛋白酶、胶原酶Ⅵ、胰岛素为Sigma公司产品.
1.2.1 分离、培养肝癌细胞原发性肝细胞癌组织: 取材于1例手术标本, 标本切下后10 min内剪取未坏死的肝癌组织, 将组织置入含青霉素(100 000 U/L), 链霉素(100 000 mg/L)的无血清DMEM培养基内, 并于1 h内处理. 组织块置于培养皿中, 加入DMEM液, 用眼科剪将不需要的血块和组织(坏死组织或结缔组织等)除去, 再用DMEM液漂洗两次后剪成约1 mm3大小. 加入0.1%胶原酶Ⅵ消化液37 ℃消化30 min, 细胞悬液纱布过滤, 1 000 r/min 5 min离心两次, 弃上清; 800 r/min 4 min离心两次, 弃上清, 每次以DMEM液重悬沉淀. 细胞沉淀重悬于DMEM中加10%(v/v)FBS. 测细胞活力, 以>1×109个/L的浓度接种于25 mL培养瓶, 50 mL/L CO2培养箱37 ℃孵育. 24 h后换液, 去除未贴壁细胞, 加入DMEM液(含10 mg/L胰岛素, 1 mmol/L谷氨酰胺, 100 000 U/L青霉素, 100 000 mg/L链霉素, 10% FBS). 37 ℃ 50 mL/L CO2培养箱内静置培养. 每两天半换液, 每天倒置显微镜观察. 成纤维细胞通过反复贴壁分离法、机械刮除法去除. 得到的为纯化的上皮样生长细胞, 每3 d传代一次.
1.2.2 有限稀释法克隆培养肝癌细胞: 取对数生长期的第10次传代细胞用胰蛋白酶消化、离心、计数; 将细胞稀释成100 mL约含50个细胞, 打匀; 用20 mL移液枪吸取细胞悬液点入96孔板, 每孔约2 mL, 倒置显微镜下观察, 仅给单个细胞的孔中加入培养液200 mL上述培养液, 然后置CO2培养箱37 ℃培养. 标记单细胞培养孔, 共164孔. 待孔内细胞增殖至大部分孔底盖满时, 经胰酶消化、分离转种植到24孔板上扩大培养. 最后形成7个克隆集落, 选取其中形态差别最大的两类细胞株, 并命名为肝癌亚群细胞LCSC-1和LCSC-2. 进行以下实验. LCSC-1和LCSC-2亚群细胞继续进行单细胞亚克隆培养.
1.2.3 细胞生长的测定: 用DMEM加15% FBS培养基将两亚群细胞分别调配成细胞数为3×104 mL的细胞悬液, 按每皿1 mL接种于3 cm的培养皿中, 2 d换液, 连续培养7 d, 每日各取3皿计数, 取平均值作为结果. 每个细胞数量设3个平行样, 实验重复3次, 计算平均值.
1.2.4 细胞周期的检测: 将处于生长期的上述LCSC-1和LCSC-2细胞换DMEM加2% FBS培养基同步化培养24 h, 胰酶消化, 预冷至4 ℃, PBS吹打成单细胞悬液, 离心弃上清, 质量分数700 mL/L酒精4 ℃固定48 h, 1 000 r/min离心10 min, 弃去上清, 加入1 mL PBS及10 g/L RNase 20 mL充分混匀, 37 ℃水浴45 min. PBS洗去RNase, 100 mL PBS重悬, 加100 mL PI染液4 ℃避光染色1 h. FACScan流式细胞仪测定荧光强度, 激发波长488 nm, cellquest分析软件进行细胞周期DNA含量分析, 确定细胞周期分布. 实验重复3次.
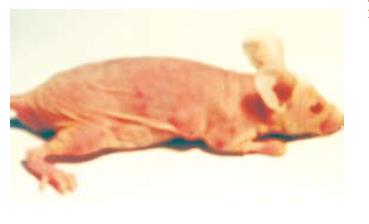
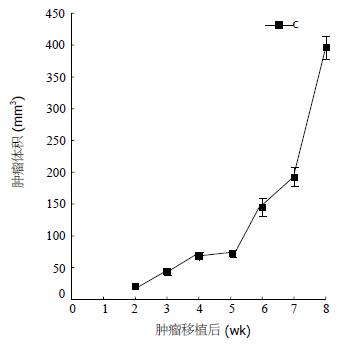
1.2.5 肿瘤细胞亚群成瘤能力测定: 调整肿瘤细胞密度为2×106/mL, 取0.2 mL细胞悬液注射到裸鼠腋背部皮下, 观察裸鼠移植肿瘤生长情况. 检测: 肿瘤生长曲线. 种植后2 wk末每周测量肿瘤的长径(a)和短径(b), 按公式V = a×b2/2计算肿瘤体积.
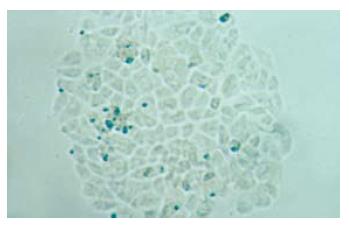
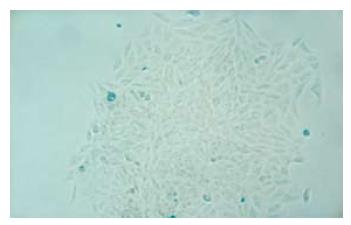
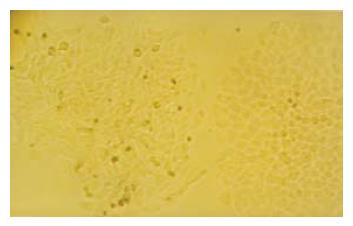
常规培养48 h, 相差显微镜下观察, LCSC-1细胞为梭形, 颗粒多, 生长分布不均, 突起少; LCSC-2细胞为多角形, 体积大小不均匀, 突起多, 颗粒少, 排列致密, 单层生长(图1, 2). LCSC-2细胞亚克隆培养, 产生的子代克隆集落出现了形态异质性的细胞, 同样产生梭形及多角形细胞;将多角形克隆集落转种植到24孔板扩大培养可见到同上两种不同形态的细胞集落(图3). 而LCSC-1细胞亚克隆培养未能产生子代细胞.
在功能上两亚群细胞也存在明显差异, LCSC-1细胞较LCSC-2细胞有更短的倍增时间及更高增殖倍数, 具有更旺盛的增殖能力. 经t检验有显著差异(P<0.05)(表1).
用流式细胞仪测定DNA相对含量, 确定细胞周期各时相所占的百分数. LCSC-1细胞与LCSC-2细胞比较, 无论是S期比例, 还是(S+G2M)都高, 说明其体外增殖能力较强. 经t检验有显著差异(P<0.05)(表1).
肿瘤研究的主要问题是确定有能力维持和致肿瘤克隆性生长的细胞类型. 大量的证据显示所有肿瘤是克隆性生长, 来源于一个单细胞. 在大多数肿瘤中, 哪种细胞具有肿瘤启动功能及维持肿瘤生长尚不清楚. 肿瘤具有异质性, 在原发肿瘤细胞中存在着不同的肿瘤细胞亚群, 这些亚群具有不同的形态、不同的增殖能力、不同的表型和染色体组型的特征[1,2], 只有有限数量的特殊亚群细胞具有肿瘤起始能力称为肿瘤起始细胞或肿瘤干细胞(TSC)[3,4]. 因此肿瘤中不同表型的细胞可能也来自干细胞的异常分化, 是正常干细胞遗传突变的积累的结果[5-7]. 他们的不对称分裂产生细胞质、细胞器不均分布, 分裂后形成两个不对称细胞, 其结果是维持TSC数目稳定并产生肿瘤, 使得细胞内DNA含量及细胞周期时相分布产生差异[8].
原发性肝细胞癌(hepatic cellular cancer, HCC)是我国常见的恶性肿瘤之一, 其死亡率在所有恶性肿瘤中居第三位. 可能正是由于肿瘤特殊亚群细胞的存在, 才是HCC复发、转移、耐药形成的根本原因[3,9-13]. 本实验通过原代肝细胞癌培养, 单细胞克隆分离亚群细胞. 根据显微镜下细胞形态的差异筛选鉴定了两个细胞亚群, 分别命名为LCSC-1、LCSC-2细胞亚群. 这两亚群细胞在形态上有明显差异, LCSC-1为梭形, 突起少, 表面平; LCSC-2为多角形, 体积不均匀, 排列致密. 在功能上两亚群细胞也存在明显差异, LCSC-1细胞较LCSC-2细胞有更短的倍增时间及更高增殖倍数. LCSC-1无论是S期比例还是(S+G2M)都高于LCSC-2, 说明其体外增殖能力较强. Arnerlov et al[14]认为肿瘤细胞DNA含量的异质性与组织形态学异质性有一定关系, 而DNA含量的异质性远较组织形态学异质性更早出现. 本文结果表明在组织形态学出现异质性的肝癌细胞亚群中其DNA相对含量、细胞周期时相分布均存在着差异, 这一结果与Arnerlov et al的观点是一致的. 通过亚克隆培养比较LCSC-1和LCSC-2两亚群细胞, LCSC-2细胞可以产生亚克隆子代细胞, 有较强的自我更新能力, LCSC-1未形成亚克隆. 观察LCSC-2亚克隆子代细胞形态发现有梭形及多角形两种细胞, 而将子代多角形克隆集落扩大培养可见到两种不同形态的集落, 说明LCSC-2亚克隆细胞同样产生了形态异质细胞. 在癌的生物学特性中, 作为恶性肿瘤的重要标志的成瘤能力最为关键. 实验证实LCSC-1和LCSC-2两亚群细胞的成瘤能力存在着明显差异, 证明两亚群存在成瘤能力的异质性, LCSC-2克隆子代细胞成瘤表明其保持母代细胞的特性. 在原发瘤中并非每个细胞亚群都存在致瘤能力, 有理论[15]认为, 这些特性也许是不同潜能的肿瘤细胞亚群与宿主组织或细胞之间, 相互作用、不断消长和选择过程中使最具有成瘤能力的细胞竞争性存活和发展的结果. 随着对肿瘤源细胞研究的深入, 肿瘤干细胞的不对称分裂产生细胞质、细胞器不均分布, 分裂后形成两个不对称细胞的机制才可能是肿瘤异质性的根本原因. LCSC-2株有较强致瘤能力及自我更新能力显示他具有干细胞的特征. 肿瘤干细胞的概念产生于肿瘤细胞和干细胞自我更新机制的相似性[3]. 最近关于白血病、乳腺癌的研究发现在肿瘤组织中只有少数细胞具有无限增生和致瘤的潜能, 而大多数细胞只有有限的克隆扩增和形成肿瘤的能力, 只分离出数量较少的细胞能够致瘤且具有明显的自我更新潜能[16,17].
总之, 两亚群细胞在形态、增殖能力、成瘤性、DNA相对含量及克隆能力存在异质性, 表明原发肝细胞癌存在异质性亚群, 只有LCSC-2亚群具有致瘤及自我更新能力, 显示LCSC-2具有干细胞特征, 肿瘤异质性可能产生于肿瘤干细胞的分化.
随着干细胞研究的不断深入, 发现干细胞和癌细胞之间有惊人的相似: 肿瘤可能通常起源于正常干细胞的转化, 相似的信号通路可能既调节干细胞也调节癌细胞的自我更新, 故癌细胞中可能包含有肿瘤干细胞(tumor stem cells). 目前, 在血液瘤、乳腺癌、脑肿瘤及前列腺癌中, 肿瘤干细胞研究取得了一定的进展. 但是, 其他实体瘤中肿瘤干细胞的鉴定与分离、肿瘤干细胞特征以及与成体干细胞的确切关系, 迫切需要通过实验进行探索.
本研究通过肿瘤异质性亚群的克隆分离, 研究肝脏肿瘤干细胞存在的可能性及其表型特征, 为今后肝肿瘤临床个性化靶向治疗提供理论依据.
肿瘤干细胞概念的提出有很长一段时间, 但近期才受到人们的关注. 本研究从肝癌组织中分离出具有不同形态和生物学特征的两种细胞亚群, 并且两群细胞的致瘤性也不同, 从而证明肿瘤细胞具有异质性, 并认为这种异质性可能来源于肿瘤干细胞的分化. 作者的研究思路很好, 研究结果对于揭示肿瘤发生机制有一定的帮助. 肿瘤干细胞应有相关表面标志, 如果作者能够深入研究两种细胞群的表面标志的差异, 将有助于寻找肝癌细胞的特征性标记物. 建议今后在这方面能够深入展开研究.
电编: 张敏 编辑:菅鑫妍 审读:张海宁
| 1. | Heppner GH. Tumor heterogeneity. Cancer Res. 1984;44:2259-2265. [PubMed] |
| 2. | Fleuren GJ, Gorter A, Kuppen PJ, Litvinov S, Warnaar SO. Tumor heterogeneity and immunothe-rapy of cancer. Immunol Rev. 1995;145:91-122. [PubMed] |
| 3. | Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105-111. [PubMed] |
| 4. | Hamburger AW, Salmon SE. Primary bioassay of human tumor stem cells. Science. 1977;197:461-463. [PubMed] |
| 5. | Osawa M, Hanada K, Hamada H, Nakauchi H. Long-term lymphohematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science. 1996;273:242-245. [PubMed] |
| 6. | Passegue E, Jamieson CH, Ailles LE, Weissman IL. Normal and leukemic hematopoiesis: are leukemias a stem cell disorder or a reacquisition of stem cell characteristics? Proc Natl Acad Sci USA. 2003;100:11842-11849. [PubMed] |
| 7. | Marx J. Cancer research. Mutant stem cells may seed cancer. Science. 2003;301:1308-1310. [PubMed] |
| 8. | Rhyu MS, Knoblich JA. Spindle orientation and asymmetric cell fate. Cell. 1995;82:523-526. [PubMed] |
| 9. | Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci USA. 2003;100:3983-3988. [PubMed] |
| 10. | Dick JE. Breast cancer stem cells revealed. Proc Natl Acad Sci USA. 2003;100:3547-3549. [PubMed] |
| 11. | Pardal R, Clarke MF, Morrison SJ. Applying the principles of stem-cell biology to cancer. Nat Rev Cancer. 2003;3:895-902. [PubMed] |
| 12. | Chaudhary PM, Roninson IB. Expression and activity of P-glycoprotein, a multidrug efflux pump, in human hematopoietic stem cells. Cell. 1991;66:85-94. [PubMed] |
| 13. | Zhou S, Schuetz JD, Bunting KD, Colapietro AM, Sampath J, Morris JJ, Lagutina I, Grosveld GC, Osawa M, Nakauchi H. The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype. Nat Med. 2001;7:1028-1034. [PubMed] |
| 14. | Arnerlov C, Emdin SO, Cajander S, Bengtsson NO, Tavelin B, Roos G. Intratumoral variations in DNA ploidy and s-phase fraction in human breast cancer. Anal Cell Pathol. 2001;23:21-28. [PubMed] |
| 15. | 江 希明, 郑 树, 丁 仁. 肿瘤生物学. 第1版. 浙江: 浙江科学技术出版社 1990; 240-241. |
| 16. | Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a pri-mitive hematopoietic cell. Nat Med. 1997;3:730-737. [PubMed] |
| 17. | Singh SK, Clarke ID, Terasaki M, Bonn VE, Haw-kins C, Squire J, Dirks PB. Identification of a cancer stem cell in human brain tumors. Cancer Res. 2003;63:5821-5828. [PubMed] |