修回日期: 2005-12-25
接受日期: 2005-12-31
在线出版日期: 2006-02-08
目的: 探讨昆明白族儿童HLA-DQA1等位基因位点上是否存在幽门螺杆菌(H. pylori)感染的易感基因或抵抗基因, 研究H. pylori感染的免疫遗传机制.
方法: 应用聚合酶链反应-序列特异性引物(PCR-SSP)方法对应用胶体金标疫渗滤法(DIGFA)和免疫印迹法联合诊断的32例H. pylori感染昆明白族儿童(实验组)和34例无H. pylori感染的昆明白族儿童(对照组)进行HLA-DQA1基因分型检测.
结果: 实验组HLA-DQA1*010401或*0402基因频率明显低于对照组, 两组比较差异存在显著性(0 vs 15%, χ2 = 0, P = 0.001, P = 0.014, OR = 1.172, 95%CI: 1.062-1.294).
结论: HLA-DQA1*010401或*0402基因可能对H. pylori感染具有免疫抵抗作用.
引文著录: 王美芬, 黄永坤, 郝萍, 戚勤, 文革生, 李海林, 周丽芳. 昆明白族儿童幽门螺杆菌感染与HLA-DQA1等位基因的相关性. 世界华人消化杂志 2006; 14(4): 442-445
Revised: December 25, 2005
Accepted: December 31, 2005
Published online: February 8, 2006
AIM: To find the susceptible or resistant genes of H. pyloriinfection in Bai-ethnic children of Kunming, and to explore the immunogenetic mechanism of H. pyloriinfection.
METHODS: Polymerase chain reaction-sequence specific primers (PCR-SSP) technique was used to detect the allelic distribution of HLA-DQA1 in Bai-ethnic children with or without H. pyloriinfection (n = 32, 34, respectively) from Kunming. H. pyloriinfection was identified by combination of dot-immunogold filtration assay and immunobloting technique.
RESULTS: The allelic frequency of HLA-DQA1 *010401 or *0402 was significantly lower in children with H. pyloriinfection than that in children without H. pyloriinfection (0 vs 15%, χ2 = 0, P = 0.001, P = 0.014, OR = 1.172, 95%CI: 1.062-1.294).
CONCLUSION: HLA-DQA1*010401 or *0402 may be resistant gene of H. pyloriinfection in Bai-ethnic children from Kunming.
- Citation: Wang MF, Huang YK, Hao P, Qi Q, Wen GS, Li HL, Zhou LF. Association between HLA-DQA1 alleles and H. pyloriinfection in Bai-ethnic children from Kunming. Shijie Huaren Xiaohua Zazhi 2006; 14(4): 442-445
- URL: https://www.wjgnet.com/1009-3079/full/v14/i4/442.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i4.442
幽门螺杆菌(Helicobacter pylori, H. pylori)是世界各地最常见的感染性疾病病原之一, 全球约有50%人口感染了H. pylori. 儿童又是H. pylori感染的易感人群, 但是H. pylori感染后大多数无临床症状, 仅极少数表现出明显的临床疾病症状. 具体的机制尚不清楚, 许多研究认为这种临床结局的差异除与细菌毒力的高低、环境有关外, 部分可从宿主因素特别是人类白细胞抗原(HLA)免疫反应基因多态性上得到解释[1-2], 即宿主遗传因素可以影响对感染的免疫炎性反应. 而HLA-DQAl属于经典的HLA Ⅱ类基因DQ亚区. 近年来, 国内外对人类白细胞抗原的免疫分析显示, HLA-DQAl等位基因分布对H. pylori感染具有抵抗或易感作用并与临床结局有一定关系, 并在不同种族、民族与地域间存在较大差异[3-9]. 我们应用先进和成熟的HLA DNA基因分型技术-聚合酶链反应序列特异性引物(PCR-sequence specifiprimers, SSP)对32例H. pylori阳性及34例H. pylori阴性的昆明白族儿童HLA-DQAl等位基因位点进行检测分析, 以探讨昆明白族儿童HLA-DQAl位点上是否存在H. pylori感染的易感基因或抵抗基因, 了解宿主的免疫遗传差异性.
2003-07采用整群抽样方法, 将昆明市某民族小学8-12岁双亲3代均为白族的141例学龄儿童列为研究对象, 且每个研究对象必须符合以下条件: (1)在当地出生且生活4年以上; (2)无严重的心、肺、脑、肾、皮肤、营养、内分泌疾病及免疫缺陷病史; (3)近4wk内无抗生素、铋剂、质子泵阻滞剂和激素使用史.
1.2.1 资料的收集: 征得家长的同意每位儿童采取外周静脉血2 mL于EDTA抗凝管中分离血浆与细胞, 并放置于-70℃冰箱中保存.
1.2.2 H. pylori感染的相关检测: 采用金标免疫渗滤法检测141例昆明白族儿童血浆H. pylori-IgG抗体(试剂盒由福建省蓝波生物技术研究有限公司提供, 批号: 200304016); 根据H. pylori-IgG抗体检测结果将儿童分为H. pylori-IgG抗体阳性组(51例)和H. pylori-IgG抗体阴性组(90例), 从以上两组中各抽起40例儿童血浆采用免疫印迹法进行H. pylori空泡毒素(CagA)、毒素相关蛋白抗体(VacA)、尿素酶A及B抗体(UreA、 UreB)检测(试剂盒由深圳市伯劳特生物技术研究有限公司提供, 批号: 20050519). 结果判读严格按说明书操作. 若两种方法均为阳性者诊断为H. pylori感染, 列为实验组(32例), 两者均为阴性者诊断为非H. pylori感染, 列为对照组(34例), 实验组的平均年龄为9.98±1.54岁, 男女之比1︰1.45, 对照组平均年龄为9.89±1.34岁, 男女之比1︰0.56, 两组年龄、性别无差异性(P>0.05). H. pylori感染的诊断标准: 根据1999-04召开的全国第1次H. pylori专家共识会议上提出的H. pylori流行病学诊断标准[10].
1.2.3 血液基因组DNA制备: 采用血液基因组DNA提取试剂盒(由美国Promega公司提供, 批号 204337), 在常温下快速提起实验组和对照组儿童基因组DNA. 提取方法严格按试剂盒所附说明进行. 提取的DNA用分光光度仪测定浓度和纯度. 纯度应在1.6-1.8之间, 浓度不低于60 mg/L, 提取的DNA放置于-20℃冰箱保存备用.
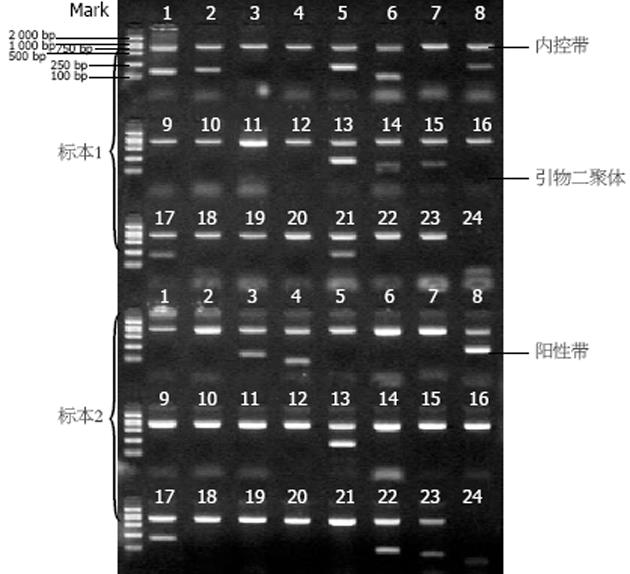
1.2.4 HLA-DQA1基因分型: 采用美国HLA-DQA1 SSP Unitray基因分型试剂盒扩增HLA-DQA1基因片段(试剂盒由美国PEL-FREEZE CLINICAL SYSTEMS公司提供, 批号: 003-17283)PCR反应体系为23 µL, 扩增程序表1所示: 扩增产物进行含20 g/L溴乙锭的琼脂糖凝胶电泳(条件为150 V, 12 min), 结果判断借助其提供的专用读板纸在凝胶成像仪和紫外灯判读并成像. 要求: 除污染对照外, 其他各电泳道内控带必须存在, 各阳性条带必须与规定的相应分子量对应(图1). 全图共48个泳道, 内控带的分子量为796 bp, 标本1和标本2的第24泳道为污染控制孔, Mark: 由下到上分别是100 bp、250 bp、500 bp、750 bp、1 000 bp、2 000 bp.
| 循环数 | 步骤 | 温度(℃) | 时间(秒) |
| 1 | 1 | 96 | 60 |
| 5 | 1 | 96 | 25 |
| 2 | 70 | 50 | |
| 3 | 72 | 45 | |
| 21 | 1 | 96 | 25 |
| 2 | 65 | 50 | |
| 3 | 72 | 45 | |
| 21 | 1 | 96 | 25 |
| 2 | 65 | 50 | |
| 3 | 72 | 45 | |
| 4 | 1 | 96 | 25 |
| 2 | 55 | 60 | |
| 3 | 72 | 120 | |
| Hold | 1 | 12 | Forever |
统计学处理 用直接法统计实验组和对照组HLA- DQA1各等位基因的基因频率. 样本分布经过Hard- Weinberg平衡检验, P>0.05, 组间HLA- DQA1等位基因的比较用2×2表χ2检验. P值经等位基因多项比较校正(同一位点需比较的等位基因数乘P值, 即PC)
实验组和对照组HLA- DQA1基因位点共检出14种等位基因, 两组等位基因频率(AF)比较(表2). 如表2显示实验组白族儿童HLA-DQA1*010401或*0402等位基因频率较对照组低(0 vs 15%, χ2 = 0, P = 0.001, Pc = 0.014 , OR = 1.172, 95%CI= 1.062-1.294).
| HLA-DQA1等位基因 | 实验组n = 64 | 对照组n = 68 | χ2 | P | P | ||
| n | AF(%) | n | AF(%) | ||||
| *0101 | 2 | 3 | 1 | 1 | 0.406 | 0.524 | - |
| *010 | 9 | 14 | 9 | 13 | 0.019 | 0.089 | - |
| *0103 | 9 | 14 | 6 | 9 | 0.898 | 0.343 | - |
| *010401/0402 | 0 | 0 | 10 | 15 | 0 | 0.001 | 0.014 |
| *0201 | 4 | 6 | 5 | 7 | 0.063 | 0.802 | - |
| *030101 | 6 | 9 | 2 | 3 | 2.397 | 0.122 | - |
| *0302 | 11 | 17 | 5 | 7 | 2.994 | 0.084 | - |
| *0303 | 6 | 9 | 9 | 14 | 0.488 | 0.485 | - |
| *040101 | 3 | 4 | 5 | 7 | 0.411 | 0.521 | - |
| *040102 | 1 | 1 | 0 | 0 | 0 | 0.485 | - |
| *050101 | 2 | 3 | 1 | 1 | 0.406 | 0.524 | - |
| *0503 | 0 | 0 | 1 | 1 | 0 | 1 | - |
| *0505 | 2 | 3 | 3 | 4 | 0.150 | 0.699 | - |
| *060101 | 9 | 14 | 11 | 16 | 0.115 | 0.735 | - |
HLA抗原系统即主要组织相容性复合物, 全长约4 000 kb,由一群密切连锁的基因组成, 包括100多个基因座共554个等位基因,是目前所知人类基因组中最复杂、最具多态性的遗传体系, 他不仅具有个体差异而且还有不同民族的差异. 他分位三类基因, 从着丝点一侧起, 依次为Ⅱ类基因、Ⅲ类基因和Ⅰ类基因区域所在.Ⅱ类基因区又称HLA D区, 长约1 100 kb, 分为DR、DQ、DP、DO、DN、DM等亚区, 其多态性决定于第二外显子区域DNA核苷酸序列. 而HLA- DQA基因属DQ区, 编码α1链的则为DQA1基因, 其基因序列已被克隆、测序, 定位于6p21.3.HLA分子具有递呈抗原、参与细胞分化、调节免疫应答、诱导同种免疫应答等作用.
HLA的DNA分型方法很多, 各有其特点. 目前常用的方法大致可分为五大类: (1)限制性片段长度多态性分析(PCR-RLFP); (2)聚合酶链式反应寡核苷酸探针杂交方法(PCR-SS0); (3)聚合酶链式反应单链构象多态性分析(PCR-SSCP); (4)DNA序列测定(sequencing); (5)序列特异性引物聚合酶链反应技术(PCR-SSP).
我们采用了PCR-SSP技术对昆明白族儿童实验组和对照组进行HLA-DQA1基因分型, 我们发现在实验组中HLA-DQAI*010401或*0402等位基因的频率明显比对照组低(0 vs 15%,χ2 = 0, P = 0.001, Pc = 0.014 , OR = 1.172, 95%CI= 1.062-1.294)提示该基因在昆明白族儿童中可能为H. pylori感染的抵抗基因, 具有免疫抵抗作用,当其频率降低时, 容易发生H. pylori感染.
目前, HLA基因与H. pylori感染的易感性问题, 国内外学者针对了不同背景人群的研究报道, 黄永坤et al[5-6]分别对昆明汉族、彝族儿童H. pylori感染HLA-DQA1免疫遗传学特征分析发现, HLA-DQA1*0103基因可能是昆明汉族儿童H. pylori感染的易感基因, HLA-DQA1*0302基因可能是昆明彝族儿童抵抗H. pylori感染的保护基因; Wang et al[7]对广西壮族、仫佬族和越南中部京族儿童H. pylori感染与HLA-DQA1相关性的研究发现, 三个民族中H. pylori阳性组的HLA-DQA1*0104基因高于H. pylori阴性组, DQA1*0104可能是H. pylori感染的易感基因, 即携带有DQA1*0104基因者易发生H. pylori感染. 但也有国外学者认为, HLA-DQA1等位基因与H. pylori感染无关[11-14]. 这些不同的结果是否提示HLA基因多态性与H. pylori致病性无必然性联系, 还是提示HLA基因多态性与H. pylori致病性的联系具有种族特异性, 需要进一步进行广泛研究.
我们的研究结果与国内外报道不完全相同甚至相反, 我们分析认为, 首先可能与HLA的多态性在不同的种族、地区人群中差别有关; 其次, H. pylori感染的致病机制是多方面的, 仅就免疫因素而言,可能也是多相关基因所致,可能QR、DP的某些基因座位也起了一定的作用; 第三, 由于某些HLA等位基因频率较低, 故样本量过小而造成实验误差. 因此, 有必要扩大样本量并在多个不同种族、不同人群、不同区域进行深入的研究.
感谢昆明医学院第一附属医院临床医学实验中心免疫遗传室的唐睿珠、邵文萍、包群在实验中给与的指导和大力支持.
H. pylori感染与慢性胃炎、消化道溃疡和胃癌等密切相关, 而这些疾病的发生与宿主的免疫遗传因素可能有关. 研究H. pylori感染与患儿的HLA-DQA1等位基因位多态性的相关性, 寻找与H. pylori感染相关的基因, 有助于今后采取可行的免疫防治策略.
本文通过对HLADQA1基因分型检测, 发现HLADQA1*010401或*0402基因可能对H. pylori感染具有免疫抵抗作用.
该研究采用分子生物学的方法证实了昆明白族儿童H. pylori感染与非H. pylori感染者相比H L ADQA1*010401或*0402基因频率明显降低. 提示: 在HLA-DQA1以上两位点, H. pylori感染白族儿童与非感染儿童可能存在免疫遗传学差异. 该结果对阐述少数民族儿童H. pylori感染机制提供了实验依据.
电编: 张勇 编辑:菅鑫妍 审读:张海宁
| 1. | Reimer P, Fischbach W, Goebeler ME, Kraus MR, Goldmann S, Muller C, Wilhelm M. Decreased frequency of HLA-B35 in patients with gastric MALT lymphoma. Ann Hematol. 2004;83:232-236. [PubMed] [DOI] |
| 2. | Gonzalez CA, Sala N, Capella G. Genetic susceptibility and gastric cancer risk. Int J Cancer. 2002;100:249-2603. [PubMed] [DOI] |
| 4. | Garza-Gonzalez E, Bosques-Padilla FJ, Perez-Perez GI, Flores-Gutierrez JP, Tijerina-Menchaca R. Association of gastric cancer, HLA-DQA1, and infection with Helicobacter pylori CagA+ and VacA+ in a Mexican population. J Gastroenterol. 2004;39:1138-1142. [PubMed] [DOI] |
| 7. | Wang LL, Tran DB, Lin WX, Jiang HX, Shan QW, Xie XZ, Liang DM. Association of HLA-DQA1 loci with Helicobacter pylori infection in children of Guangxi Zhuang, Mulam nationalities, China and central Jing nationality, Vietnam. Zhonghua ErKe ZaZhi. 2004;42:577-580. [PubMed] |
| 8. | Magnusson PKE, Enroth H, Eriksson I, Held M, Nyren O, Engstrand L, Hansson E, Gyllensten UB. Gastric cancer and human leukocyte antigen: distinct DQ and DR alleles are associated with development of gastric cancer and infection by Helicobacter pylori. Cancer Research. 2001;61:2684-2689. [PubMed] |
| 9. | Kawahara Y, Mizuno M, Yoshino T, Yokota K, Oguma K, Okada H, Fujiki S, Shiratori Y. HLA-DQA1*0103-DQB1*0601 haplotype and Helicobacter pylori-positive gastric mucosa-associated lymphoid tissue lymphoma. Clin Gastroenterol Hepatol. 2005;3:865-868. [PubMed] [DOI] |
| 11. | Perri F, Piepoli A, Quitadamo M, Quarticelli M, MerlaA , Bisceglia M. HLA-DQA1 and - DQB1 genes and Helicobacter pylori infection in Italian patients with gastric adenocarcinoma. Tissue Antigens. 2002;59:55-57. [PubMed] [DOI] |
| 12. | Kunstmann E, Hardt C, Crabtree JE, Suerbaum S, Epplen JT. Helicobacter pylori infection: CagA-specific antibodies are associated with clinical outcome, but not with HLA classⅡpolymorphisms of the host. Int J Med Microbiol. 2003;292:537-540. [PubMed] [DOI] |
| 13. | Kunstmann E, Hardt C, Treitz H, Suerbaum S, Faller G, Peitz U, Schmiegel W, Epplen JT. In the European population HLA-class Ⅱ genes are not associated with Helicobacter pylori infection. Eur J Gastroenterol Hepatol. 2002;14:49-53. [PubMed] |
| 14. | Quintero E, Pizarro MA, Rodrigo L, Pique JM, Lanas A, Ponce J, Mino G, Gisbert J, Jurado A, Herrero MJ. Association of Helicobacter pylori-related distal gastric cancer with the HLA classⅡgene DQB10602 and cagA strains in a southern European population. Helicobacter. 2005;10:12-21. [PubMed] [DOI] |