修回日期: 2005-12-15
接受日期: 2005-12-19
在线出版日期: 2006-02-08
目的: 观察重症急性胰腺炎(SAP)大鼠白血病抑制因子(LIF)在肺组织中表达的时相变化, 探讨LIF在SAP病程及肺损伤中的意义.
方法: 36只雄性SD大鼠随机分为正常对照组(N组, n = 6)、假手术组(Sham组, n = 6)和重症急性胰腺炎组(SAP组, n = 24). 采用胰管逆行灌注50 g/L牛磺胆酸钠的方法复制大鼠SAP模型. 用RT-PCR法检测肺组织中LIF mRNA的表达水平, 免疫组织化学方法检测LIF在肺组织中的表达变化.
结果: SAP组3 h后肺组织LIF mRNA的表达量明显高于对照组和假手术组(灰度值: 1.018±0.065 vs 1.451±0.067, 1.322±0.072, P<0.05),并且6, 12, 24 h持续升高(0.853±0.058, 0.635±0.064, 0.582±0.089)(P<0.01). 同样, SAP组LIF蛋白表达在3和6 h后明显高于对照组和假手术(127.36±2.76, 122.53±2.43 vs 159.46±2.78, 156.35±3.12, P<0.05), 并且12, 24 h后也维持在很高的水平(109.37±2.87, 102.42±2.27).
结论: LIF作为促炎症因子参与了SAP肺组织的炎症反应.
引文著录: 滕晓丽, 赵秋, 杜静, 谷华, 覃华. 重症急性胰腺炎大鼠肺组织中LIF的表达变化及意义. 世界华人消化杂志 2006; 14(4): 438-441
Revised: December 15, 2005
Accepted: December 19, 2005
Published online: February 8, 2006
AIM: To observe the levels of leukemia inhibitory factor (LIF) in the pulmonary tissues in rats with severe acute pancreatitis (SAP), and to investigate the role of LIF in the progression of SAP and lung injury.
METHODS: Thirty-six male Sprague Dawley rats were randomly divided into three groups: normal control (n = 6), sham operation (n = 6), and SAP (n = 24) group. SAP model was induced by retrograde injection of 50 g/L sodium taurocholate into the pancreatobiliary duct. The expression of pulmonary LIF mRNA was detected by semi-quantitative reverse transcription polymerase chain reaction (RT-PCR), and the expression of LIF protein was detected by immunohistochemistry.
RESULTS: The level of pulmonary LIF mRNA expression was increased significantly in SAP group at 3 h in comparison with that in normal control and sham operation group (grey value: 1.018 ± 0.065 vs 1.451 ± 0.067, 1.322 ± 0.072, both P < 0.05), and maintained at high levels up to 24 h after modeling (0.853 ± 0.058, 0.635 ± 0.064, 0.582 ± 0.089 for 6, 12, and 24 h, respectively, P < 0.01). Similarly, the expression of pulmonary LIF protein was also markedly increased in SAP group 3 and 6 h after modeling as compared with that in normal and sham operation group (grey value: 127.36 ± 2.76, 122.53 ± 2.43 vs 159.46 ± 2.78, 156.35 ± 3.12, all P < 0.05), and maintained at high levels at 12 and 24 h (109.37 ± 2.87, 102.42 ± 2.27, respectively)(P < 0.01).
CONCLUSION: LIF acts as a proinflammatory mediator in SAP.
- Citation: Teng XL, Zhao Q, Du J, Gu H, Qin H. Role of leukemia inhibitory factor on lung injury in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2006; 14(4): 438-441
- URL: https://www.wjgnet.com/1009-3079/full/v14/i4/438.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i4.438
重症急性胰腺炎(SAP)是一种严重的全身性疾病, 死亡率高达20%-30%. 急性肺损伤是SAP最常见且严重的并发症, 其发病机制尚未完全阐明. 近年许多研究表明是由多种促炎细胞因子(TNF, IL-1, IL-6, NO, 血小板活化因子等)介导的全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)引起的.
白血病抑制因子(LIF)是白介素-6(IL-6)家族中的一个多功能细胞因子, 因其能抑制鼠M1白血病细胞克隆生长和促进其分化而得名. 近年来有报道称LIF作为一种促炎症细胞因子参与了炎症反应, 然而, 目前关于LIF在SAP肺损伤发病机制中的作用尚未见报道. 为此, 我们通过对实验性SAP肺组织LIF mRNA的研究, 探讨LIF在SAP肺损伤发病机制中的作用.
♂SD大鼠36只, 清洁级, 180-220 g, 由华中科技大学同济医学院实验动物学部提供. 动物以10 g/L戊巴比妥钠(35 mg/kg)腹腔内注射麻醉. 经腹正中切口进腹, 用一号丝线结扎近肝门处胆管, 将带有四号针头的1 mL注射器穿刺距离胆胰管开口0.3-0.4 cm处的胆管, 注入50 g/L牛磺胆酸钠(Sigma公司)生理盐水溶液1 mL/kg, 速度为2 mL/min. 停留4 min, 去除结扎线, 逐层关腹. 对照组仅牵引胰腺和十二指肠后关腹. 术毕, 皮下注射生理盐水4 mL/100 g, 6 h.
随机将大鼠分为3组: 正常对照组(N组, n = 6)麻醉动物后取材; 假手术组(Sham组, n = 6)麻醉后开腹轻揉胰腺, 取材; 重症急性胰腺炎组(SAP组, n = 24): 分为建模后3, 6, 12, 24 h共4个亚组, 各时点麻醉动物后取材.
于上述时点用戊巴比妥钠麻醉动物, 开腹后取出肺组织. 肺组织标本, 均沿纵向剖开取材, 经100 g/L中性福尔马林固定后, 石蜡包埋制成组织蜡块. 将石蜡包埋好的组织块, 制成4-5 μm 厚的连续切片, 置于60℃烘箱内烘烤6 h以上备用.
1.2.1 肺组织LIF抗体检测: 采用免疫组化染色(SP法). LIF兔抗鼠多克隆抗体购自武汉博士德生物工程有限公司. SP试剂盒和DAB试剂盒购自北京中杉金桥生物技术有限公司. 操作步骤为: 按有关试剂的产品说明书进行操作. 脱蜡、水化, 滴加30 g/L H2O2 50 μL, 38℃ 15 min, 抗原修复液中95℃ 15 min, 依次滴加正常山羊血清封闭液30 min, 一抗40 μL 4℃过夜, 二抗37℃ 30 min, 酶标三抗37℃ 30 min. 每步骤后均用缓冲液PBS洗涤5 min×3次, DAB显色, 苏木素复染, 干燥, 中性树胶封片. 阳性细胞为胞质染色呈棕黄色. 用TC21000数据图像分析系统进行图像分析, 每组6只动物各取一张切片, 白色为0, 黑色为255, 测出积分光密度和平均光密度, 进行统计学处理.
1.2.2 肺组织中LIF mRNA的表达用RT-PCR检测: 采用Trizol(MRC公司)一步法提取肺组织总RNA, 紫外分光光度仪测定RNA浓度. M-MLV逆转录酶试剂(Promega公司), Taq DNA聚合酶(MBI公司), ECL发光试剂(Pierce公司), 梯度PCR仪(Backman 公司). 互补DNA(cDNA)的合成采用2 μL M-MuLV逆转录酶反应体系, 42℃反应1 h. LIF引物: 正义5'-GTCAACTGGCTCAACTCAACG-3', 反义5'-CTGGCAGCCCAACTTCTTC-3', 扩增片段长度406 bp. β-actin引物: 正义5'-CTTTTGTGCCTTGATAGTTC-3', 反义5'-GAGTCCTTCTGACCCATAC-3', 扩增片段长度265 bp. 引物由上海生工生物技术公司合成. PCR反应条件: 94℃ 5 min, 94℃ 45 s, 55℃ 45 s, 72℃ 1 min, 30个循环. 取7 μL PCR反应产物加1 μL 10×loading buffer在15 g/L琼脂糖凝胶上电泳(110 V, 30 min), 紫外透射仪观察, 并用UVP紫外凝胶图像分析仪摄影记录. 用TC21000数据图像分析系统分析各条带灰度值, 得LIF/β-actin的灰度比值, 即为LIF mRNA的相对表达值.
统计学处理 采用SPSS 11.0分析, 数据均采用mean±SD表示, 根据实验要求采用t检验, 方差分析进行数据分析, P<0.05认为有显著统计学意义.
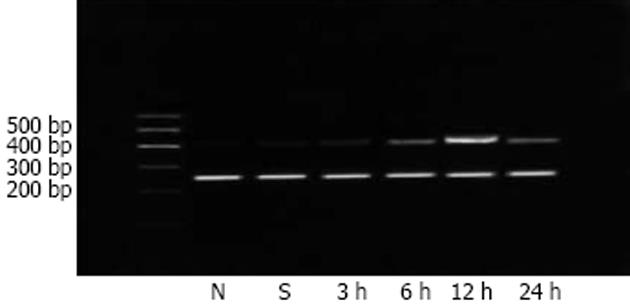
通过RT-PCR检测, 经琼脂糖凝胶电泳后, LIF与β-actin基因的RT-PCR产物与理论长度相一致, 正常组、假手术组均未见明显的LIF表达, 建模3, 6, 12, 24 h组均能检测到LIF的表达, 其中以12 h组为最明显(图1). 我们用LIF/β-actin的灰度比值作为LIF基因的相对表达值, 各组LIF mRNA的相对表达见表1, 3 h组起, 与N组和Sham组比较有显著性差异(P<0.05), 6 h组起, 与N组和SAP组比较有极显著性差异(P<0.01). 各组内参β-actin基因的RT-PCR产物在265 bp附近. LIF基因的RT-PCR产物在406 bp附近, N组和Sham组几乎不见LIF基因的RT-PCR产物, 12 h组及24 h组则表达明显.
急性胰腺炎(AP)是临床常见的急腹症, 除有局部的病理损伤表现外常伴有明显的全身炎症反应, 甚至并发多器官损伤, 病死率很高. 急性肺损伤是SAP最常见的并发症, 并与高死亡率有关[1,2]. 多种促炎细胞因子(TNF, IL-1, IL-6, NO, 血小板活化因子)等参与的炎症反应是SAP发病的机制之一[3]. 细胞因子可以通过"扳机样作用"触发炎症介质的"瀑布样级联反应", 使得AP易于从局部病变迅速发展成为全身性炎症性反应综合征和多器官功能衰竭(MOF). TNF是炎症早期一过性释放的致炎因子[4], 针对炎症早期的TNF和其他致炎因子的拮抗剂有一定的疗效, 但对于炎症后期所引起的脓毒症却无能为力. 许多研究发现确实存在着一种感染后期的炎症介导因子[3].
白血病抑制因子(LIF)是一个多功能的细胞因子, 属于细胞因子IL-6家族, 能促进细胞的生长、分化, 调节钙和骨骼的新陈代谢, 介导急性期蛋白和肿瘤机体的恶病质的产生[4]. 已在活化的T细胞、单核细胞、神经胶质细胞、肝成纤维细胞、骨髓基质细胞、胚胎干细胞、胸腺上皮细胞等多种细胞中发现有LIF的表达[5]. 正常情况下组织和外周血循环中LIF的表达量极低[6], 许多证据表明, 炎症介质IL-1, IL-6, IL-17, TNF-α以及脂多糖(LPS)等可诱导LIF基因表达[7], 抗炎症物质可抑制LIF基因的表达, 例如: 糖皮质激素、IL-4和IL-13[7,8]. 这些促炎物质可能是通过活化第二信使蛋白激酶(PKC)而刺激细胞产生LIF[9]. LIF在正常成年大鼠体内有极低水平的表达, 在炎症反应中表达升高[6,10].
Lankisch et al[11]对死于AP的36例患者进行了深入的研究, 发现肺组织学的改变与成人呼吸窘迫综合征(ARDS)一样. Jorens et al[12]证实在ARDS患者的支气管肺泡灌洗液中LIF表达增高, 他提出LIF是ARDS中炎症细胞因子级联中的一员, 但LIF在炎症反应中是作为抗炎因子还是促炎因子仍不清楚. LIF可能在一些动物炎症模型中起到了保护的作用. 他通过下调TNF的表达来下调诸如LPS引起的急性肺部炎症[13]. 而且, 有报道称LIF可以轻微的保护肺部抵抗氧化毒性[14,15].
现已证实肺组织结构细胞可表达LIF和LIFR, 而且IL-1β和IL-6可以诱导肺组织LIF释放, 其中以成纤维细胞表达LIF水平最高, 气道平滑肌细胞和肺动脉平滑肌细胞也可检测到高水平的LIF基因表达, 支气管上皮细胞表达水平较低[16]. Fujii et al[17]和Elias et al[18]也发现直径小于10 μm的空气污染微粒(PM10)可诱导人支气管上皮细胞表达LIF, IL-1, TGF-b和呼吸道合胞病毒(RSV)可刺激气道平滑肌细胞产生IL-11及其他IL-6家族细胞因子(IL-6和LIF). 此外, 嗜酸粒细胞、肥大细胞、T细胞等炎症细胞也可表达、合成并释放LIF[19,20].
在本实验中, LIF在建模后开始上升, 到12 h有较高的表达, 至24 h仍维持在较高的水平. SAP大鼠肺组织LIF水平的时相变化以及其作为炎症介质的能力说明他可能作为炎症介质参与了SAP的全身炎症反应. 他可能是早期炎症因子TNF-a和IL-1b的下游因子, 因为有研究显示, TNF-a和IL-1b都可单独刺激活化的T细胞合成并释放LIF[7,9]. 体外实验证明, LIF可明显增强嗜酸粒细胞对血小板活化因子(PAF)和P物质的迁移反应, 诱导嗜酸粒细胞释放颗粒蛋白, 表达活性标记物CD69[19], 诱导各种细胞产生促炎症细胞因子, 刺激趋化因子合成[21].
LIF可能作为晚期炎症因子参与了SAP的晚期炎症反应, 通过各种途径下调LIF水平或拮抗其作用可能在SAP的炎症调控中具有重要意义. LIF作为晚期炎症介质将成为治疗的新的有希望的靶点.
重症急性胰腺炎(SAP)是一种严重的全身性疾病, 死亡率高达20%-30%. 急性肺损伤是SAP最常见且严重的并发症, 其发病机制尚未完全阐明. 近年来有报道称LIF作为一种促炎症细胞因子参与了炎症反应, 然而, 目前关于LIF在SAP肺损伤发病机制中的作用尚未见报道. 为此, 我们通过对实验性SAP肺组织LIFmRNA的研究, 探讨LIF在SAP肺损伤发病机制中的作用.
LIF是新近认识的白介素家族中的一个多功能细胞因子, 学术界对LIF的研究主要集中在生殖、免疫和神经方面, 在炎症反应中的研究较少. 细胞因子是目前研究重症急性胰腺炎发病机制的热点, 尤其是后期致炎因子的研究. 本实验就此建立动物模型深入探讨LIF在SAP发病机制中的作用.
本研究只检测了LIF一种因子在肺组织中的表达变化, 反映了一定的问题, 但不足以证实这种变化的机制. 讨论条理分明,结论中肯.
电编: 张敏 编辑:菅鑫妍 审读:张海宁
| 1. | Steer ML. Relationship between pancreatitis and lung diseases. Respir Physiol. 2001;128:13-16. [PubMed] [DOI] |
| 2. | Shields CJ, Winter DC, R5 Hisaka T, Desmouliere A, Taupin JL, Daburonedmond HP. Lung injury in acute pancreatitis: mechanisms, prevention, and therapy. Curr Opin Crit Care. 2002;8:158-163. [PubMed] [DOI] |
| 3. | Gomez-Cambronero LG, Sabater L, Pereda J, Cass-inello N, Camps B, Vina J, Sastre J. Role of cytokines and oxidative stress in the pathophysiology of acute pancreatitis: therapeutical implications. Curr Drug Targets Inflamm Allergy. 2002;1:393-403. [PubMed] [DOI] |
| 4. | Szepietowski J, Reich A. Leukaemia inhibitory fact-or (LIF): structure and biological activity. Postepy Hig Med Dosw (Online). 2004;58:243-251. [PubMed] |
| 5. | Neaud V, Senant N, Blanc JF, Moreau JF, Rosenbaum J. Expression of leukemia inhibitory factor (LIF) and its receptor gp190 in human liver and in cultured human liver myofibroblasts. Clon-ing of new isoforms of LIF mRNA. Comp Hepatol. 2004;3:10. [PubMed] |
| 6. | Brown MA, Metcalf D, Gough NM. Leukaemia inhibitory factor and interleukin 6 are expressed at very low levels in the normal adult mouse and are induced by inflammation. Cytokine. 1994;6:300-309. [PubMed] [DOI] |
| 7. | Chabaud M, Fossiez F, Taupin JL, Miossec P. Enhancing effect of IL-17 on IL-1-induced IL-6 and leukemia inhibitory factor production by rheumato-id arthritis synoviocytes and its regulation by Th2 cytokines. J Immunol. 1998;161:409-414. [PubMed] |
| 8. | Grosset C, Taupin JL, Lemercier C, Moreau JF, Reiffers J, Ripoche J. Leukaemia inhibitory factor expression is inhibited by glucocorticoids through post-transcriptional mechanisms. Cytokine. 1999;11:29-36. [PubMed] [DOI] |
| 9. | Hershko DD, Robb BW, Luo G, Hasselgren PO. Multiple transcription factors regulating the IL-6 gene are activated by cAMP in cultured Caco-2 cells. Am J Physiol Regul Integr Comp Physiol. 2002;283:R1140-R1148. [PubMed] [DOI] |
| 10. | Kerr BJ, Patterson PH. Potent pro-inflammatory actions of leukemia inhibitory factor in the spinal cord of the adult mouse. Exp Neurol. 2004;188:391-407. [PubMed] [DOI] |
| 11. | Lankisch PG, Rahlf G, Koop H. Pulmonary comp-lications in fatal acute hemorrhagic pancreatitis. Dig Dis Sci. 1983;28:110-116. [PubMed] [DOI] |
| 12. | Jorens PG, De Jongh R, Bossaert LL, De Backer W, Herman AG, Pollet H, Bosmans E, Taupin JL, Moreau JF. High levels of leukaemia inhibitory factor in ARDS. Cytokine. 1996;8:873-876. [PubMed] [DOI] |
| 13. | Ulich TR, Fann MJ, Patterson PH, Williams JH, Samal B, Del Castillo J, Yin S, Guo K, Remick DG. Intratracheal injection of LPS and cytokines. V. LPS induces expression of LIF and LIF inhibits acute inflammation. Am J Physiol. 1994;267:L442-L446. [PubMed] |
| 14. | Weber MA, Schnyder-Candrian S, Schnyder B, Quesniaux V, Poli V, Stewart CL, Ryffel B. Endog-enous leukemia inhibitory factor attenuates endoto-xin response. Lab Invest. 2005;85:276-284. [PubMed] [DOI] |
| 15. | Wang J, Chen Q, Corne J, Zhu Z, Lee CG, Bhandari V, Homer RJ, Elias JA. Pulmonary expression of leukemia inhibitory factor induces B cell hyperpla-sia and confers protection in hyperoxia. J Biol Chem. 2003;278:31226-31232. [PubMed] [DOI] |
| 16. | Loewen GM, Tracy E, Blanchard F, Tan D, Yu J, Raza S, Matsui S, Baumann H. Transformation of human bronchial epithelial cells alters responsi-veness to inflammatory cytokines. BMC Cancer. 2005;5:145. [PubMed] [DOI] |
| 17. | Fujii T, Hayashi S, Hogg JC, Vincent R, Van Eeden SF. Particulate matter induces cytokine expression in human bronchial epithelial cells. Am J Respir Cell Mol Biol. 2001;25:265-271. [PubMed] [DOI] |
| 18. | Elias JA, Wu Y, Zheng T, Panettieri R. Cytokine- and virus-stimulated airway smooth muscle cells produce IL-11 and other IL-6-type cytokines. Am J Physiol. 1997;273:L648-L655. [PubMed] |
| 19. | Zheng X, Knight DA, Zhou D, Weir T, Peacock C, Schellenberg RR, Bai TR. Leukemia inhibitory factor is synthesized and released by human eosinophils and modulates activation state and chemotaxis. J Allergy Clin Immunol. 1999;104:136-144. [PubMed] [DOI] |
| 20. | Piccinni MP, Scaletti C, Mavilia C, Lazzeri E, Romagnani P, Natali I, Pellegrini S, Livi C, Romag-nani S, Maggi E. Production of IL-4 and leukem-ia inhibitory factor by T cells of the cumulus oopho-rus: a favorable microenvironment for pre-implantation embryo development. Eur J Immunol. 2001;31:2431-2437. [PubMed] [DOI] |
| 21. | Tofaris GK, Patterson PH, Jessen KR, Mirsky R. Denervated Schwann cells attract macrophages by secretion of leukemia inhibitory factor (LIF) and monocyte chemoattractant protein-1 in a process regulated by interleukin-6 and LIF. J Neurosci. 2002;22:6696-6703. [PubMed] |