修回日期: 2005-12-05
接受日期: 2005-12-19
在线出版日期: 2006-02-08
目的: 研究趋化性细胞因子巨噬细胞炎症蛋白-1α(macrophage inflammation protein-1α, MIP-1α)在外周血中快速动员树突状细胞(DC)前体细胞, 并荷载小鼠前胃癌(MFC)抗原后, 其体内的抗肿瘤免疫效应.
方法: B6小鼠尾静脉注射MIP-1α, 分选出外周血B220-CD11c+细胞, 以GM-CSF、IL-4及 mTNF-α培养5-6 d, 检测其表型和混合淋巴细胞反应; B220-CD11c+细胞荷载MFC抗原后制备成DC疫苗, 经皮下回输MFC荷瘤小鼠, 观察小鼠瘤体生长和存活时间, 检测其体内抗肿瘤效应. 未荷载肿瘤抗原的MIP-1α动员的胃癌DC疫苗、MFC肿瘤可溶性抗原和PBS缓冲液作为对照.
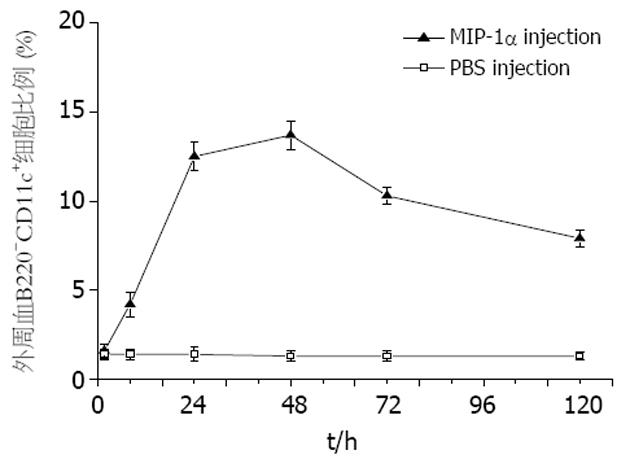
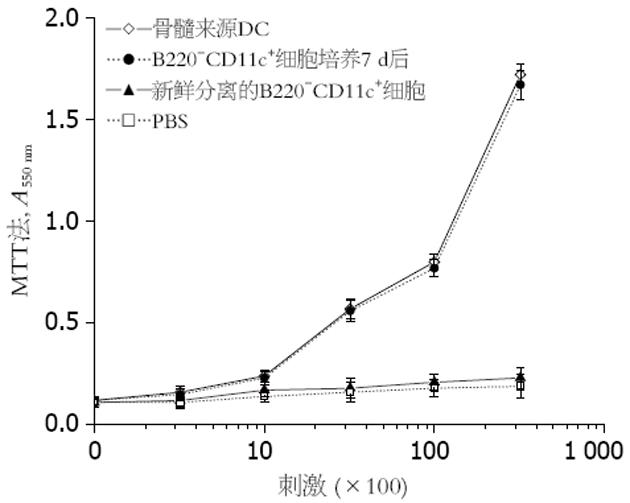
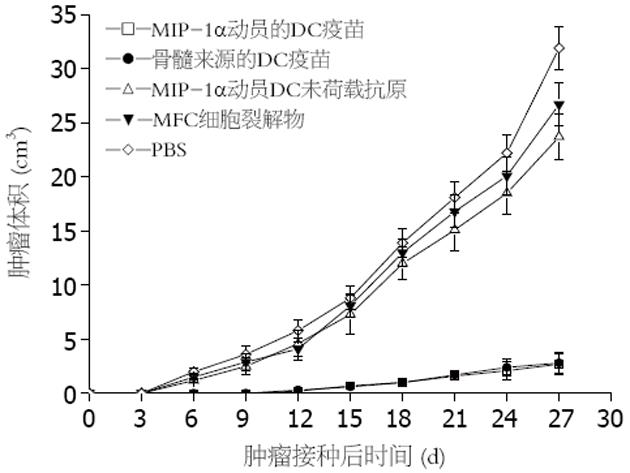
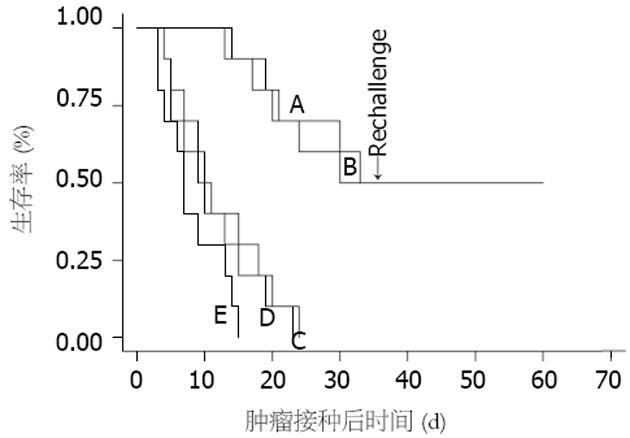
结果: MIP-1α注射B6小鼠4 h后外周血中B220-CD11c+细胞即升高, 48 h达到高峰, 占外周血单个核细胞(MNC)13.7%±0.8%. 新鲜分离的B220-CD11c+细胞不具有成熟DC的特征, 经过细胞因子培养的B220-CD11c+细胞具有典型的DC表面标志, 在混合淋巴细胞反应中具有极强的刺激T细胞增殖的能力. 当荷载 MFC抗原后制成的DC疫苗皮下回输MFC荷瘤小鼠后, 观察至第27天, MIP-1α动员的胃癌DC疫苗和骨髓源性的胃癌DC疫苗实验组小鼠的瘤体大小分别为(2.7±0.6) cm3和(2.8±0.8) cm3, 两者之间无显著性差异(P>0.05); 而对照组小鼠瘤体迅速生长, 瘤体大小分别为23.7±1.7 cm3、26.4±1.9 cm3和31.2±2.2 cm3, 实验组与对照组之间有显著性差异(P<0.05). 此外, 对照组小鼠在荷瘤后25 d内全部死亡, 而实验组小鼠的生存期则明显延长, 且治疗组小鼠在无瘤存活35 d后, 再次接受MFC细胞冲击, 继续观察小鼠至60 d仍存活, 实验组和对照组的差异有统计学意义(P<0.05).
结论: 注射MIP-1α可以直接快速动员B220-CD11c+ DC前体细胞进入小鼠外周血, 这些DC前体细胞荷载MFC抗原后制成的胃癌DC疫苗, 可激活机体T细胞, 产生明显的体内抗肿瘤效应.
引文著录: 何宋兵, 汪良, 黄瑞, 张雁云. 趋化性细胞因子MIP-1α动员DC前体细胞的体内抗胃癌效应. 世界华人消化杂志 2006; 14(4): 387-391
Revised: December 5, 2005
Accepted: December 19, 2005
Published online: February 8, 2006
AIM: To study the in vivo anti-tumor effects of dendritic cell (DC) precursors after being recruited in the peripheral blood by injection of macrophage inflammation protein-1α (MIP-1α) and pulsed by the mouse forestomach carcinoma cell (MFC) lysates.
METHODS: B220-CD11c+ cells were sorted from the peripheral blood of C57BL/6 mice after injection of MIP-1α via tail vein, and then cultured for 5-6 d in the presence of granulocyte-macrophage colony stimulating factor (GM-CSF), interleukin-4 (IL-4) and mouse tumor necrosis factor (mTNF-α). The phenotypes and mixed lymphocyte reaction (MLR) of these cells were assayed. DC vaccines were prepared after B220-CD11c+ cells were loaded with MFC tumor antigen, and then were transfused in the mice baring MFC. The tumor size and the survival of the mice were observed. The mice treated DC vaccine without loading MFC tumor antigen, soluble MFC tumor antigen and phosphate-buffered saline were used as controls.
RESULTS: The peripheral blood level of B220-CD11c+ cells were increased 4 h after MIP-1α injection, and reached the peak at 48 h, accounting for 13.7% ± 0.8%. Freshly isolated B220-CD11c+ cells did not show the features of mature DC, while the ones cultured with mGM-CSF, IL-4, and mTNF-α were phenotypically identical to typical DC, gaining the capacity to stimulate the proliferation of allogenic T cells. 27 days later B220-CD11c+ cells loading MFC tumor antigen were transfused in the mice challenged with MFC cells, the tumor sizes of experimental groups were 2.7 ± 0.6 and 2.8 ± 0.8 cm3, while those of the controls were 23.7 ± 1.7, 26.4 ± 1.9 and 31.2 ± 2.2 cm3. The difference between experimental groups and control groups was statistically significant (P < 0.05). Moreover, all the mice in control groups died within 25 days after the first MFC cell challenging, while the survival periods of experimental groups were much longer. After living for 35 d with tumor free and receiving the second MFC cell challenging, the mice in experimental groups were still alive at day 60. The difference between experimental groups and control groups was also statistically significant (P < 0.05).
CONCLUSION: B220-CD11c+ DC precursors can rapidly accumulate in the peripheral blood after injection of MIP-1α in mice. MFC cell lysates-pulsed DC vaccine can promote the anti-tumor effects of T cells in vivo.
- Citation: He SB, Wang L, Huang R, Zhang YY. Anti-gastric carcinoma efficacy of macrophage inflammation protein-1α recruited dendritic cell vaccine in mice. Shijie Huaren Xiaohua Zazhi 2006; 14(4): 387-391
- URL: https://www.wjgnet.com/1009-3079/full/v14/i4/387.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i4.387
树突状细胞(dendritic cells, DC)是功能最强的专职性抗原递呈细胞(antigen presentation cell, APC), 也是迄今发现的唯一能激活未致敏T细胞并建立初次免疫应答的APC, 在启动抗肿瘤免疫反应中起关键作用[1,2], 近年来已成为研究热点. 目前, 以从外周血中获取DC最适合于临床, 但DC前体细胞在外周血淋巴细胞仅占1%左右[3], 无法满足需要. 因此, 拓展获取DC的新途径是DC生物治疗应用的关键所在.
最近我们用灭活的痤疮丙酸杆菌(Propioni-bacterium acnes, P. acnes)可动员大量B220-CD11c+ DC前体细胞进入小鼠外周血中[4], 实验证明, 这一群细胞即DC前体细胞高表达CC型趋化性细胞因子受体CCR1和CCR5. 通过进一步研究我们发现趋化性细胞因子巨噬细胞炎症蛋白-1α(macrophage inflammation protein-1α, MIP-1α)同样可以动员这群细胞进入小鼠外周血[5]. 本研究中我们给小鼠注射MIP-1α后, 动员B220-CD11c+ DC前体细胞至外周血, 将这些细胞分离后诱导成DC, 并荷载肿瘤抗原, 制备DC疫苗, 以此为基础进行胃癌免疫生物学治疗的小鼠体内实验.
人重组MIP-1α为美国ATCC公司产品. 鼠粒细胞-巨噬细胞集落刺激因子(GM-CSF)、白细胞介素4(IL-4)和鼠肿瘤坏死因子-α(mTNF-α) 为美国R&D公司产品. 所有的单克隆抗体(mAb)均购自美国Pharmigen公司. 完全培养基为在RPMI1640培养基中加入100 mL/L的胎牛血清, 100 kU/L青霉素, 100 mg/L链霉素. 免疫磁珠法分离(MACS)细胞所用磁珠抗体及相关装置系Miltenyi Biotec公司产品. 流式细胞仪(FACS Aria)购自美国Becton Dickinson公司. ♀C57BL/6(B6)、BALB/c小鼠和615小鼠(8-10周龄)购于中科院上海实验动物中心. 养殖于上海第二医科大学动物科学部. 小鼠前胃癌(mouse forestomach carcinoma, MFC)细胞购于中科院上海生化细胞所.
1.2.1 DC的体外诱导: B6小鼠尾静脉注射20 mg MIP-1α, 48 h后心脏穿刺获取外周血. 用淋巴细胞分离液分离得单个核细胞(MNC), FACS分选出B220-CD11c+细胞(纯度>99%). 将分选所得细胞(3×108/L)加入含有细胞因子GM-CSF(4 mg/L)和IL-4(10 mg/L)的RPMI 1640完全培养基, 接种于24孔培养板, 37℃ 50 mL/L CO2条件下培养3 d后, 加入GM-CSF和mTNF-α(50 mg/L)再培养2-3 d. 骨髓DC培养参考文献[6], 取B6小鼠后肢骨, 分离得骨髓MNC. 将细胞用完全培养基重悬后置于培养皿中, 孵育2 h, 去除悬浮细胞. 将贴壁细胞重悬后按照上述条件续贯培养14-17 d.
1.2.2 DC细胞表面标志分析: FACS分析按照我室常规方法进行[7].
1.2.3 混合淋巴细胞反应: (MLR)按我室常规方案进行[7]. 简述如下: 无菌条件下取BALB/c小鼠脾脏, 分离得MNC, MACS获取脾脏CD4+ T淋巴细胞, 调整细胞浓度至3×108/L, 作为效应T细胞. 各刺激组细胞经丝裂霉素MMC在37℃下处理45 min后加入至效应细胞中共培养4 d(37℃, 50 mL/L CO2), 用MTT法检测细胞增殖.
1.2.4 DC疫苗的制备: MFC细胞用完全培养基常规传代培养, 消化、收集对数生长期的肿瘤细胞, 用PBS(含25 mL/L FCS)离心洗涤、记数. 反复冻融3次所得细胞混悬液以10 000 g离心30 min, 取上清液作为肿瘤可溶性抗原, -20℃ 保存备用. 使用前37℃水浴融化后紫外线照射 30 min. 在含GM-CSF、IL-4和mTNF-α的完全培养基中, MIP-1α动员的B220-CD11c+细胞经培养4 d后和骨髓细胞培养10-12 d(37℃, 50 mL/L CO2)后, 分别加入1 g/L终浓度的胃癌抗原, 共同孵育48 h.
1.2.5 MFC荷瘤小鼠模型的建立: 615小鼠腋窝皮下注射2×1011/L MFC细胞, 建立小鼠前胃癌模型, 观测瘤体的生长情况和小鼠的存活时间.
1.2.6 MIP-1α动员的胃癌DC疫苗治疗胃癌荷瘤小鼠: 615小鼠(分成5组, 每组8只)在接种MFC细胞后7 d, 以1×106MIP-1α动员的胃癌DC疫苗和骨髓源性胃癌DC疫苗注射于肿瘤边缘皮下, 1 wk后按上述方法再次免疫注射一次. 1×106未荷载肿瘤抗原的MIP-1α动员的胃癌DC疫苗、500 mL MFC肿瘤可溶性抗原和500 mL PBS缓冲液作为对照组. 每隔3 d测量皮下肿瘤的大小, 以公式: (肿瘤短径)2×肿瘤长径×0.52来计算肿瘤的大小, 当小鼠瘤体有破溃时, 处死小鼠, 以死亡记数.
统计学处理 数据以mean±SD表示, 用SPSS 11.0统计软件进行t检验, P<0.05为有统计学意义. 小鼠的生存差异用Kaplan-Meier生存曲线来评估.
注射MIP-1α或PBS前, B6小鼠外周血MNC中仅见少量B220-CD11c+细胞(1.5%±0.3%), 但注射MIP-1α 4 h后, 实验组小鼠外周血中B220-CD11c+细胞含量即开始升高, 24 h细胞数量明显升高, 48 h达到高峰, 72 h后逐渐下降, 而注射PBS的对照组小鼠外周血中B220-CD11c+细胞的数量未发生变化(图1). 实验结果证实尾静脉注射MIP-1α可以快速动员大量B220-CD11c+细胞进入小鼠外周血循环.
取注射MIP-1α 48 h后小鼠外周血中分选出的B220-CD11c+细胞, FACS分析其细胞表面标志, 结果显示其高表达CD11b(56.70%±1.05%)分子; 中度表达CD40(12.30%±0.47%)分子; 低表达MHCⅡ类分子(1.71%±0.11%)、DEC-205(1.41%±0.08%)、CD80(3.10%±0.16%)和CD86(2.81%±0.13%); 不表达F4/80和CD8a. 这些细胞经GM-CSF+IL-4培养3-4 d并续以GM-CSF+mTNF-α再培养3-4 d后, 细胞表面标志出现明显变化, 其MHCⅡ类分子表达明显上调(69.76%±1.97%). 这些细胞在高表达MHCⅡ类分子的同时也高表达DEC-205(59.64%±1.62%)、CD80(47.69%±1.29%)和CD86(54.39%±1.57%); 中度表达CD40(35.19%±0.61%); 仍不表达F4/80和CD8a, 与骨髓来源的成熟DC具有类似的表型特征.
注射MIP-1α后48 h, 从B6鼠外周血中分离得B220-CD11c+细胞经GM-CSF、IL-4和mTNF-α续贯培养5-7 d. 取这些培养的细胞和骨髓来源的DC分别作为刺激细胞, 与BABL/c鼠脾脏CD4+T细胞作混合淋巴细胞反应, 用MTT法检测他们刺激同种异源性T细胞增殖的能力. 结果显示新鲜分离的B220-CD11c+细胞并不能刺激CD4+T细胞增殖, 而在经过细胞因子GM-CSF+IL-4及后续的GM-CSF+mTNF-α培养后的MIP-1α动员的B220-CD11c+细胞则与骨髓来源的DC相当, 具有很强的刺激异源性CD4+T细胞增殖的能力(图2). 实验结果表明MIP-1α动员的B220-CD11c+细胞可分化为成熟DC.
荷瘤小鼠接受MIP-1α动员的胃癌DC疫苗治疗后的瘤体大小见图3. MIP-1α动员的胃癌DC疫苗和骨髓源性的胃癌DC疫苗实验组的小鼠瘤体生长相当缓慢, 观察至第27 d, 实验组小鼠的瘤体大小分别为(2.7±0.6)cm3和(2.8±0.8)cm3, 两者之间无显著性差异; 而对照组小鼠瘤体迅速生长, 同样观察至第27 d, 瘤体大小分别为(23.7±1.7)cm3、(26.4±1.9)cm3和(31.2±2.2)cm3, 实验组与对照组之间有显著性差异(P<0.05).
观察小鼠的存活情况, 并记录荷瘤小鼠的生存时间见图4. 结果显示对照组小鼠在荷瘤后 25 d内全部死亡, 而MIP-1α动员的胃癌DC疫苗和骨髓源性的胃癌DC疫苗实验组小鼠的生存期则明显延长, 且治疗组小鼠在无瘤存活35 d后, 再次接受MFC细胞冲击, 继续观察小鼠至60 d仍存活, 实验组和对照组的差异有统计学意义(P<0.05).
免疫治疗是现代肿瘤综合治疗的一种重要手段. DC在免疫反应中处于中心调控地位, DC疫苗抗肿瘤作为很有前景的临床抗肿瘤免疫生物学治疗新策略[1], 近年来已成为研究热点, 并已被广泛用于对感染、肿瘤和自身免疫病等的治疗, 展现出良好的应用前景.
抗肿瘤免疫效应通过机体的固有性免疫启动, 并由适应性免疫得到加强, 而在这过程中DC起到了核心调控作用. 其中包括DC前体细胞识别肿瘤分子、DC激活NK/NKT细胞并介导杀伤识别的肿瘤分子、未成熟DC摄取和交叉递呈肿瘤相关抗原(TAA)、激活TAA特异性T细胞以及非特异性分子(如巨噬细胞)、TAA特异性T细胞到达肿瘤部位, 杀伤肿瘤细胞等环节[8].
进行以DC为基础的细胞免疫治疗的前提是获得足够量的DC. Marroquin et al[9]报道注射Flt3配体可以增加将近10倍的组织居留的DC数量, 虽然获取这些DC依然困难, 但这是首次报道可以在短期内增加DC前体细胞数量的方法. 外周血取样容易, 临床可操作性强, 但是DC前体细胞在外周血中含量很少, 因此在临床应用研究中亟待探索以快速简单的方法来增加外周血中的DC前体细胞或未成熟DC.
我们的研究发现, 给小鼠静脉注射MIP-1α能直接快速地动员来自骨髓的B220-CD11c+细胞进入外周血, 这些细胞经过细胞因子GM-CSF、IL-4和mTNF-α短期培养后即呈现典型的髓系DC的表型, 高表达MHCⅡ类分子、CD11c、DEC205和CD11b等分子, 而CD8a和F4/80为阴性. 在功能上, 他们与骨髓细胞来源的DC一样, 能有效地刺激异源性T细胞大量增殖. 说明MIP-1α动员的外周血B220-CD11c+细胞具有分化为DC的潜能, 是DC的前体细胞. 这就为我们解决外周血中DC数量少和需求量大之间的矛盾开辟了新的途径.
获取了一定数量并具有正常功能的DC后, 将DC应用于肿瘤的免疫治疗的关键是DC疫苗的构建. 目前常见的构建DC疫苗的方法主要有[10]: 肿瘤细胞冻融物冲击致敏DC[11]、基因工程肿瘤蛋白抗原或人工合成的肿瘤抗原多肽冲击致敏DC[12,13]、基因转染构建DC疫苗[14]等. 本实验中, 我们通过反复冻融肿瘤细胞即可方便地制成有效的可溶性抗原, 用 MIP-1α动员的DC荷载胃癌细胞抗原后可致敏小鼠脾脏T细胞, 使其对靶细胞产生明显的特异性杀伤作用, 这为我们进一步开展新的DC抗肿瘤免疫治疗的研究奠定了基础.
用骨髓分离和诱导出的DC用于免疫治疗的方法已经得到大家的公认[15]. 因此, 本实验中我们收集小鼠的骨髓源性DC前体细胞, 用同样的方法来培养、诱导出成熟DC, 用于和MIP-1α动员的DC做功能上的比较. 结果发现MIP-1α动员的DC和骨髓源性DC在荷载MFC细胞裂解物后, 用于治疗荷瘤小鼠, 均显示了强大的抑瘤作用, 治疗组瘤体生长缓慢, 且在再次接种后仍然未观察到肿瘤的生长, 显示了DC疫苗的长期抗肿瘤效应; 治疗组与对照组小鼠的平均存活期有显著性差异. MIP-1α动员的DC和骨髓源性DC疫苗一样, 在荷载肿瘤细胞抗原后, 具有诱导小鼠体内T细胞产生肿瘤特异性的杀伤作用, 对荷瘤小鼠有明显的治疗作用.
总之, 本研究阐明了注射MIP-1α能直接快速地动员B220-CD11c+细胞进入外周血, 这些细胞在体外经过短期培养后可分化为功能正常的成熟DC; 用MIP-1α动员的DC荷载肿瘤抗原后, 制备成胃癌DC疫苗, 在小鼠体内可产生明显的抗肿瘤效应. 进一步研究胃癌DC疫苗回输机体后的抗胃癌免疫的机制, 将对DC抗胃癌免疫治疗的基础和临床应用有重要的意义.
电编: 张敏 编辑:张海宁
| 1. | Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature. 1998;392:245-252. [PubMed] [DOI] |
| 3. | Marland G, Bakker AB, Adema GJ, Figdor CG. Dendritic cells in immune response induction. Stem Cells. 1996;14:501-507. [DOI] |
| 4. | Yoneyama H, Matsuno K, Zhang Y, Murai M, Itakura M, Ishikawa S, Hasegawa G, Naito M, Asakura H, Matsushima K. Regulation by chemoki-nes of circulating dendritic cell precursors, and the formation of portal tract-associated lymphoid tissue, in a granulomatous liver disease. J Exp Med. 2001;193:35-49. [PubMed] [DOI] |
| 6. | Zhang Y, Zhang YY, Ogata M, Chen P, Harada A, Hashimoto S, Matsushima K. Transforming growth factor-beta1 polarizes murine hematopoietic proge-nitor cells to generate Langerhans cell-like dendri-tic cells through a monocyte/macrophage differen-tiation pathway. Blood. 1999;93:1208-1220. |
| 7. | Zhang Y, Wang Y, Ogata M, Hashimoto S, Onai N, Matsushima K. Development of dendritic cells in vitro from murine fetal liver-derived lineage phenotype-negative c-kit(+) hematopoietic progeni-tor cells. Blood. 2000;95:138-146. [PubMed] |
| 8. | Banchereau J, Briere F, Caux C, Davoust J, Lebecque S, Liu YJ, Pulendran B, Palucka K. Immunobiology of dendritic cells. Annu Rev Immunol. 2000;18:767-811. [PubMed] [DOI] |
| 9. | Marroquin CE, Westwood JA, Lapointe R, Mixon A, Wunderlich JR, Caron D, Rosenberg SA, Hwu P. Mobilization of dendritic cell precursors in patients with cancer by flt3 ligand allows the generation of higher yields of cultured dendritic cells. J Immunother. 2002;25:278-288. [PubMed] [DOI] |
| 10. | Steinman RM, Pope M. Exploiting dendritic cells to improve vaccine efficacy. J Clin Invest. 2002;109:1519-1526. [PubMed] [DOI] |
| 11. | Zeng Y, Feng H, Graner MW, Katsanis E. Tumor-derived, chaperone-rich cell lysate activates dendri-tic cells and elicits potent antitumor immunity. Blood. 2003;101:4485-4491. [PubMed] [DOI] |
| 12. | Sadanaga N, Nagashima H, Mashino K, Tahara K, Yamaguchi H, Ohta M, Fujie T, Tanaka F, Inoue H, Takesako K. Dendritic cell vaccination with MAGE peptide is a novel therapeutic approach for gastrointestinal carcinomas. Clin Cancer Res. 2001;7:2277-2284. [PubMed] |
| 13. | Brossart P, Stuhler G, Flad T, Stevanovic S, Rammensee HG, Kanz L, Brugger W. Her-2/neu-derived peptides are tumor-associated antigens expressed by human renal cell and colon carcinoma lines and are recognized by in vitro induced specific cytotoxic T lymphocytes. Cancer Res. 1998;58:732-736. [PubMed] |
| 14. | Foley R, Tozer R, Wan Y. Genetically modified dendritic cells in cancer therapy: implications for transfusion medicine. Transfus Med Rev. 2001;15:292-304. [PubMed] [DOI] |