修回日期: 2005-12-05
接受日期: 2005-12-24
在线出版日期: 2006-02-08
目的: 探讨不同的转染试剂对AGS细胞形态的影响, 观察这些转染试剂能否像幽门螺杆菌那样引起AGS细胞蜂鸟状改变.
方法: 用多聚阳离子转染试剂(多聚乙酰亚胺、梭华-Sofast)和改良的脂类转染试剂(Effectene Transfection Reagent)分别转染AGS细胞, 观察细胞形态的变化. 用幽门螺杆菌26695菌株攻击AGS细胞, 观察细胞形态的变化并与经转染试剂作用的细胞进行形态比较.
结果: 幽门螺杆菌攻击后4 h能引起AGS细胞发生蜂鸟状改变. 两种多聚阳离子转染试剂也均能引起AGS细胞发生蜂鸟状改变, 与幽门螺杆菌引起的细胞形态改变相似, 大部分细胞拉长, 并且不受是否转染DNA的影响. 此种变化在转染4 h时便出现, 与试剂剂量的增加成正相关. 当PEI的剂量为10 µL时, 细胞出现凋亡, 15 µL时凋亡加重. 改良的脂类转染试剂对AGS细胞的形态未产生影响.
结论: 在研究引起AGS细胞形态改变的因素时, 不宜选择多聚阳离子转染试剂; 多聚阳离子引起的AGS细胞形态改变与幽门螺杆菌引起的AGS细胞形态改变之间是否存在关系值得进一步研究.
引文著录: 邹清华, 曾浔, 孟凡亮, 何利华, 张建中. 转染试剂及幽门螺杆菌对 AGS 细胞形态的影响. 世界华人消化杂志 2006; 14(4): 382-386
Revised: December 5, 2005
Accepted: December 24, 2005
Published online: February 8, 2006
AIM: To investigate the effects of different transfection reagents on the morphology of AGS cells and to explore whether these reagents can induce humming bird type of AGS cells as Helicobacter pylori (H. pylori) does.
METHODS: AGS cells were transfected with polycation transfection reagents (polyethylenimine, Sofast Cell Transfection reagent) and the new generation of lipid transfection reagents (Effectene Transfection Reagent). Then morphological changes of the cells were observed. Meanwhile, AGS cells were infected with H. pylori 26695, and then the morphology of the cells was compared with that of the cells transfected with transfection reagents.
RESULTS: H. pylori 26695 induced humming bird type of AGS cells 4 h after infection. Both polycation transfection reagents also induced humming bird type of AGS cells, and the cells were elongated in shape, which was similar to that induced by H. pylori 26695. The humming bird type always appeared whether the cells were transfected with DNA or without DNA at 4 h. The morphological changes were positively related with the dosages of the reagents. The apoptosis of the cells were observed when 10 µL reagents were used, and it became severe as the dosage reached 15 µL. The new generation of lipid transfection reagents had no effect on the morphology of AGS cells.
CONCLUSION: Polycation transfection reagents should not be used in the research of AGS cell morphology. Further study should be performed to find out whether there are some common pathways between the morphology variation induced by H pylori and polycation transfection reagents.
- Citation: Zou QH, Zeng X, Meng FL, He LH, Zhang JZ. Effects of transfection reagents and Helicobacter pylori on morphology of AGS cells. Shijie Huaren Xiaohua Zazhi 2006; 14(4): 382-386
- URL: https://www.wjgnet.com/1009-3079/full/v14/i4/382.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i4.382
幽门螺杆菌(Helicobacter pylori, H. pylori)是慢性活动性胃炎和消化性溃疡的首要致病因子[1,2], 并与人群胃癌和胃恶性淋巴瘤的发生密切相关[3-5]; WHO已将其列为一类致癌物. 细胞毒素相关蛋白A(cytotoxin associated protein A, CagA)是H. pylori的一种重要毒力因子[6-8]. 编码该蛋白的cagA基因(cytotoxin asociated gene A)位于H. pylori的cag毒力岛3'末端, 是后者存在的重要标志. 众多实验表明含有cagA基因的H. pylori能引起AGS细胞发生蜂鸟状改变, 特征是细胞伸长和扩散[9-11], 而cagA基因的缺失株却不能引起此种改变[10]. 因此CagA进入细胞后启动了哪些信号通路而导致AGS细胞发生蜂鸟状改变引起了众多学者的关注. 目前已知CagA蛋白通过幽门螺杆菌的IV型分泌系统进入到宿主细胞中[12,13], 然后被宿主细胞的激酶c-Src酪氨酸磷酸化[14], 磷酸化的CagA激活下游信号转导通路从而引起细胞骨架的改变, 进而引起细胞的病变[15-18]. 在研究CagA的作用机制时经常采用基因转染的方式. 可以通过各种转染方式将表达CagA的真核载体转染入AGS细胞, 进而分析CagA在细胞内的作用方式[10,19]. 但不同的转染试剂本身是否会对AGS细胞产生影响尚没有文献报道. 目前, 最常用的转染试剂是脂质体和阳离子聚合物. 因此我们旨在研究阳离子聚合物多聚乙酸亚胺(polyethylenimine, PEI)、梭华-Sofast和改良的脂类转染试剂Effectene Transfection Reagent是否能像幽门螺杆菌那样对AGS细胞产生形态的影响.
H. pylori国际标准菌株26695, AGS细胞(ATCC CRL1739), RPMI1640、胰酶(Hyclone), 胎牛血清(PAA, Austria), PEI(sigma), 梭华-Sofast(北京天来医学科技有限公司), Effectene Transfection Reagent(QIAGEN), pEGFP-N3 (Clontech, America)稀释成1 g/L.
1.2.1 H. pylori攻击AGS细胞: 用PBS将处于对数生长期的H. pylori 26695清洗3遍, 测细菌浓度. 将AGS细胞用PBS清洗1遍, 按细菌与细胞比例为100︰1加入细菌, 加入适量的细胞培养液, 37℃, 50 mL/L CO2孵箱中培养4 h, 显微镜下观察细胞形态.
1.2.2 PEI转染细胞: 将PEI (Mr,50 000)制成10 mmol/L的溶液, 用1 mol/L的HCl调pH值至7.0, 经0.2 μm微孔滤膜除菌, 4℃保存备用. 按表1在5个Eppendorf 管中加入相应的试剂.
将A液缓慢加入到B液中, 室温静置10-15 min; 用PBS清洗细胞, 加入2.2 mL无血清RPMI 1640, 将上述制备好的溶液移入6孔板细胞内, 置于50 mL/L CO2培养箱内4-6 h; 补加100 mL/L血清, 50 mL/L CO2 孵育箱孵育直到检测.
1.2.3 梭华-Sofast转染细胞: 2 µg pEGFP-N3质粒稀释于98 µL 150 mmoL/L NaCl, 轻轻混匀. 6 µL梭华-Sofast稀释于94 µL 150 mmol/L NaCl中, 轻轻混匀. 100 µL梭华-Sofast稀释液滴加到DNA稀释液中, 一边滴加一边混匀. 室温孵育15-20 min. 200 µL梭华-Sofast/DNA复合物加到每孔中并轻轻摇动使均匀混合. 放置37℃ 50mL/L CO2孵育箱孵育24-48 h. 同时做一不加质粒的转染, 观察没有质粒时, 梭华-Sofast对AGS细胞的影响.
1.2.4 Effectene Transfection Reagent转染细胞: 用buffer EC溶解0.4 µg pEGFP-N3, 终体积100 µL. 加入3.2 µL Enhancer, 轻轻混匀. 15℃-25℃放置2-5 min. 加入10 µL Effectene Transfection Reagent, 轻轻混匀, 15℃-25℃放置5-10 min. 用PBS清洗细胞, 加入1.6 mL培养液. 向转染混合物中加入0.6 mL培养液, 混匀, 迅速加入细胞中. 37℃ CO2孵育箱孵育24-48 h. 同时做一不加质粒的转染, 观察没有质粒时, Effectene Transfection Reagent对AGS细胞的影响.
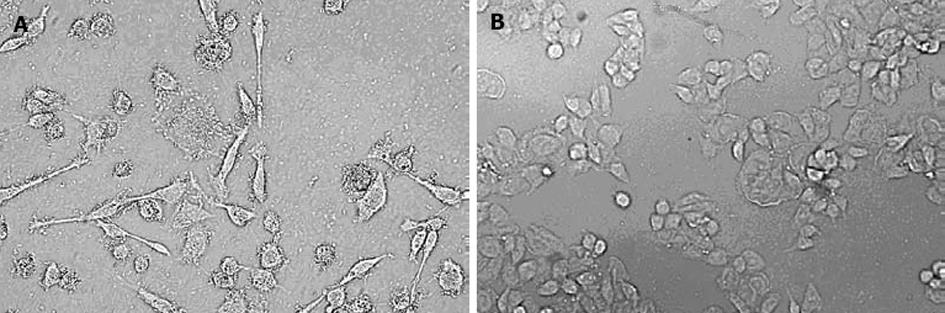
用H. pylori 26 695攻击AGS细胞4 h时, 可见大部分细胞拉长, 出现蜂鸟状改变(图1A), 而未经攻击的AGS细胞形态正常(图1B).
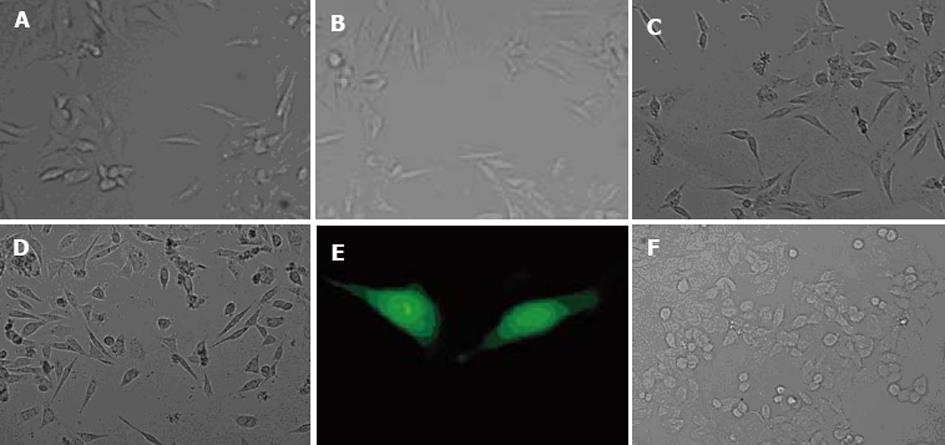
低剂量的PEI(1 µL)即能引起AGS细胞发生蜂鸟状改变, 此种变化在转染4 h时便出现, 与PEI剂量的增加成正相关(图2A-D). 当PEI的剂量为10 µL时, 细胞出现凋亡, 15 µL时凋亡加重. 在转染质粒时, PEI仍能引起AGS细胞发生蜂鸟状改变(图2E), 而未经PEI转染的细胞形态正常(图2F).
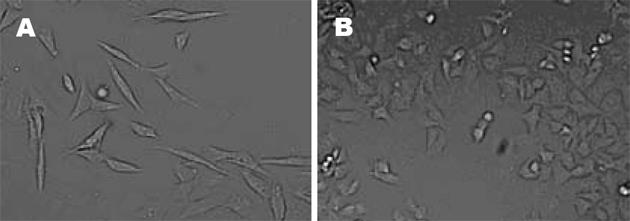
为了验证其他的多聚阳离子转染试剂是否会对AGS细胞产生相同的影响, 我们采用了另一种多聚阳离子梭华-Sofast, 发现此试剂无论在转染质粒和不转染质粒时都能使细胞发生蜂鸟状改变, 其作用效果与PEI相似. 图3A显示的是不加质粒时单纯的梭华-Sofast转染试剂引起的蜂鸟状改变, 图3B为未经作用的细胞.
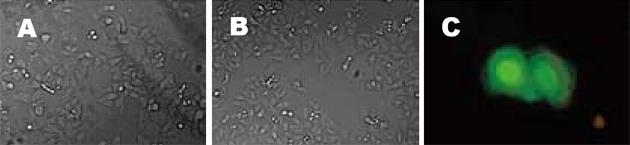
为了观察其他类型的转染试剂对AGS细胞的影响, 我们采用了改良的脂类转染试剂Effectene Transfection Reagent, 发现此试剂无论在转染质粒和不转染质粒时均未引起AGS细胞产生蜂鸟状改变(图4A-C).
目前已经有许多证据表明幽门螺杆菌与胃癌的发生有着密切的关系, 而CagA蛋白在幽门螺杆菌的致病性中起着重要的作用. CagA蛋白通过幽门螺杆菌的IV型分泌系统被注入到宿主细胞中, 然后被宿主细胞的c-Src酪氨酸激酶磷酸化[20]. Backert et al[10]发现26695菌株CagA蛋白中972位的酪氨酸对细胞的蜂鸟状改变起着重要的作用. Mimuro et al[21]的结果表明CagA与Grb2结合, 激活Ras/MEK/ERK通路, 引起细胞延长和伸展, 产生蜂鸟状改变. 而Higashi et al[22]的结果表明CagA能与SHP-2结合, 破坏他们之间的结合则不会引起细胞的蜂鸟状改变. 因此, CagA究竟是怎样引起AGS细胞产生蜂鸟状改变的尚有待进一步阐明. 我们发现多聚阳离子转染试剂能与幽门螺杆菌产生相似的作用, 引起AGS细胞产生蜂鸟状改变, 而改良的脂类转染试剂却不能产生这种作用. PEI是近年来发现的一种多聚阳离子化合物[23], 其结构特点为每隔3个原子即出现氨基氮, 构成多聚网状结构, 从而与DNA结合形成颗粒状[24], 与细胞表面的蛋白多糖结合, 通过细胞"内吞作用"进入细胞. PEI-复合体具有质子海绵的特性, 能吸收溶酶体的H+, 在复合体中形成酸性环境使核酸酶失活, 保护DNA免受核酸酶的降解[25]. 进入细胞后, PEI复合体囊泡肿胀破裂, 将DNA释放到细胞质中. 据文献报道, 1 μg DNA有3 nmoL 磷酸基团, 1 μL PEI工作液中有10 nmoL氨基氮. 通常以氨基氮和磷酸基团的比例来确定DNA和PEI的用量. 当两者的比例从6︰1到9︰1, 13︰1, 18︰1, 20︰1时转染效率仅差10倍, 其中9-13︰1时最高. 到18︰1时未见明显细胞毒性[22]. 我们发现低剂量的PEI即能引起AGS细胞产生蜂鸟状改变. 这种结果是否提示多聚阳离子转染试剂引起AGS细胞形态改变的信号通路与幽门螺杆菌引起AGS细胞形态改变的信号通路之间存在共同点, 值得进一步探讨.
同时, 基因转染技术在研究幽门螺杆在AGS细胞的致病机制研究中有着广泛的应用. 基因转染是将具生物功能的核酸转移或运送到细胞内并使核酸在细胞内维持其生物功能. 在研究幽门螺杆菌对AGS细胞的毒力因子时, 经常需要将编码此因子的基因连到表达载体上转染入AGS细胞, 观察其对AGS细胞形态的影响. 由于多聚阳离子转染试剂能对AGS细胞产生形态影响, 因此在研究引起AGS细胞形态改变的因素时应尽量避免使用此类转染试剂.
幽门螺杆菌感染与胃炎和胃癌的发生密切相关, CagA蛋白在其致病过程中起重要作用. CagA+的菌株能引起AGS细胞发生蜂鸟状改变. 研究CagA引起蜂鸟状改变的机制时经常通过转染试剂将表达CagA的载体转染入AGS细胞. 但不同的转染试剂本身是否会对AGS细胞产生影响, 转染时选择什么类型的转染试剂不会对实验产生影响, 目前尚没有相关研究.
CagA+幽门螺杆菌能引起AGS细胞发生蜂鸟状改变. 但其机制尚不是很明确. 新一代的脂类转染试剂EffecteneTransfection试剂以及多聚阳离子转染试剂因为具有较高的转染效率、对细胞毒性比较低而受到广泛应用. 但此类转染试剂是否适于在AGS细胞中转染尚没有明确报道.
发现多聚阳离子转染试剂本身即能引起AGS细胞发生蜂鸟状改变, 因此在研究引起AGS细胞发生蜂鸟状改变的因素时不宜用多聚阳离子类转染试剂. 同时此类转染试剂引起AGS细胞发生蜂鸟状改变的机制是否与幽门螺杆菌引起的AGS细胞发生蜂鸟状改变的机制有共同之处值得进一步探讨.
蜂鸟状改变: 细胞出现的一种两端拉长的类似于蜂鸟的形态改变.
本文研究结果对转染试剂的选择上提供理论依据与指导意义, 使对H. pylori的毒力研究向前迈进一步. 研究起点高, 材料规范, 方法先进, 技术难度大, 结果可靠, 讨论切题, 观点明确, 代表H. pylori研究领域的先进性.
电编: 张勇 编辑:张海宁
| 1. | Nduduba DA, Rotimt O, Otegbeye FM. Helicobacter pylori and the pathogenesis of gastroduodenal disease: implications for the management of peptic ulcer disease. Niger Postgrad Med J. 2005;12:289-298. [PubMed] |
| 2. | Chomvarin C, Kulsuntiwong P, Mairiang P, Sangchan A, Kulabkhow C, Chau-in S, Waropastrakul N. Detection of H. pylori in dyspeptic patients and correlation with clinical outcomes. Southeast Asian J Trop Med Public Health. 2005;36:917-922. [PubMed] |
| 3. | Tokudome S, Samsuria Soeripto WD, Triningsih FX, Suzuki S, Hosono A, Triono T, Sarjadi IW, Miranti IP, Ghadimi R, Moore MA. Helicobacter pylori infection appears essential for stomach carcinogenesis: observations in Semarang, Indonesia. Cancer Sci. 2005;96:873-875. [PubMed] [DOI] |
| 4. | Parsonnet J, Friedman GD, Vandersteen DP, Chang Y, Vogelman JH, Orentreich N, Sibley RK. Helicobacter pylori infection and the risk of gastric carcinoma. N Engl J Med. 1991;325:1127-1131. [PubMed] [DOI] |
| 5. | Suzuki T, Matsuo K, Ito H, Hirose K, Wakai K, Saito T, Sato S, Morishima Y, Nakamura S, Ueda R. A past history of gastric ulcers and Helicobacter pylori infection increase the risk of gastric malignant lymphoma. Carcinogenesis. 2006;. [PubMed] [DOI] |
| 6. | Hatakeyama M, Higashi H. Helicobacter pylori CagA: a new paradigm for bacterial carcinogenesis. Cancer Sci. 2005;96:835-843. [PubMed] [DOI] |
| 7. | Sozzi M, Tomasini ML, Vindigni C, Zanussi S, Tedeschi R, Basaglia G, Figura N, De Paoli P. Heterogeneity of cag genotypes and clinical outcome of Helicobacter pylori infection. J Lab Clin Med. 2005;146:262-270. [PubMed] [DOI] |
| 8. | Suzuki M, Mimuro H, Suzuki T, Park M, Yamamoto T, Sasakawa C. Interaction of CagA with Crk plays an important role in Helicobacter pylori-induced loss of gastric epithelial cell adhesion. J Exp Med. 2005;202:1235-1247. [PubMed] [DOI] |
| 9. | Su B, Ceponis PJ, Sherman PM. Cytoskeletal rearrangements in gastric epithelial cells in response to Helicobacter pylori infection. J Med Microbiol. 2003;52:861-867. [PubMed] [DOI] |
| 10. | Backert S, Moese S, Selbach M, Brinkmann V, Meyer TF. Phosphorylation of tyrosine 972 of the Helicobacter pylori CagA protein is essential for induction of a scattering phenotype in gastric epithelial cells. Mol Microbiol. 2001;42:631-644. [PubMed] [DOI] |
| 11. | Moese S, Selbach M, Kwok T, Brinkmann V, Konig W, Meyer TF, Backert S. Helicobacter pylori induces AGS cell motility and elongation via independent signaling pathways. Infect Immun. 2004;72:3646-3649. [PubMed] [DOI] |
| 12. | Odenbreit S, Puls J, Sedlmaier B, Gerland E, Fischer W, Haas R. Translocation of Helicobacter pylori CagA into gastric epithelial cells by type IV secretion. Science. 2000;287:1497-1500. [PubMed] [DOI] |
| 13. | Backert S, Ziska E, Brinkmann V, Zimny-Arndt U, Fauconnier A, Jungblut PR, Naumann M, Meyer TF. Translocation of the Helicobacter pylori CagA protein in gastric epithelial cells by a type IV secretion apparatus. Cell Microbiol. 2000;2:155-164. [PubMed] [DOI] |
| 14. | Selbach M, Moese S, Hauck CR, Meyer TF, Backert S. Src is the kinase of the Helicobacter pylori CagA protein in vitro and in Vivo. J Biol Chem. 2002;277:6775-6778. [PubMed] [DOI] |
| 15. | Higashi H, Tsutsumi R, Muto S, Sugiyama T, Azuma T, Asaka M, Hatakeyama M. SHP-2 tyrosine phosphatase as an intracellular target of. Helicobacter pylori CagA protein. Science. 2002;295:683-686. [PubMed] |
| 16. | Mimuro H, Suzuki T, Tanaka J, Asahi M, Haas R, Sasakawa C. Grb2 is a key mediator of helicobacter pylori CagA protein activities. Mol Cell. 2002;10:745-755. [PubMed] [DOI] |
| 17. | Bach S, Makristathis A, Rotter M, Hirschl AM. Gene expression profiling in AGS cells stimulated with Helicobacter pylori isogenic strains (cagA positive or cagA negative). Infect Immun. 2002;70:988-992. [PubMed] [DOI] |
| 18. | Tsutsumi R, Takahashi A, Azuma T, Higashi H, Hatakeyama M. Focal Adhesion Kinase Is a Substrate and Downstream Effector of SHP-2 Complexed with Helicobacter pylori CagA. Mol Cell Biol. 2006;26:261-276. [PubMed] [DOI] |
| 19. | Higashi H, Yokoyama K, Fujii Y, Ren S, Yuasa H, Saadat I, Murata-Kamiya N, Azuma T, Hatakeyama M. EPIYA motif is a membrane-targeting signal of Helicobacter pylori virulence factor CagA in mammalian cells. J Biol Chem. 2005;280:23130-23137. [PubMed] [DOI] |
| 20. | Stein M, Bagnoli F, Halenbeck R, Rappuoli R, Fantl WJ, Covacci A. c-Src/Lyn kinases activate Helicobacter pylori CagA through tyrosine phosphorylation of the EPIYA motifs. Mol Microbiol. 2002;43:971-980. [PubMed] |
| 21. | Mimuro H, Suzuki T, Tanaka J, Asahi M, Haas R, Sasakawa C. Grb2 is a key mediator of Helicobacter pylori CagA protein activities. Mol Cell. 2002;10:745-755. [PubMed] [DOI] |
| 22. | Higashi H, Tsutsumi R, Muto S, Sugiyama T, Azuma T, Asaka M, Hatakeyama M. SHP-2 tyrosine phosphatase as an intracellular target of Helicobacter pylori CagA Protein. Science. 2002;295:683-686. [PubMed] [DOI] |
| 24. | Boussif O, Lezoualc'h F, Zanta MA, Mergny MD, Scherman D, Demeneix B, Behr JP. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proc Natl Acad Sci USA. 1995;92:7297-7301. [PubMed] [DOI] |