修回日期: 2005-12-05
接受日期: 2005-12-06
在线出版日期: 2006-02-08
目的: 观察胃电刺激(GES)对大鼠下丘脑腹内侧区(VMH)胃扩张(GD)相关神经元的作用及脑内增食欲素(orexin)表达的影响, 初步探讨GES的中枢作用机制.
方法: 选用成年Wistar大鼠52只, 采用细胞外记录神经元单位放电方法, 记录VMH神经元自发放电活动, 根据神经元对胃扩张刺激反应的不同, 分为胃扩张兴奋性神经元(GD-E)和胃扩张抑制性神经元(GD-I). 观察3组不同参数的胃电刺激(GES1, GES2, GES3)对VMH内GD-E和GD-I放电频率的影响: GES1(6 mA, 0.3 ms, 40 Hz, 2 s-on, 3 s-off)为标准参数; GES2的串刺激持续时间减少为0.1 s; GES3的串刺激频率减少至20 Hz, 其他参数均同GES1. 采用免疫荧光组织化学染色方法和放射免疫分析法观测胃电刺激2 h对大鼠下丘脑外侧区 (LHA)增食欲素-A(orexin-A)阳性神经元和不同脑区orexin含量表达的影响.
结果: VMH记录的96个神经元中有82个神经元(85.41%)对胃扩张刺激(GD, 3-5 mL, 10-30 s)有反应, 其中31个(37.8%)为胃扩张兴奋性(GD-E)神经元, 51个(62.2%)为胃扩张抑制性(GD-I)神经元. GES1, 2, 3分别兴奋了55.0%, 17.6%, 14.3%的GD-E神经元. GES1对GD-E神经元的作用明显强于GES2和GES3 (P = 0.002, P = 0.016). 63.6%, 37.9%和51.9%的GD-I神经元分别被GES1, 2, 3所兴奋, 其中GES2的兴奋作用较弱(P = 0.043). GES1刺激胃窦部2 h, 下丘脑LHA orexin-A免疫阳性神经元表达明显减少(6.97±1.51/0.1 mm2vs 26.62±8.30/0.1 mm2, P<0.01); 且下丘脑、中脑、延脑和孤束核中orexin免疫反应物(IR)的含量与对照组相比明显减少(112.54±11.58 fmol/mg vs 185.23±15.22 fmol/mg, P<0.01; 71.95±8.45 fmol/mg vs 98.48±12.02 fmol/mg, P<0.05; 72.36±6.58 fmol/mg vs 101.29±15.22 fmol/mg, P<0.05; 69.12±4.99 fmol/mg vs 89.21±9.23 fmol/mg, P<0.05), 但脑桥内orexin-IR的含量与对照组相比无显著差异.
结论: GES可兴奋下丘脑"饱中枢"-VMH内胃扩张反应性神经元, 电刺激作用的强弱与GES刺激的频率和刺激的持续时间有关; 脑内orexin的降低可能也参与了GES的中枢作用机制.
引文著录: 孙向荣, 徐珞, 叶俊丽. 胃电刺激对大鼠胃扩张反应神经元及增食欲素的影响. 世界华人消化杂志 2006; 14(4): 370-375
Revised: December 5, 2005
Accepted: December 6, 2005
Published online: February 8, 2006
AIM: To investigate the effects of gastric electri-cal stimulation (GES) on responsive neurons to gastric distension (GD) in ventromedia hypotha-lamus (VMH) and the expression of orexin in rat brain.
METHODS: Fifty-two adult Wistar rats were used in this experiment. The effects of GES on GD responsive neurons in VMH were observed by recording extracellular potentials of single neuron. GD responsive neurons were classified as GD-excitatory (GD-E) and GD-inhibitory (GD-I) ones according to their responses to GD. GES with three sets of parameters were applied for one minute respectively: GES1 (6 mA, 0.3 ms, 40 Hz, 2 s-on, 3 s-off) with standard pulse trains; GES2 with reduced on-time to 0.1 s and GES3 with decreased frequency to 20 Hz. After GES1 was using for 2 h, we observed the expression of orexin-A immunoreactive (orexin-A-IR) positive neurons in lateral hypothalamus area (LHA) by fluorescent immunohistochemistry and the content of orexin in rat brain by radioimmunoassay.
RESULTS: Ninety neurons in VMH were recorded, of which 82 (85.41%) responded to GD (3-5 mL, 10-30 s). Of the 82 GD responsive neurons, 31 (37.8%) were GD-E neurons and 51 (62.2%) were GD-I neurons. 55.0%, 17.6%, and 14.3% of GD-E neurons were excited by GES1, GES2, and GES3 respectively. More GD-E neurons were excited by GES1 than by GES2 and GES3 (P = 0.002 and 0.016, respectively). Of the GD-I neurons, 63.6%, 37.9%, and 51.9% neurons were excited by GES1, GES2, and GES3, respectively. GES2 was noted to be less effective in comparison with GES1 (P = 0.043). After GES1 was in application for 2 h, the levels of orexin-A-IR positive neurons were significantly decreased in LHA as comopared with those in control group (6.97 ± 1.51/0.1 mm2 vs 26.62 ± 8.30/0.1 mm2, P < 0.01), and the content of orexin peptide was decreased obviously in the hypothalamus (112.54 ± 11.58 fmol/mg vs 185.23 ± 15.22 fmol/mg, P < 0.01), mesencephalon (71.95 ± 8.45 fmol/mg vs 98.48 ± 12.02 fmol/mg, P < 0.05), medulla oblongata (72.36 ± 6.58 fmol/mg vs 101.29 ± 15.22 fmol/mg, P < 0.05), solitary tract nucleus (69.12 ± 4.99 fmol/mg vs 89.21 ± 9.23 fmol/mg, P < 0.05) by radioimmunoassay. However, the content of orexin peptide had no significant change in pons.
CONCLUSION: GES may activate the GD responsive neurons in VMH and the excitatory effect of GES is related to the frequency and time of stimulation. Decreased expression of orexin in the brain may also take part in the central mechanism of GES.
- Citation: Sun XR, Xu L, Ye JL. Effects of gastric electrical stimulation on responsive neurons to gastric distension and expression of orexin in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(4): 370-375
- URL: https://www.wjgnet.com/1009-3079/full/v14/i4/370.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i4.370
肥胖已成为中国面临的一个严重的公共健康问题. 其不但会导致糖尿病、高血压、癌症等诸多疾病, 还会使人早逝. 因此如何行之有效的减肥已成为医学界及营养学界专家研究的一个热点. 目前治疗肥胖的一些方法因其难以坚持, 容易反弹, 且影响身体健康而不能为广大肥胖患者所完全接受. 最近, 在西方国家兴起了一种新型肥胖治疗方法--胃电刺激疗法[1-4]. 有文献报道, 胃电刺激可减少胃窦的运动频率、抑制胃排空、减弱胃的慢波节律, 从而减少食物摄入量[5-7]. 在临床上胃电刺激可明显抑制肥胖患者的食欲并减轻患者体重[1-4]. 但胃电刺激的中枢作用机制至今仍不明了. 我们通过观察胃电刺激对大鼠下丘脑VMH的胃扩张敏感性神经元的作用以及中枢内orexin表达的影响, 探讨胃电刺激的中枢作用机制.
1.1.1 实验动物: 采用健康成年Wistar大鼠(由青岛市药检所提供), 雌雄兼备, 体质量250-350 g, 置于室温25±2℃, 12/12 h昼夜循环光照条件下生活, 自由摄食、饮水.
1.1.2 实验仪器: MEZ8201型微电极放大器; VC-Ⅱ型双道记忆示波器; QC-111J型直方图分析仪; SSEW-3301电子刺激器, 均由日本光电公司生产.
1.2.1 电生理实验: 200 g/L乌拉坦(1 g/kg)经腹腔注射麻醉大鼠. 颈部正中纵行切口, 行气管插管术. 腹部正中纵行切口, 经胃底部切口将胃内容物掏出, 以温和生理盐水清洗. 置入一薄软胶气囊, 经聚乙烯软管连至一5 mL注射器, 实验中注入生理盐水(3-5 mL, 0.5 mL/s, 37℃)扩张胃, 用以鉴别胃扩张敏感神经元[8]. 胃窦部近胃小弯侧缝合一铂金刺激电极, 电极尖端相距约0.2 cm, 关闭腹腔. 头部正中切口, 牙科钻颅骨钻孔, 切开脑膜暴露脑表面, VMH定位参照Paxions-Watson大鼠脑图谱. 坐标定位: AP -2.3--2.8 mm; L 0.5-1.0 mm; H 9.0-10.4 mm.
用液压推进器将电极送至预定深度后进行细胞外记录, 记录电极内充灌20 g/L滂胺天蓝的0.5 mol/L的醋酸钠溶液, 观察细胞电信号与噪声比在3∶1以上. 信号经MEZ-8201型微电极放大器输入VC-11双道示波器, 电信号经由示波器同步Y轴输出, 经SUMP-PC生物信号处理系统进行放电频率分析, 并绘出序列密度直方图. 以神经元放电频率的变化率超过20%作为神经元兴奋或抑制指标, 神经元表现兴奋或抑制反应可确定为GD敏感神经元. 给予3组不同参数的胃电刺激(GES1: 6 mA, 0.3 ms, 40 Hz, 2 s-on, 3 s-off; GES2: 6 mA, 0.3 ms, 40 Hz, 0.1 s-on, 4.9 s-off; GES3: 6 mA, 0.3 ms, 20 Hz, 2 s-on, 3 s-off)观察GD神经元自发放电频率的变化.
1.2.2 免疫组织化学实验: GES1电刺激胃2 h后立即用生理盐水、40 g/L多聚甲醛/PBS经心脏灌注固定. 断头取脑, 后固定2 h, 梯度蔗糖浸泡过夜, 待组织块沉底后行脑冠状连续冰冻切片, 片厚20 μm. 各组脑片均在同一水平每隔3张取1, 各组均取6张. 脑片经40 mL/L正常羊血清/0.5 mL/L Triton X-100/PBS孵育2-3 h后, 与orexin-A单克隆抗体(1∶300, Chemicon international, CA, USA)孵育液(4 mL/L NGS和0.5 mL/L Triton X-100的PBS孵育液)孵育40 h(4℃). 二抗选用羊抗小鼠Cy3-IgG(1∶500, Jackson Immunoresearch, USA)孵育2 h(避光), 0.01 moL/L PBS冲洗后, 甘油/PBS封片剂 (Citifluor, UK)封片, 激光共聚焦显微镜(Biorad, MRC1024型, 日本)下观察免疫阳性细胞.
1.2.3 放射免疫实验: 放射免疫试剂盒由上海第二军医大学提供, 脑区内orexin的提取和放免检测严格按说明书进行操作. 首先配制orexin标准液(将orexin标准品用PBS缓冲液稀释成每100 μL分别含2.5, 5, 10, 20, 40, 80, 160, 320, 640, 1 280 pg的orexin); orexin抗血清用PBS稀释至1∶8 000(orexin纯品和抗orexin兔血清为美国Sigma公司产品). 动物实验完毕, 迅速断头取脑. 将脑和垂体置于煮沸的生理盐水中煮5 min; 吸干、分离下丘脑、称重, 加1 mol/L盐酸1.0 mL制成匀浆, 室温下静置100 min. 然后加1 mol/L氢氧化钠1 mL中和, 4 000 r/min离心20 min, 取上清液测定. 测定程序: 各管加125I-orexin 100 μL, 抗orexin血清100 μL. 样品管加100-200 μL, 标准管加orexin 100 μL, 最后以磷酸缓冲液补足总反应体积为500 μL; 4℃冰箱内孵育24 h; 各管加1∶3羊抗兔血清100 μL, 继续孵育24 h, 4 000 r/min离心20 min, 弃上清液. 测沉淀物的cpm, 根据同批测定管的orexin竞争抑止曲线, 求取每mg组织中orexin-IR的含量.
统计学处理 采用软件GraphPad Prism 3.0 (GraphPad Software公司, 美国)进行统计分析, 数据以mean±SD表示, 两样本均数的比较采用t检验, 各组电刺激之间的作用差别用χ2检验, P<0.05为差异有显著性.
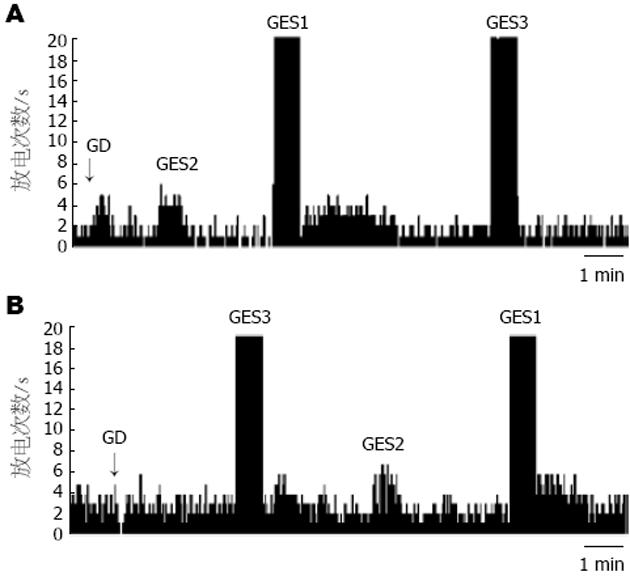
2.1.1 VMH内神经元对胃扩张刺激的反应: 52只大鼠的VMH共记录到96个神经元单位放电, 其中82个神经元(82/96, 85.41%)为GD反应性神经元; 在82个GD反应性神经元中, 51个神经元(51/82, 62.19%)为GD-I神经元, 31个(31/82, 37.80%)为GD-E神经元. 给以胃扩张刺激后, GD-E神经元的放电频率由1.51±0.33 Hz增加至2.84±0.62 Hz(P<0.01); 而GD-I神经元的放电频率却显著下降, 由1.20±0.20 Hz降至0.61±0.10 Hz(P<0.01)(图1).
2.1.2 GES对GD-E和GD-I神经元的作用: GES1、GES2和GES3使GD-E神经元兴奋率分别为55.00%, 17.64%和14.29%. GES1的作用与GES2和GES3相比有显著差异(P = 0.002 vs GES2; P = 0.016 vs GES3)(图1A). GES1作用的潜伏期为0-120 s, 持续时间为85.56±14.15 s, GD-E神经元的平均放电频率由1.50±0.34 Hz升高到2.63±0.83 Hz. 63.64%, 37.93%和51.85%的GD-I神经元分别被GES1、GES2和GES3所兴奋, GES1的作用与GES2的作用相比差别有显著意义(P = 0.043)(图1B). GES1对GD-I神经元作用的潜伏期为0-190 s, 持续时间为119.26±14.70 s, GD-I神经元的平均放电频率由1.05±0.25 Hz升高到1.49±0.30 Hz.
采用荧光免疫组化染色, 镜下可见大鼠下丘脑LHA内有orexin-A-IR神经元的表达. 该神经元胞体较大, 呈梭形或多形性. 部分神经元的突起可见有orexin-A-IR的表达(图2). 经GES1刺激胃2 h后, LHA中orexin-A-IR神经元的表达与对照组相比明显减少(26.62±8.30/0.1 mm2vs 6.97±1.51/0.1 mm2, P<0.01).
经GES1刺激胃2 h后, 下丘脑、中脑、延脑和孤束核中orexin-IR含量与对照组相比明显减少(P<0.05-0.01)(表1), 但脑桥内orexin-IR含量与对照组相比无显著差异.
1996年, Cigaina[9]首先报道了胃电刺激可以减轻肥胖模型猪的体质量, 并使处于生长期的小猪摄食量和体质量减少. 胃电刺激同样可以抑制肥胖大鼠的摄食量从而减轻大鼠体质量[10]. 临床研究也进一步证实GES可以减轻肥胖患者的体质量[1-4]. 本实验选择的胃电刺激标准参数为40 Hz/0.3 ms/2 s-on 3 s-off/6 mA. 研究结果显示, 该参数的胃电刺激可以兴奋大鼠饱食中枢-VMH的GD反应神经元. 为了进一步比较不同参数的胃电刺激对GD敏感性神经元的影响, 我们设置了刺激持续时间减少组(GES2)和刺激频率减慢组(GES3)做为对照, 结果显示GES2与GES3对GD敏感性神经元的兴奋作用都减弱, 其中GES2减弱的程度更为明显. 此结果提示, 在GES改变中枢GD敏感性神经元兴奋过程中, 刺激的持续时间及刺激频率均起着一定的影响, 其中持续时间的影响作用更为明显.
胃的牵张刺激可兴奋胃壁机械性感受器, 兴奋通过迷走传入纤维上传至脑干的孤束核(NTS)继而上传至下丘脑及其他脑区, 如海马、杏仁核、皮层等, 引起进食后系统性的情绪、心理及植物神经系统的活动反应[11,12]. 电生理学上利用对胃扩张刺激的电应答反应, 鉴定消化道机械感受性传入信息的神经途径, 用以研究参与调控胃肠机能的中枢部位及影响其活动的神经体液因素. 有文献报道, 胃电刺激抑制动物摄食主要通过改变胃肠肌电活动而影响其动力[13,14]. 本研究进一步证实了该过程是由GD反应性神经元参与完成的. 在胃电刺激作用下, VMH的GD反应性神经元兴奋性提高, 其可将电刺激传入的信号传向更高一级的中枢-海马、杏仁核、皮层或与下丘脑食欲调节网络有关的核团--弓状核、室旁核(PVN)、下丘脑外侧区(LHA)等部位的神经元相互作用, 最终使动物产生饱感而抑制摄食. 有文献报道, 胃扩张刺激可作为一种饱信号, 通过迷走神经传入中枢, 在臂旁核(PBN)可记录到发生兴奋或抑制反应的神经元, 前者主要对胃的机械刺激敏感, 但对味觉没有反应, 而后者则多为味觉敏感性神经元[15]. 已知NTS和VMH有相互纤维联系[16,17], 由此推测, 胃电刺激可作为一种饱信号由迷走神经介导而兴奋VMH的GD-E神经元, 继而通过与其他摄食敏感的神经中枢联系而产生饱感, 减少摄食. 而GD-I神经元通路的兴奋可能主要参与味觉活动的调节.
orexin由下丘脑后外侧区神经元合成, 有A, B两种亚型[18], 其作用的受体也有两种亚型-OR1 和OR2[19,20]. 其中, OR1选择性的与orexin-A结合, 而OR2则与orexin-A和orexin-B均有很强的亲和力[21]. orexin-A有调节摄食和觉醒的作用, 其促进摄食的作用比orexin-B强100倍[22]. 脑室内或下丘脑注射orexin, 动物可产生剂量依赖性摄食量增加[23,24]; 注射orexin抗体或其拮抗剂则可显著抑制饥饿动物的摄食量[25-27]. Mondal et al[28,29]用放射免疫的方法观察到orexin广泛分布于下丘脑的外侧区, VMH, 视上核(SON)、PVN和弓状核, 此外, 中脑的黑质、延髓的蓝斑核和NTS也有orexin免疫反应阳性物的分布. orexin能神经纤维及orexin特异性受体在脑干及脊髓内广泛分布, 其中投射到迷走神经复合体(DVC)的神经纤维在调控胃肠功能上起着重要的作用[22]. 本研究结果显示, GES1刺激2 h后, 下丘脑、中脑、延髓及NTS内orexin-IR明显降低, 下丘脑LHA内orexin-A-IR阳性神经元表达也显著减少. 由此推测, 电刺激胃窦部, 可能通过减少中枢内orexin的表达, 继而通过一定的传导通路抑制迷走神经活动而调节胃肠运动及消化腺分泌[30], 辅助完成对摄食的抑制作用.
总之, GES可兴奋饱中枢的GD反应性神经元和减少脑内orexin的表达, 其对神经元电活动影响的强弱与GES的强度、频率和刺激持续时间有关. 以上机制可能参与了GES治疗肥胖过程. 我们还为临床上治疗肥胖参数的选择提供了有价值的实验依据.
肥胖已经成为威胁人类健康的一大难题. 胃电刺激疗法是在西方国家兴起了一种新型肥胖治疗方法.动物实验发现, 胃电刺激可减少胃窦的运动频率、抑制胃排空、减弱胃的慢波节律,从而减少食物摄入量. 在临床上胃电刺激可明显抑制肥胖患者的食欲并减轻患者体重. 但胃电刺激的中枢作用机制至今仍不明了. 我们通过观察胃电刺激对大鼠下丘脑VMH的胃扩张敏感性神经元的作用以及中枢内or exin表达的影响, 探讨胃电刺激的中枢作用机制.
胃电刺激疗法目前已被应用于治疗肥胖, 呕吐等疾病. 关于其在临床应用中的可行性及其治疗机制的研究成为学术界的热点.
目前关于胃电刺激的相关文献主要集中在其对动物的摄食量、体质量、呕吐反应等行为学的研究以及其对胃肠动力、胃肠肌电活动的影响的外周机制的研究. 我们的研究则从脑内摄食相关核团及脑内神经肽表达入手, 开辟了更深层次的研究领域.
我们将为新兴的治疗肥胖的方法即胃电刺激疗法提供切实可靠的可行性理论支持.对不同刺激参数的效果的比较研究将为临床上胃电刺激治疗肥胖的参数的选择提供有价值的实验依据.
胃电刺激: 将一微小的刺激电极埋于胃浆膜层, 在不同的部位给予不同参数的电刺激,可以起到不同的作用. 目前的研究表明, 刺激电极埋在胃窦小弯部且给予低频电刺激可破坏胃的正常慢波运动, 延缓胃排空速度, 抑制胃窦收缩, 从而起到抑制胃运动, 减少动物摄食量的作用. 而刺激电极埋于胃大弯近贲门端且给予高频电刺激可以明显减弱胃轻瘫患者的呕吐症状.
本文明确指出了研究的背景目的和材料方法, 其实验结果与结论相符, 讨论行文条理分明, 文献引用恰当, 具有科学性和一定可读性.
电编: 张敏 编辑:菅鑫妍 审读:张海宁
| 1. | Miller KA. Implantable electrical gastric stimulation to treat morbid obesity in the human: operative technique. Obes Surg. 2002;12:17S-20S. [PubMed] [DOI] |
| 2. | D'Argent J. Gastric electrical stimulation as therapy of morbid obesity: preliminary results from the French study. Obes Surg. 2002;12:21S-25S. [PubMed] [DOI] |
| 3. | Yao S, Ke M, Wang Z, Xu D, Zhang Y, Chen JD. Retrograde gastric pacing reduces food intake and delays gastric emptying in humans: a potential therapy for obesity? Dig Dis Sci. 2005;50:1569-1575. [PubMed] [DOI] |
| 4. | Cigaina V. Gastric pacing as therapy for morbid obesity: preliminary results. Obes Surg. 2002;12:12S-16S. [PubMed] [DOI] |
| 5. | Zhu H, Chen JD. Implantable gastric stimulation inhibits gastric motility via sympathetic pathway in dogs. Obes Surg. 2005;15:95-100. [PubMed] [DOI] |
| 6. | Xu X, Zhu H, Chen JD. Pyloric electrical stimulation reduces food intake by inhibiting gastric motility in dogs. Gastroenterology. 2005;128:43-50. [PubMed] [DOI] |
| 7. | Ouyang H, Xing J, Chen JD. Tachygastria induced by gastric electrical stimulation is mediated via alpha- and beta-adrenergic pathway and inhibits antral motility in dogs. Neurogastroenterol Motil. 2005;17:846-853. [PubMed] [DOI] |
| 8. | Guan Y, Tang M, Jiang Z, Peeters TL. Excitatory effects of motilin in the hippocampus on gastric motility in rats. Brain Res. 2003;984:33-41. [PubMed] [DOI] |
| 9. | Cigaina V V, Saggioro A, Rigo V V, Pinato G, Ischai S. Long-term Effects of Gastric Pacing to Reduce Feed Intake in Swine. Obes Surg. 1996;6:250-253. [PubMed] [DOI] |
| 10. | Yin J, Chen JD. Retrograde gastric electrical stimu-lation reduces food intake and weight in obese rats. Obes Res. 2005;13:1580-1587. [PubMed] [DOI] |
| 11. | Otake K, Nakamura Y. Forebrain neurons with collateral projections to both the interstitial nucleus of the posterior limb of the anterior commissure and the nucleus of the solitary tract in the rat. Neuroscience. 2003;119:623-628. [PubMed] [DOI] |
| 12. | Schusdziarra V. Regulation of food intake. Zentralbl Chir. 1996;121:354-357. |
| 13. | Xu X, Brining DL, Chen JD. Effects of vasopressin and long pulse-low frequency gastric electrical stimulation on gastric emptying, gastric and intes-tinal myoelectrical activity and symptoms in dogs. Neurogastroenterol Motil. 2005;17:236-244. [PubMed] [DOI] |
| 14. | Ouyang H, Yin J, Chen JD. Therapeutic potential of gastric electrical stimulation for obesity and its possible mechanisms: a preliminary canine study. Dig Dis Sci. 2003;48:698-705. [PubMed] [DOI] |
| 15. | Baird JP, Travers JB, Travers SP. Parametric analysis of gastric distension responses in the parabrachial nucleus. Am J Physiol Regul Integr Comp Physiol. 2001;281:R1568-R1580. [PubMed] |
| 16. | Konturek SJ, Konturek JW, Pawlik T, Brzozowski T. Brain-gut axis and its role in the control of food intake. J Physiol Pharmacol. 2004;55:137-154. [PubMed] |
| 17. | Monnikes H, Ruter J, Konig M, Grote C, Kobelt P, Klapp BF, Arnold R, Wiedenmann B, Tebbe JJ. Differential induction of c-fos expression in brain nuclei by noxious and non-noxious colonic distension: role of afferent C-fibers and 5-HT3 receptors. Brain Res. 2003;966:253-264. [PubMed] [DOI] |
| 18. | Yamamoto Y, McKinley MJ, Nakazato M, Yamashita H, Shirahata A, Ueta Y. Postnatal development of orexin-A and orexin-B like immunoreactivities in the Eastern grey kangaroo (Macropus giganteus) hypothalamus. Neurosci Lett. 2006;392:124-128. [PubMed] [DOI] |
| 19. | Soffin EM, Gill CH, Brough SJ, Jerman JC, Davies CH. Pharmacological characterisation of the orexin receptor subtype mediating postsynaptic excitation in the rat dorsal raphe nucleus. Neuropharmacology. 2004;46:1168-1176. [PubMed] [DOI] |
| 20. | Ammoun S, Holmqvist T, Shariatmadari R, Oonk HB, Detheux M, Parmentier M, Akerman KE, Kukkonen JP. Distinct recognition of OX1 and OX2 receptors by orexin peptides. J Pharmacol Exp Ther. 2003;305:507-514. [PubMed] [DOI] |
| 21. | Ziolkowska A, Spinazzi R, Albertin G, Nowak M, Malendowicz LK, Tortorella C, Nussdorfer GG. Orexins stimulate glucocorticoid secretion from cultured rat and human adrenocortical cells, exclusively acting via the OX1 receptor. J Steroid Biochem Mol Biol. 2005;96:423-429. [PubMed] [DOI] |
| 22. | Janas-Kozik M, Krupka-Matuszczyk I. The role of orexines in appetite regulation. Psychiatr Pol. 2004;38:95-104. [PubMed] |
| 23. | Thorpe AJ, Teske JA, Kotz CM. Orexin A-induced feeding is augmented by caloric challenge. Am J Physiol Regul Integr Comp Physiol. 2005;289:R367-R372. [PubMed] [DOI] |
| 24. | Asakawa A, Inui A, Inui T, Katsuura G, Fujino MA, Kasuga M. Orexin reverses cholecystokinin-induced reduction in feeding. Diabetes Obes Metab. 2002;4:399-401. [PubMed] [DOI] |
| 25. | Yamada H, Okumura T, Motomura W, Kobayashi Y, Kohgo Y. Inhibition of food intake by central injection of anti-orexin antibody in fasted rats. Biochem Biophys Res Commun. 2000;267:527-531. [PubMed] [DOI] |
| 26. | Ishii Y, Blundell JE, Halford JC, Upton N, Porter R, Johns A, Jeffrey P, Summerfield S, Rodgers RJ. Anorexia and weight loss in male rats 24 h following single dose treatment with orexin-1 rece-ptor antagonist SB-334867. Behav Brain Res. 2005;157:331-341. [PubMed] [DOI] |
| 27. | Ishii Y, Blundell JE, Halford JC, Upton N, Porter R, Johns A, Rodgers RJ. Differential effects of the selective orexin-1 receptor antagonist SB-334867 and lithium chloride on the behavioural satiety sequence in rats. Physiol Behav. 2004;81:129-140. [PubMed] [DOI] |
| 28. | Mondal MS, Nakazato M, Date Y, Murakami N, Hanada R, Sakata T, Matsukura S. Characterization of orexin-A and orexin-B in the microdissected rat brain nuclei and their contents in two obese rat models. Neurosci Lett. 1999;273:45-48. [PubMed] [DOI] |
| 29. | Amiot C, Brischoux F, Colard C, La Roche A, Fellmann D, Risold PY. Hypocretin/orexin-contain-ing neurons are produced in one sharp peak in the developing ventral diencephalon. Eur J Neurosci. 2005;22:531-534. [PubMed] [DOI] |
| 30. | Takahashi N, Okumura T, Yamada H, Kohgo Y. Stimulation of gastric acid secretion by centrally administered orexin-A in conscious rats. Biochem Biophys Res Commun. 1999;254:623-627. [PubMed] [DOI] |