修回日期: 2006-09-10
接受日期: 2006-09-28
在线出版日期: 2006-12-18
目的: 探讨血管生成抑制剂Canstatin与细胞毒药物5-FU联合应用治疗胰腺癌的效果, 以期探索胰腺癌治疗新途径.
方法: 胰腺癌SW1990细胞(1×107/只)注射到32只裸鼠皮下, 建立胰腺癌皮下移植瘤模型. 当肿瘤长至2-3 mm时, 随机分4组, 即PBS (0.3 mL/d)对照组、5-FU (12.5 mg/(kg·d)×5 d)治疗组、Canstatin(10 mg/(kg·d)×3 wk)治疗组、及5-FU [12.5 mg/(kg·d)×5 d]+Canstatin[10 mg/(kg·d)×3 wk)]联合治疗组, 给药途径均为ip. 治疗期间, 定期用圆规和游标卡尺测量皮下移植瘤大小. 疗程结束时, 取下瘤体, 常规病理切片, 观察药物毒性反应, CD34免疫组化染色, 检测肿瘤内微血管密度(MVD).
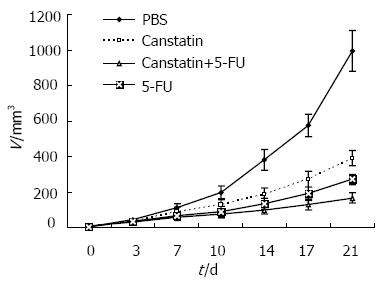
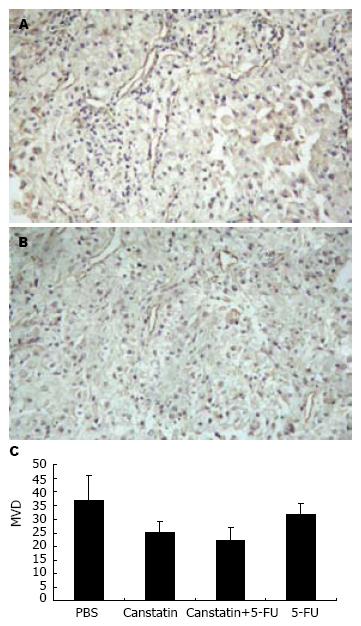
结果: Canstatin治疗组移植瘤体积从第10天起显著小于对照组(P<0.01), 5-FU治疗组第7天起就显著小于对照组(P<0.05), 而联合治疗组自第3天起, 移植瘤体积就显著小于对照组(P<0.05). 疗程结束时, 联合治疗组小鼠移植瘤体积显著小于其余各组(P<0.01), 抑瘤率最高, 达83.2%. 治疗期间, 各实验组未观察到明显毒性反应. 免疫组化染色显示, Canstatin组(25.2±3.7)和联合治疗组(22.0±4.8)治疗小鼠肿瘤组织内MVD显著低于对照组(36.8±9.4)和5-FU治疗组(31.6±4.0) (P<0.05), 而5-FU治疗组与对照组间无显著差异.
结论: 重组人Canstatin蛋白能有效抑制人胰腺癌生长, 无明显副作用, 作用机制是抑制肿瘤新血管形成, 与细胞毒药物联合使用, 具有协同作用, 为胰腺癌治疗提供了新的有力的治疗方法.
引文著录: 何小平, 朱人敏, 王震凯, 汪芳裕, 张晓华, 刘炯, 王琳. 重组Canstatin蛋白联合氟尿嘧啶治疗胰腺癌. 世界华人消化杂志 2006; 14(35): 3353-3357
Revised: September 10, 2006
Accepted: September 28, 2006
Published online: December 18, 2006
AIM: To study the anti-tumor effects of recombinant Canstatin protein plus 5-fluorouracil (5-FU) on pancreatic cancer in order to develop a new treatment modality.
METHODS: Tumor xenografts were established by subcutaneous inoculation of 1×107 SW1990 pancreatic cancer cells into the right flanks of 32 BALB/c nude mice. When the tumors reached 2-3 mm in diameter, mice were randomly divided into 4 groups: phosphate buffer solution (PBS) group were treated with PBS 0.3 mL per day for 3 weeks; Canstatin group were treated with Canstatin 5 mg/kg per day for 3 weeks; 5-FU group were treated with 5-FU 12.5 mg/kg per day for 5 days; and combination group were treated with 5-FU 12.5 mg/kg per day for 5 days plus Canstatin 5 mg/kg per day for 3 weeks. All the agents were injected intraperitoneally. During the treatment period, the subcutaneous tumors were measured by compasses and caliper every 3 or 4 days. At the end of the experiment, all the tumors were resected, and both routine pathological and immunohistochemical examinations were performed to observe the drug toxicity and intratumoral microvescular density (MVD)
RESULTS: The size of tumors treated with Canstatin was significantly decreased in comparison with that of PBS group from the 10th day after treatment (P < 0.01). In 5-FU group, the tumor size was obviously smaller than that in PBS group from the 7th day after treatment (P < 0.05), and in combination group from the 3rd day after treatment (P < 0.05). At the end of the experiment, the size of tumors in combination group was the lowest (P < 0.05), with the highest tumor suppression rate of 83.2%. During treatment, no obvious toxicity was observed. The immunohistochemical examination showed that the MVD in Canstatin group (25.2 ± 3.7) or combination group (22.0 ± 4.8) was significantly lower than that in PBS group (36.8 ± 9.4) or 5-FU group (31.6 ± 4.0)(P < 0.05). No significant difference was found in MVD between 5-FU and PBS group.
CONCLUSION: Recombinant human Canstatin protein effectively retards the growth of pancreatic cancer through inhibiting the angiogenesis of tumors, without remarkable adverse effects. Synergic anti-tumor effect is achieved as Canstatin is combined with cytotoxic drugs.
- Citation: He XP, Zhu RM, Wang ZK, Wang FY, Zhang XH, Liu J, Wang L. Efficacy of recombinant Canstatin protein plus fluorouracil in treatment of pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2006; 14(35): 3353-3357
- URL: https://www.wjgnet.com/1009-3079/full/v14/i35/3353.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i35.3353
胰腺癌无论治疗与否, 预后都很差[1-2]. 在美国, 每年有胰腺癌新增病例约27000例, 年死亡病例约26000例, 位居肿瘤死因第4位. 在我国, 胰腺癌也位居肿瘤死因前10位, 严重影响着人类的健康. 胰腺癌局部侵袭力非常强, 当产生症状并确诊时, 病程常到晚期, 手术可切除率不到20%. 治疗上通常采用联合治疗, 如联合化疗、放疗或手术切除. 尽管如此, 胰腺癌5年存活率依然不足5%[3]. 迫切需要寻找新的治疗策略. 胰腺癌和其他恶性肿瘤一样, 新生血管在其生长转移中起着关键作用[4-5]. 研究证实, 胰腺癌微血管密度(MVD)与肿瘤组织恶性程度直接相关, MVD高者预后差[6-7]. 抗血管生成治疗以肿瘤新生血管为靶点, 目的是切断肿瘤生长转移所依赖的"命脉", 成为胰腺癌治疗领域的研究热点[8-9].
Canstatin是继血管抑素和内皮抑素后新发现的一种内源性血管生成抑制剂[10-12]. 体内外实验表明, Canstatin具有抑制新生血管生成, 抑制异种移植人前列腺癌和人肾癌的生长的作用, 疗效甚至强于Endostatin, 引起人们普遍关注. 但是, Canstatin对人胰腺癌的作用如何, 尚未见报道, 其与传统化疗药物联合应用的疗效亦有待阐明. 我们在既往研究中, 成功克隆了canstatin基因[13], 并表达出活性重组人Canstatin蛋白[14], 在此基础上, 我们探讨了Canstatin蛋白联合化疗药物5-FU治疗胰腺癌的疗效, 旨在探索胰腺癌治疗新途径.
SW1990胰腺癌细胞系购于美国ATCC公司, 来源于一中度分化胰腺导管腺癌患者, 其倍增时间为64 h, 具有局部浸润转移能力. 大鼠抗小鼠CD34 IgG抗体, 购自荷兰Hbt公司. 抗大鼠第二抗体购自晶美公司. ♂SPF级BALB/c裸鼠32只, 4周龄, 体质量16-18 g, 购自上海中科院实验动物培育中心.
体外培养人胰腺癌细胞株SW1990, 取对数生长期贴壁生长细胞, 2.5 g/L胰酶消化, 离心、收集细胞后用PBS液重悬, 1000 r/min室温下离心5 min, 弃上清, 再用PBS液重悬后离心收集细胞, 调整细胞悬液浓度至1×1011个/L. 于裸鼠右肋背部皮下接种SW1990细胞, 0.1 mL/只. 至接种10 d后可见接种部位皮下长出小米粒大小硬结, 为皮下移植瘤模型建成. 32只皮下移植瘤的裸鼠, 随机分4组, 即PBS对照组(PBS 0.3 mL/d×3 wk]、Canstatin治疗组[Canstatin 5 mg/(kg·d)×3 wk)、5-FU治疗组[5-FU 25 mg/(kg·d)×5 d]及5-FU+Canstatin联合治疗组[Canstatin 5 mg/(kg·d)×3 wk+5-FU 12.5 mg/(kg·d)×5 d], 共4组, 给药途径均为ip, 疗程3 wk. 在开始治疗后分别于第3, 7, 10, 14, 17, 21 d用圆规和游标卡尺测量肿瘤大小. 肿瘤体积计算按公式: 肿瘤体积(mm3) = A×B2/2(A、B分别为经过中心点的肿瘤最大径和最小径). 同时测量小鼠体质量, 计算肿瘤生长抑制率: 肿瘤生长抑制率 = (V确定时间点对照组体积-V确定时间点治疗组体积)/V确定时间点对照组体积×100%. 动物实验结束采用颈椎脱臼法处死, 无菌条件下取出肿瘤组织, 称重, 以40 g/L甲醛固定. 为观察药物毒性反应, 同时取出实验动物的心、肝、胃、胰腺、肠等组织以40 g/L甲醛固定. 免疫组化染色采用链霉素抗生物素蛋白-过氧化酶法. 镜下微血管计数分级方法: 先在100倍光镜下选择5个血管密度高的"热点", 在200倍视野下行微血管计数, 5个视野均值为MVD. 微血管判断标准: 不以含有红细胞或出现管腔作为判断标准, 只要与周围肿瘤细胞和结缔组织成分明显区别的任何染成棕色的内皮细胞或细胞丛计数就可作为一个微血管计数, 而厚壁血管或管径大于50 μm的血管则排除在外.
统计学处理 所有实验数据结果均以均数±标准差(mean±SD)表示, 采用SPSS 10.0软件包中的重复测量资料的方差分析进行统计处理, 两两比较用非配对T-test.
32只裸鼠, 在接种部位均生长出新生物, 表明该模型构建成功率是100%. 在不同时间点测量裸鼠皮下移植瘤大小, 并计算其体积, 结果表明, Canstatin治疗组移植瘤体积从第10天起显著小于对照组(P<0.01), 5-FU治疗组第7天起就显著小于对照组(P<0.05), 到第10天时, 有非常显著差异(P<0.01), 而联合治疗组自第3天起, 移植瘤体积就显著小于对照组(P<0.05), 到第7天时, 有非常显著差异(P<0.01, 图1). 疗程结束时, 联合治疗组小鼠移植瘤体积显著小于Canstatin或5-FU治疗组(P<0.01), 抑瘤率分别为83.2%, 60.6%和72.6%.
各治疗组小鼠给药后未出现明显精神萎靡, 活动减少, 双眼微闭表现, 实验期间, 食粮无明显减少, 疗程结束时, Canstatin治疗组和5-FU治疗组与对照组相比较, 体质量无明显差异(P>0.05), 有趣的是, 联合治疗组小鼠体质量高于对照组, 经统计学检验, 有显著性差异(P<0.05, 表1). 各实验组动物心、肝、胃、胰腺、肠等脏器常规病理检查未发现明显异常.
疗程结束时, 病理切片经免疫组化染色, 以5个高倍视野计算, 各试验组MDV分别是: A组36.8±9.4; B组25.2±3.7; C组22.0±4.8; D组 31.6±4.0(图2A-C).
胰腺癌恶性程度高, 预后很差, 号称"癌中之王", 5年生存率不到5%[1-2]. 如何改善胰腺癌患者预后, 是临床医生面临的棘手问题. 近年来, 胰腺癌化疗取得重大进展, 健择取代5-FU成为胰腺癌化疗的一线药物[15-16]. 但是, 虽然健择能明显改善晚期胰腺癌患者症状, 但对患者预后的改善非常限, 与5-FU相比较, 接受健择治疗的晚期转移胰腺癌患者中位生存期仅略有升高(分别为5.6 mo和4.4 mo), 1年生存率分别是18%和2%[16]. 因此, 仍迫切需要研发治疗胰腺癌的新的有效药物.
1971年, Folkman[17]首次提出, 肿瘤生长依赖于新生血管形成, 后被大量研究所证实. 当肿瘤体积增至1-2 mm3以上时, 如果没有新生血管长入, 肿瘤组织将保持休眠状态或发生退化. 新生血管供给肿瘤生长所需要的氧和营养物质, 并带走代谢产物, 因此, 一旦血管长入肿瘤, 肿瘤将快速生长并达到难以控制的体积. 此外, 肿瘤新生血管不成熟, 结构缺乏完整性, 通透性较高, 易于肿瘤细胞发生血行转移; 同时, 因间质内压力增高, 淋巴回流加速, 也易于肿瘤发生淋巴转移. 研究证实, 新生血管在胰腺癌的生长转移中也起着关键作用, 胰腺癌MVD与恶性程度直接相关, MVD高者预后差[7-8]. 抗血管生成治疗以肿瘤新生血管为靶点, 有希望长期控制肿瘤生长, 成为胰腺癌治疗领域研究热点. 血管生成是促血管生成因子和抑制因子作用失平衡的结果[18-20]. 促血管生成因子主要是一些经典的肽类生长因子, 如: 血管内皮细胞生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)、血管生成素(Ang)、基质金属蛋白酶(MMP)、血小板衍生生长因子(PDGF)等, 其中最重要的是VEGF, bFGF和Ang. 血管生成抑制因子则包括血管抑素(angiostatin)、内皮抑素(endostatin)、组织金属蛋白酶抑制剂(TIMP)、血小板因子-4(PF-4)等[21-25]. 众多研究表明, 抑制促血管生成因子作用和/或增强血管生成抑制因子作用, 能有效抑制新生血管形成. 与既往研究结果类似, 本研究表明, 重组人Canstatin蛋白能有效抑制人胰腺癌生长, 有望成为治疗胰腺癌的新药物. Canstatin 5mg/(kg·d), ip, 治疗第10天起, 肿瘤体积显著低于对照组, 第21天时, 肿瘤体积较对照组缩小近3倍, 抑瘤率达60.6%. 治疗期间, 未观察到明显毒副作用, Canstatin治疗组小鼠体重与对照组相比无显著差异. 免疫组化结果显示, Canstatin治疗组小鼠肿瘤内MVD显著低于对照组, 提示Canstatin抗肿瘤作用是通过与抑制肿瘤新生血管生成有关. 与细胞毒药物相比, 抗血管生成治疗具有多种优点[26-27]: 首先是毒性低; 其次肿瘤内血管不成熟, 对药物反应较敏感; 另外, 当某一根毛细血管塌陷使血流中断, 可能会产生抗血管作用放大效应; 而且因内皮细胞遗传性状稳定, 不同于肿瘤细胞, 产生耐药的机会少.
另外, 本实验研究结果表明, 联合治疗组疗效最好, 自第3天起, 移植瘤体积就显著小于对照组(P<0.05), 疗程结束时, 该组小鼠移植瘤体积显著小于其余各组(P<0.01), 抑瘤率达83.2%. 这是因为抗血管生成治疗和细胞毒药物的作用机制不同, 两者合用产生了协同作用. 而且理论上讲, 抗血管生成治疗使肿瘤体积缩小到一定程度, 当肿瘤生长不再依赖新生血管时, 肿瘤便蛰伏起来, 但若和细胞毒药物联合使用, 则有可能彻底杀死肿瘤细胞. 本研究还发现, 疗程结束时, 联合治疗组小鼠体重甚至略高于对照组, 经统计学检验有显著差异(P<0.05). 这可能是因为联合应用抗血管生成药和细胞毒药物, 在未增加明显毒性反应情况下, 增强了抗肿瘤疗效, 使肿瘤负荷减轻所致.
总之, 我们的研究证实, 重组人Canstatin蛋白能有效抑制人胰腺癌生长, 其作用机制是抑制肿瘤新生血管形成. 与细胞毒药物联合应用, 能显著增强抗肿瘤效果, 为胰腺癌治疗开辟了新方法.
胰腺癌无论治疗与否, 预后都很差, 迫切需要寻找新的治疗策略. 抗血管生成治疗以肿瘤新生血管为靶点, 切断肿瘤生长转移所依赖的"命脉", 成为胰腺癌治疗领域的研究热点. 自2004-02美国FDA陆续批准Avastin, Sorafenib和Sutent等3个抗血管生成生物制剂用于晚期肿瘤治疗, 更促进了抗肿瘤血管生成治疗领域的研究进程.
理论上讲, 抗血管生成治疗使肿瘤体积缩小到一定程度, 肿瘤便蛰伏起来, 只有和细胞毒药物或放射治疗联合使用, 才有可能彻底杀死肿瘤细胞, 抗血管生成治疗和这些治疗联合使用的疗效及合理联合方案亟待深入研究.
Kamphauset al通过体外实验发现, Canstatin具有抑制内皮细胞的迁移和管状结构形成, 诱导内皮细胞调亡, 最终抑制新生血管生成的作用. 体内实验亦表明, Canstatin能有效抑制异种移植人前列腺癌和人肾癌的生长, 作用甚至强于Endostatin, 引起人们普遍关注.
本研究成功克隆了canstatin基因, 并表达出活性重组人Canstatin蛋白, 在此基础上, 证实重组人Canstatin蛋白能有效抑制人胰腺癌生长, 其作用机制是抑制肿瘤新生血管形成. 与细胞毒药物联合应用, 能显著增强抗肿瘤效果, 为胰腺癌治疗开辟了新方法.
本文证实了重组人Canstatin蛋白对胰腺癌的治疗作用及与细胞毒药物联合应用的意义, 为胰腺癌治疗开辟了新方法.
血管生成: 血管丛通过出芽的方式逐渐扩展, 形成有机的结构高度稳固的血管网络, 再分支形成较小的血管支, 新生的内皮细胞EC被周细胞(PCs)和平滑肌细胞(SMCs)覆盖, 起支撑和调节血管灌注作用, 这一过程被称为血管生成.
本文探索胰腺癌治疗新途径, 观察了血管生成抑制剂Canstatin与细胞毒药物5-FU联合应用治疗胰腺癌的效果, 内容新颖, 实验设计合理, 讨论、数据充分说明问题, 逻辑性强.
电编: 李琪 编辑: 王晓瑜
| 1. | MacKenzie MJ. Molecular therapy in pancreatic adenocarcinoma. Lancet Oncol. 2004;5:541-549. [PubMed] |
| 2. | Yamamoto M, Davydova J, Wang M, Siegal GP, Krasnykh V, Vickers SM, Curiel DT. Infectivity enhanced, cyclooxygenase-2 promoter-based conditionally replicative adenovirus for pancreatic cancer. Gastroenterology. 2003;125:1203-1218. [PubMed] |
| 3. | de Braud F, Cascinu S, Gatta G. Cancer of pancreas. Crit Rev Oncol Hematol. 2004;50:147-155. [PubMed] |
| 6. | Zhongqiu W, Guangming L, Jieshou L, Xinhua Z, Ziqian C, Kui M. The comparative study of tumor angiogenesis and CT enhancement in pancreatic carcinoma. Eur J Radiol. 2004;49:274-280. [PubMed] |
| 7. | Wang ZQ, Li JS, Lu GM, Zhang XH, Chen ZQ, Meng K. Correlation of CT enhancement, tumor angiogenesis and pathologic grading of pancreatic carcinoma. World J Gastroenterol. 2003;9:2100-2104. [PubMed] |
| 9. | Onizuka S, Kawakami S, Taniguchi K, Fujioka H, Miyashita K. Pancreatic carcinogenesis: apoptosis and angiogenesis. Pancreas. 2004;28:317-319. [PubMed] |
| 10. | Narazaki M, Tosato G. Canstatin: an inhibitor of angiogenesis and tumor growth revisited. Cancer J. 2006;12:110-112. [PubMed] |
| 11. | Kamphaus GD, Colorado PC, Panka DJ, Hopfer H, Ramchandran R, Torre A, Maeshima Y, Mier JW, Sukhatme VP, Kalluri R. Canstatin, a novel matrix-derived inhibitor of angiogenesis and tumor growth. J Biol Chem. 2000;275:1209-1215. [PubMed] |
| 12. | Hou WH, Wang TY, Yuan BM, Chai YR, Jia YL, Tian F, Wang JM, Xue LX. Recombinant mouse canstatin inhibits chicken embryo chorioallantoic membrane angiogenesis and endothelial cell proliferation. Acta Biochim Biophys Sin (Shanghai). 2004;36:845-850. [PubMed] |
| 15. | Haller DG. New perspectives in the management of pancreas cancer. Semin Oncol. 2003;30:3-10. [PubMed] |
| 16. | Tsai JY, Iannitti DA, Safran H. Combined modality therapy for pancreatic cancer. Semin Oncol. 2003;30:71-79. [PubMed] |
| 17. | Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med. 1971;285:1182-1186. [PubMed] |
| 18. | Cavallaro U, Christofori G. Molecular mechanisms of tumor angiogenesis and tumor progression. J Neurooncol. 2000;50:63-70. [PubMed] |
| 19. | Conti CJ. Vascular endothelial growth factor: regulation in the mouse skin carcinogenesis model and use in antiangiogenesis cancer therapy. Oncologist. 2002;7 Suppl 3:4-11. [PubMed] |
| 20. | Bandoh N, Hayashi T, Takahara M, Kishibe K, Ogino T, Katayama A, Imada M, Nonaka S, Harabuchi Y. VEGF and bFGF expression and microvessel density of maxillary sinus squamous cell carcinoma in relation to p53 status, spontaneous apoptosis and prognosis. Cancer Lett. 2004;208:215-225. [PubMed] |
| 21. | Kuwahara K, Sasaki T, Kuwada Y, Murakami M, Yamasaki S, Chayama K. Expressions of angiogenic factors in pancreatic ductal carcinoma: a correlative study with clinicopathologic parameters and patient survival. Pancreas. 2003;26:344-349. [PubMed] |
| 22. | Cao Y, Cao R, Veitonmaki N. Kringle structures and antiangiogenesis. Curr Med Chem Anticancer Agents. 2002;2:667-681. [PubMed] |
| 23. | Sim BK, MacDonald NJ, Gubish ER. Angiostatin and endostatin: endogenous inhibitors of tumor growth. Cancer Metastasis Rev. 2000;19:181-190. [PubMed] |
| 24. | Kirsch M, Schackert G, Black PM. Angiogenesis, metastasis, and endogenous inhibition. J Neurooncol. 2000;50:173-180. [PubMed] |
| 25. | Ren B, Hoti N, Rabasseda X, Wang YZ, Wu M. The antiangiogenic and therapeutic implications of endostatin. Methods Find Exp Clin Pharmacol. 2003;25:215-224. [PubMed] |
| 26. | Kieran MW, Billett A. Antiangiogenesis therapy. Current and future agents. Hematol Oncol Clin North Am. 2001;15:835-51, viii. [PubMed] |
| 27. | Davis DW, McConkey DJ, Abbruzzese JL, Herbst RS. Surrogate markers in antiangiogenesis clinical trials. Br J Cancer. 2003;89:8-14. [PubMed] |