修回日期: 2006-09-17
接受日期: 2006-09-28
在线出版日期: 2006-12-08
目的: 探讨MTA1基因在胃癌及癌周组织中的表达及其表达水平与胃癌浸润和转移潜能的相关性.
方法: 采用荧光定量PCR及Western印迹技术, 分别在mRNA和蛋白水平检测42例手术切除的人胃癌组织及癌旁组织中MTA 1的表达, 结合胃癌的临床生物学特征分析MTA 1表达与胃癌病理类型、淋巴结转移的关系.
结果: 胃癌组织中MTA1 mRNA相对量的表达显著高于癌旁胃黏膜组织(0.6711 vs 0.3940, P<0.01), 蛋白水平表达与mRNA一致. 低分化胃腺癌组织中的MTA1 mRNA的相对量表达显著高于中高分化胃腺癌组织(0.7475 vs 0.3460, P<0.01), 而伴有淋巴结转移的胃癌组织中MTA1 mRNA的相对量表达明显高于不伴有淋巴结转移的胃癌组织(0.8128 vs 0.4933, P<0.01).
结论: MTA1的表达与促进胃癌的转移相关, 检测 MTA1表达可作为预测胃癌生物学行为、判断胃癌患者预后的一个参考指标.
引文著录: 刘海, 胡俊波, 王志强, 卫子然. MTA1基因表达与人胃癌的浸润和转移. 世界华人消化杂志 2006; 14(34): 3317-3320
Revised: September 17, 2006
Accepted: September 28, 2006
Published online: December 8, 2006
AIM: To investigate the expression of metastasis-associated gene 1 (MTA1) in human gastric carcinoma and its correlation with tumor metastasis.
METHODS: Real time polymerase chain reaction (PCR) and Western blot were employed to detect the expression of MTA1 in gastric carcinoma and its adjacent gastric mucosa obtained from the surgical specimens of 42 patients, and the correlation between the expression of MTA1 and the differentiation and metastasis of gastric carcinoma were investigated.
RESULTS: The expression of MTA1 mRNA in gastric carcinoma was significantly higher than that in the adjacent gastric mucosa (0.6711 vs 0.3940, P < 0.01), and the expression of MTA1 protein was in accordance with that of MTA1 mRNA. MTA1 mRNA expression was markedly higher in the poorly-differentiated gastric carcinomas than that in the well- or moderately-differentiated ones (0.7475 vs 0.3460, P < 0.01). Moreover, the expression of MTA1 mRNA was dramatically increased in the gastric carcinomas with metastasis as compared with that in the ones without metastasis (0.8128 vs 0.4933, P < 0.01).
CONCLUSION: MTA1 expression is up-regulated in gastric carcinoma, which is closely correlated with the differentiation and metastasis, MTA1 may serve as a marker in predicting the biological behavior and prognosis of gastric carcinoma.
- Citation: Liu H, Hu JB, Wang ZQ, Wei ZR. Expression of metastasis-associated gene 1 and its correlation with invasion and metastasis of human gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(34): 3317-3320
- URL: https://www.wjgnet.com/1009-3079/full/v14/i34/3317.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i34.3317
胃癌是我国恶性肿瘤中发病率最高的肿瘤,高转移是其一个重要的生物学特性, 也是造成临床治疗失败的主要原因. 而淋巴结转移是公认的预后不良因素之一. 因此, 探讨胃癌淋巴结转移的相关因素对其有效遏制淋巴结转移, 判断预后及治疗方案的选择具有重要意义. 肿瘤转移相关基因1(metastasis-associated gene 1, MTA1)是近年来发现的一个与肿瘤转移密切相关的基因, 本研究主要分别从mRNA、蛋白质水平利用荧光定量PCR和Wester印迹技术对MTA1在胃癌中的表达进行研究, 探讨MTA1表达与胃癌浸润和转移潜能的相关性.
收集同济医院胃肠外科中心2003/2006年切除的胃腺癌组织标本及远离癌灶边缘5 cm无肿瘤浸润的癌旁胃黏膜组织标本42例. 男26例, 女16例, 患者年龄29-74(平均52.50)岁, 其中低分化腺癌27例, 中高分化腺癌15例. 42例中有淋巴结转移者22例, 无淋巴结转移者20例. 患者术前未经任何抗肿瘤治疗, 所有病例都经病理切片证实. 所取标本均置于-70 ℃超低温冰箱中保存备用.
按TRIzol试剂盒提供的操作步骤提取总RNA, -70 ℃保存. 利用武汉晶美公司逆转录试剂盒合成cDNA, 具体操作按试剂盒说明书中的步骤进行. cDNA产物-20 ℃保存.
1.2.1 荧光定量PCR检测: MTA1引物利用美国应用生物系统公司引物设计软件Primer Express Version 1.0设计, 上游引物为5'- GAGGAAGGGGAAATAGAAG -3', 下游引物为5'-TGTTCTTGTGGAGAGTATCC3-3'; GAPDH上游引物为5'-GACCCCTTCATTGACCTCAAC-3', 下游引物为5'-CTTCTCCATGGTGGTGAAGA-3'. 荧光定量PCR检测反应利用美国应用生物系统公司试剂盒SYBRGreen PCR Master Mix进行. 在每个25 mg反应体系中包含SYBRGreen PCR Master Mix 12.5 mL, 上下游引物各900 nmol/L, cDNA 1.0 mL. 95 ℃变性10 min; 95 ℃ 10 s, 60 ℃ 1 min, 40个循环; 72 ℃延伸10 min. 每种样本设3个重复孔. 反应在美国应用生物系统公司7000型荧光定量PCR仪上进行. 利用比较CT法检测样本的mRNA表达情况. 以正常胃黏膜为校正样本, 其mRNA值设置为1, 反应体系以甘油醛232磷酸脱氢酶(GAPDH)为内参照.
1.2.2 蛋白免疫印迹分析: 癌组织和对应癌旁组织以三去污裂解液法(按"分子克隆"配制)提取组织中蛋白, 每孔加样50 μg蛋白, 以120 g/LSDS-PAGE凝胶电泳分离, 电转印将蛋白质转移到硝酸纤维膜(NC膜), 用含50 g/L脱脂奶粉的TBST缓冲液37 ℃下封闭1 h, 将多克隆羊抗人MTA1一抗(1:1000, 美国Santa Cruz公司)和b-actin(1:200,武汉晶美), 以含50 g/L脱脂奶粉的TBST缓冲液稀释, 分别置杂交袋中37 ℃孵育1 h, TBST漂洗数次后, 在1:2000稀释的HRP标记鼠抗羊IgG中于37 ℃孵育1 h, TBST漂洗数次, 采用ECL化学发光试剂(美国Pierce生物技术公司)于暗室中进行放射自显影.
统计学处理 采用SPSS12.0软件分析结果, 定量PCR所有数据均为正态分布, 各组间MTA1表达差异采用配对t检验分析.
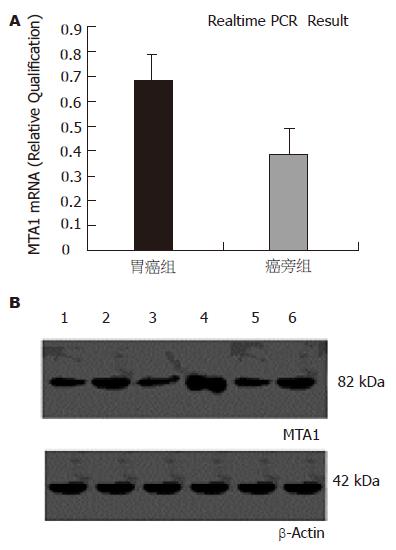
在胃癌组织中MTA1 mRNA的比例明显高于癌旁组织, 各组mRNA相对量分别为0.6711和0.3940, 二者有显著性差异(P<0.01); Western blot进一步证实, 胃癌癌组织中MTA1的蛋白表达显著高于其癌旁组织,与mRNA一致(图1).
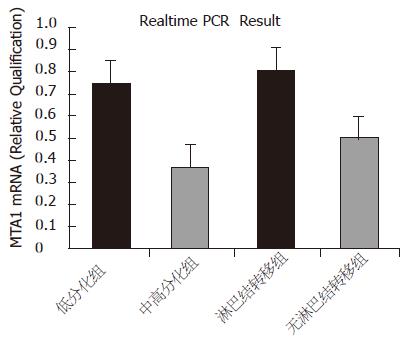
荧光定量PCR对27例低分化胃癌和15例中高分化胃癌病人的手术标本检测表明, MTA1在低分化胃癌中的相对表达比例明显高于中高分化胃癌, 分别为0.7475和0.3460, 有显著性差异(P<0.01). 22例合并有淋巴结转移者相对表达比例明显高于20例无淋巴结转移者, 分别为0.8128和0.4933, 差异有显著性(P<0.01, 图2).
肿瘤致死的主要原因是瘤细胞从原发灶转移到邻近和远隔器官, 因此了解肿瘤转移所涉及的基因和基因产物是目前国内外一项重要的研究课题. 转移是一个涉及多种基因及其产物的复杂过程,包括肿瘤细胞从原发灶脱离而侵入血管、淋巴管, 黏附内皮细胞等而停留, 在远隔部位向外浸润、诱导血管形成、逃避宿主抗肿瘤反应和在转移部位生长[1]. 肿瘤的发展是个复杂的多阶段过程: 简单的增殖-异常的增殖-癌前病变-癌症. 最近在分子遗传学上研究表明, 不同的癌基因和抑癌基因在胃癌的发生、发展上有不同的作用. 从生物学上看, 表现在两个方面:一是干扰肿瘤细胞的凋亡, 另一方面是异常细胞的增殖. 抑癌基因的失活或突变以及癌基因的激活或过表达, 其结果导致恶性转换或过增殖. MTA1基因作为一种新的肿瘤转移相关基因, 尽管其功能还不完全清楚, 但已有的研究和资料表明, 其与许多肿瘤侵袭、转移密切相关, 并在信号传导通路中发挥作用. Pencil et al[2]利用相差杂交技术首次在鼠乳腺癌细胞株中分离一新的乳腺癌转移相关cDNA克隆,经部分测序证明其在GEBANK EMBL数据库没有同源性核苷酸序列. Toh et al[3-4]测定该基因的核苷酸序列及其蛋白产物的氨基酸序列, 命名为MTA1, 并利用Southern印迹杂交法找到其对应的人类同源物MTA1. 目前, 对于其功能还不是十分清楚, 比较确切的是MTA1蛋白能与组蛋白去乙酰化酶结合, 募集去乙酰化酶到目的基因启动子区域, 通过去除组蛋白的乙酰基来重塑染色质结构, 使目的基因变得更加紧密而不利于转录[5], 因此, MTA1可通过此种功能直接或者间接作用于某些抑制肿瘤浸润转移的基因, 下调其转录.
本实验利用荧光定量PCR技术检测人MTA1 mRNA在外科切除胃癌标本中的表达, 结果发现, 42例胃癌标本中mRNA的相对表达明显高于癌周正常胃黏膜, 结合相关临床病理资料可见MTA1基因表达上调, 胃腺癌分化越低, 肿瘤的浸润及淋巴结的转移率更高. 这说明, MTA1基因的过表达与肿瘤分化和转移密切相关,可以推测MTA1 mRNA的高表达是估计胃癌恶性潜能的潜在指示因子. 这与Toh et al[6]的结论是一致的. 虽然MTA1基因在正常细胞中可能具有一定的生理功能, 但在某些癌中, 其表达量出现异常, 最终促进或导致癌转移. 该蛋白可能通过影响信号传导途径发挥其功能. 我们还通过Western印迹技术发现, 胃癌组织中82 kDa蛋白条带明显高于邻近非肿瘤组织, 进一步得出MTA1在胃癌组织中可能高表达的结论.
有研究表明, 食道癌、直肠癌和肝癌等中MTA1基因的高表达与肿瘤细胞的基底膜浸润、淋巴转移密切相关[7-9]. 这说明, MTA1基因是肿瘤浸润和转移的关键分子机制之一. Nawa et al[10]发现, 抗MTA1基因的反义寡核苷酸可以抑制高表达MTA1基因mRNA的乳腺癌细胞发生转移, 并呈剂量依赖性关系. 对MTA1基因低表达的细胞没有影响, MTA1可能是通过参与信号传导与基因表达调控一系列有关浸润转移的蛋白而起重要作用[11-12]. Iguchi et al[8]用定量PCR检测13个细胞株和23个胰腺癌组织中MTA1基因的表达情况. 均发现MTA1 mRNA表达, 然而其表达水平与发生血道远处转移的细胞株转移潜能无关. 下一步我们拟通过抑制MTA1活性, 探讨以MTA1为靶点基因治疗的可能性.
MTA1基因作为一种新的肿瘤转移相关基因, 尽管其功能还不完全清楚, 但已有的研究和资料表明, 其与许多肿瘤侵袭、转移密切相关, 并在信号传导通路中发挥作用. 虽然MTA1基因在正常细胞中可能具有一定的生理功能, 但在某些癌中, 其表达量出现异常, 最终促进或导致癌转移. 该蛋白可能通过影响信号传导途径发挥其功能. 其功能还不是十分清楚.
有研究表明, 食道癌、直肠癌和肝癌等中MTA1基因的高表达与肿瘤细胞的基底膜浸润、淋巴转移密切相关.
文章分析了肿瘤转移相关基因(MTA1)在胃癌及正常组织、转移及未转移、低分化及中高分化胃癌组织中的表达情况, 发现MTA1基因在癌、转移癌及低分化癌中表达明显增高, 认为其可作为胃癌恶性度判断的标志物, 具有一定的临床意义.
电编: 李琪 编辑:王晓瑜
| 2. | Pencil SD, Toh Y, Nicolson GL. Candidate metastasis-associated genes of the rat 13762NF mammary adenocarcinoma. Breast Cancer Res Treat. 1993;25:165-174. [PubMed] [DOI] |
| 3. | Toh Y, Pencil SD, Nicolson GL. A novel candidate metastasis-associated gene, mta1, differentially expressed in highly metastatic mammary adenocarcinoma cell lines. cDNA cloning, expression, and protein analyses. J Biol Chem. 1994;269:22958-22963. [PubMed] |
| 4. | Toh Y, Pencil SD, Nicolson GL. Analysis of the complete sequence of the novel metastasis-associated candidate gene, mta1, differentially expressed in mammary adenocarcinoma and breast cancer cell lines. Gene. 1995;159:97-104. [PubMed] [DOI] |
| 5. | Toh Y, Ohga T, Endo K, Adachi E, Kusumoto H, Haraguchi M, Okamura T, Nicolson GL. Expression of the metastasis-associated MTA1 protein and its relationship to deacetylation of the histone H4 in esophageal squamous cell carcinomas. Int J Cancer. 2004;110:362-367. [PubMed] [DOI] |
| 6. | Toh Y, Kuwano H, Mori M, Nicolson GL, Sugimachi K. Overexpression of metastasis-associated MTA1 mRNA in invasive oesophageal carcinomas. Br J Cancer. 1999;79:1723-1726. [PubMed] [DOI] |
| 7. | Toh Y, Kuninaka S, Endo K, Oshiro T, Ikeda Y, Nakashima H, Baba H, Kohnoe S, Okamura T, Nicolson GL. Molecular analysis of a candidate metastasis-associated gene, MTA1: possible interaction with histone deacetylase 1. J Exp Clin Cancer Res. 2000;19:105-111. [PubMed] |
| 8. | Iguchi H, Imura G, Toh Y, Ogata Y. Expression of MTA1, a metastasis-associated gene with histone deacetylase activity in pancreatic cancer. Int J Oncol. 2000;16:1211-1214. [PubMed] [DOI] |
| 10. | Nawa A, Nishimori K, Lin P, Maki Y, Moue K, Sawada H, Toh Y, Fumitaka K, Nicolson GL. Tumor metastasis-associated human MTA1 gene: its deduced protein sequence, localization, and association with breast cancer cell proliferation using antisense phosphorothioate oligonucleotides. J Cell Biochem. 2000;79:202-212. [PubMed] [DOI] |
| 11. | Martin MD, Fischbach K, Osborne CK, Mohsin SK, Allred DC, O'Connell P. Loss of heterozygosity events impeding breast cancer metastasis contain the MTA1 gene. Cancer Res. 2001;61:3578-3580. [PubMed] |
| 12. | Nicolson GL, Nawa A, Toh Y, Taniguchi S, Nishimori K, Moustafa A. Tumor metastasis-associated human MTA1 gene and its MTA1 protein product: role in epithelial cancer cell invasion, proliferation and nuclear regulation. Clin Exp Metastasis. 2003;20:19-24. [PubMed] [DOI] |