修回日期: 2006-08-07
接受日期: 2006-08-10
在线出版日期: 2006-12-08
目的: 探讨大鼠蛋白酶激活受体-2在应激性溃疡中的作用.
方法: 建立大鼠水浸束缚应激模型, 肉眼计算胃黏膜溃疡指数(UI); 取动脉血和胃液做血气分析计算胃黏膜内pH值(pHi); 应用分光光度计检测胃黏膜氨基己糖; 采用放射免疫方法检测血浆中6-酮前列腺素F1a(6-K)和血栓素B2 (TXB2); 观察胃组织病理形态学变化.
结果: PAR-2激动剂组pHi(4.71±0.23 vs 4.53±0.11, P<0.05)、氨基己糖(5.26±1.48 g/kg vs 1.19±0.58 g/kg, P<0.05)、6-K(856.92±165.21 ng/L vs 654.50±221.31 ng/L, P<0.05)高于阴性对照组, TXB2(338.67±12.91 ng/L vs 378.89±15.10 ng/L, P<0.05)、UI(37.50±24.42 vs 69.00±33.27, P<0.05)低于阴性对照组. 除6-K(856.92±165.21 ng/L vs687.60±219.50 ng/L, P<0.05)外, PAR-2激动剂组与奥美拉唑组相比其他参数差异无统计学意义(P>0.05), 并且两组病理形态学观察均表现为无明显血栓形成.
结论: 蛋白激酶受体-2激动剂通过促进胃黏液分泌、舒张血管起到保护胃黏膜的作用, 其机制可能是激活辣椒素敏感性感觉神经元.
引文著录: 窦勇鹰, 谢立群, 李俊美, 华建平, 海鸥, 李华. 蛋白酶激活受体-2激动剂在应激性溃疡中的作用. 世界华人消化杂志 2006; 14(34): 3306-3310
Revised: August 7, 2006
Accepted: August 10, 2006
Published online: December 8, 2006
AIM: To investigate the role of protease-activated receptor-2 (PAR-2) agonist in the formation and pathogenesis of stress ulcer.
METHODS: Water immersion-restaint method was used to induce stress ulcer model in Wistar rats. Arterial blood and gastric fluid were colleted for the blood gas analysis to obtain the gastric mucosal pH value. The levels of thromboxane B2 (TXB2) and 6-ketoprostaglandin F1 alpha (6-K) were measured by radioimmunoassay. The content of mucosal aminohexose was detected by spectro photometer, and the histopathological changes were observed.
RESULTS: The gastric mucosal pH value (4.71 ± 0.23 vs 4.53 ± 0.11, P < 0.05), the content of mucosal aminohexose (5.26 ± 1.48 g/kg vs 1.19 ± 0.58 g/kg, P < 0.05), and the level of 6-K (856.92 ± 165.21 ng/L vs 654.50 ± 221.31 ng/L, P < 0.05) were significantly higher in the rats treated with PAR-2 agonist than those in negative controls. However, except the level of 6-K (856.92 ± 165.21 ng/L vs 687.60 ± 219.50 ng/L, P < 0.05), the other indexes in the rats treated with PAR-2 agonist were not markedly different from those in the positive controls (P > 0.05), and no obvious thrombus was found in both PAR-2 agonist group and positive control group.
CONCLUSION: PAR-2 agonist can protect gastric mucosa through promoting the secretion of gastric fluid and dilation of blood vessel, which may be associated with the activation of capsaicin-sensitive nerve cells.
- Citation: Dou YY, Xie LQ, Li JM, Hua JP, Hai O, Li H. Role of protease-activated receptor-2 agonist in the formation of stress ulcer. Shijie Huaren Xiaohua Zazhi 2006; 14(34): 3306-3310
- URL: https://www.wjgnet.com/1009-3079/full/v14/i34/3306.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i34.3306
应激性溃疡(stress ulcer, SU)的发病机制非常复杂, 目前尚未完全明了. 目前认为SU的发生机制涉及机体神经内分泌失调、胃黏膜保护功能削弱及胃黏膜损伤因素作用增强等诸多方面, 主要因素为胃黏膜血流量减少. 蛋白酶激活受体-2(PAR-2)属于蛋白酶激活受体超家族成员, 是体内许多消化道腺体外分泌的直接调控者, 可活化血管内皮细胞, 影响胃肠道动力. 在胃组织中, 活化该受体可刺激辣椒素敏感性感觉神经元, 释放内源性降钙素基因相关肽、神经激肽A和P物质而发挥抑制胃酸分泌、促进黏液蛋白的分泌、短暂增加胃黏膜血流量等作用, 也可促进胃蛋白酶的分泌[1], 起到保护胃黏膜作用. 因此, PAR-2是胃黏膜疾病治疗研究的新靶点. 本实验用人工合成的PAR-2激动剂、辣椒素和奥美拉唑预防大鼠SU, 观察其效果是否有差别, 为SU发生的神经内分泌学说提供新的理论依据.
健康成年Wistar♂大鼠, 购自中国人民解放军医学科学院实验动物中心, 清洁级, 体质量190±10 g, 普通饲料喂养, 自由饮水. PAR-2激动剂为Calbiochem公司产品, 分子式为2-Furoyl-Leu-Ile-Gly-Arg-Leu-Orn-NH2, 辣椒素为Fluka公司产品, 氨基己糖为北京医科大学第三附属医院消化实验室馈赠, 6-酮前列腺素(6-K)和血栓素B2(TXB2)试剂盒购自南京建成生物工程研究所. 血气分析仪: Rapidpoint 400, Bayer; g放射免疫计数仪: 中国科学技术大学科技实业总公司; 紫外分光光度仪, TU-1800型, 北京普析通用有限责任公司.
♂Wistar大鼠40只分为阴性对照组、奥美拉唑组、PAR-2激动剂组、辣椒素组和无应激组. 阴性对照组、奥美拉唑组和PAR-2激动剂组在应激前30 min分别给予1 mL 9 g/L氯化钠溶液、5 mg/kg奥美拉唑注射液和1.5 mmol/kg PAR-2激动剂ip; 辣椒素组于0, 6, 32 h分别给予25, 50, 50 mg/kg辣椒素sc, 饲养14 d后, 于应激前30 min给予1.5 mmol/kg PAR-2激动剂腹腔注入. 大鼠禁食24 h, 造模前禁水2 h, 将大鼠四肢束缚于自制鼠板上, 限制其活动, 将其直立置于20±1 ℃水桶中, 使水平面与大鼠的胸骨剑突水平平齐. 水浸束缚应激后, 给予大鼠3 mL生理盐水灌胃, 30 min后, 予4 g/L戊巴比妥钠9 mL/kg腹腔麻醉, 仰卧固定, 常规剪毛、消毒、铺敷, 打开腹腔, 暴露胃, 双结扎法完整取胃, 用注射器取胃液, 于血气分析仪上测量胃液内PCO2. 双结扎法完整取胃, 沿胃大弯剪开, 用9 g/L氯化钠溶液冲洗胃腔内及黏膜面上的血迹, 观察溃疡、糜烂出血点发生的部位、大小、形状并计算黏膜损伤指数, 按Guth标准评估胃黏膜损伤溃疡指数(ulcer index, UI)并累计积分, 斑点、糜烂为1分, 糜烂长度<1 mm为2分, 1-2 mm为3分, 2-4 mm为4分, >4 mm为5分. 在溃疡或糜烂中心取黏膜组织2块(0.5 cm×0.5 cm), 置入40 g/L甲醛溶液中, 固定48 h、常规脱水包埋, 4 mm厚切片, HE染色. 开腹, 直视下用肝素润管的5 mL注射器于腹主动脉取血3 mL, 即做血气分析, 将剩余血37 ℃温育30 min, 后3500 r/min离心10 min, 半径3 cm, 取上清, EP管分装. 标记后置-80 ℃保存, 待测各项指标. 根据胃腔液内PCO2和动脉血HCO3-浓度. 按Henderson-Hasselbalch公式计算pHi: pHi = 6.1+log(HCO3-/PCO2×0.0307). 此处6.1是指在37 ℃时血浆中HCO3-/CO2体系的pK值; HCO3-是动脉血样品实际CO2浓度(mmol/L); PCO2是胃液内PCO2值; 0.0307是在37 ℃状态下, CO2在血浆中的溶解度(mmol/L). 应用放射免疫方法测定6-K和TXB2, 严格按照试剂盒进行操作. 胃黏膜氨基己糖含量测定采用Neuhaus法[2].
统计学处理 结果以mean±SD表示, 统计学分析用SPSS11.5软件, 均数间的比较用LSD法. P<0.05为差异有统计学意义.
阴性对照组和辣椒素组大鼠胃腔内可见少量血性积液, 黏膜面附有较多血痂, 9 g/L氯化钠溶液水冲洗后, 见黏膜充血、水肿明显, 腺胃部弥漫点线状出血灶, 损伤主要位于黏膜皱襞处. 奥美拉唑组和PAR-2激动剂组胃腔内无血性积液, 黏膜面附有少量血痂, 9 g/L氯化钠溶液冲洗后, 黏膜充血、水肿不明显, 糜烂、出血点较上述两组减少, UI下降. PAR-2激动剂组与阴性对照组比较, UI指数明显下降(P = 0.01), 与奥美拉唑比较, 无明显差别(P = 0.357), 与辣椒素组比较, UI指数明显下降(P<0.05), 辣椒素组与阴性对照组无明显差别(P = 0.385, 表1).
| 分组 | UI | pHi | 氨基己糖(g/kg) | 6-K (ng/L) | TXB2 (ng/L) |
| 阴性对照组 | 69.00±33.27 | 4.53±0.11 | 1.19±0.58 | 654.50±221.31 | 378.89±15.10 |
| 奥美拉唑组 | 26.88±14.13a | 4.72±0.47a | 5.20±2.69a | 687.60±219.50c | 359.41±16.49a |
| PAR-2激动剂组 | 37.50±24.42a | 4.71±0.23a | 5.26±1.48a | 856.92±165.21a | 338.67±12.91a |
| 辣椒素组 | 59.00±12.46c | 4.43±0.63c | 2.13±1.39c | 675.06±139.92c | 358.40±13.80c |
| 无应激组 | 4.94±0.22c | 6.21±2.67c | 969.38±82.97a | 278.86±12.38a |
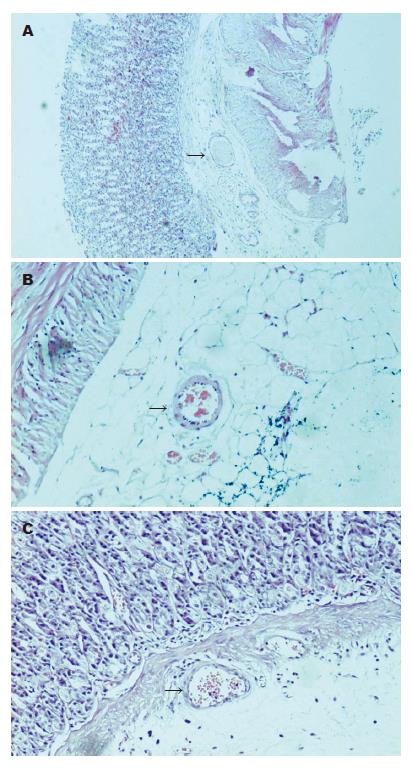
光镜下可见阴性对照组大鼠黏膜表层上皮细胞受损、脱落, 可见黏膜中断现象, 腺体结构紊乱, 间隙扩大, 其间可见炎性细胞浸润, 黏膜层、黏膜下层明显充血、水肿. 可见出血、溃疡以及黏膜糜烂, 血管内有血栓形成. PAR-2激动剂组和奥美拉唑组黏膜充血、水肿程度较阴性对照组轻, 血管内聚集红细胞(图1).
(1)PAR-2激动剂组与阴性对照组比较, pHi(4.71±0.23)比阴性对照组(4.53±0.11)明显升高(P<0.01); 氨基己糖(5.26±1.48)比阴性对照组(1.19±0.58)显著升高(P<0.01); 6-K(856.92±165.21)比阴性对照组(654.50±221.31)明显升高(P<0.05); TXB2(338.67±12.91)比阴性对照组(378.89±15.10)降低; UI(37.50±24.42)比阴性对照组(69.00±33.27)明显降低(P<0.01); 病理形态学观察, 血栓形成减少. PAR-2激动剂组与奥美拉唑组比较, pHi、氨基己糖和UI数值相近, 差异无统计学意义(P>0.05); 6-K(856.92±165.21)比奥美拉唑组(687.60±219.50)明显升高(P<0.05); TXB2(338.67±12.91)比奥美拉唑组(359.41±16.49)降低; 病理形态学观察均表现为无明显血栓形成. PAR-2激动剂组与辣椒素组比较, pHi、氨基己糖和6-K明显升高, 差异有统计学意义(P<0.05); TXB2明显下降,差异有统计学意义(P<0.05, 表1).
PAR-2激动剂对SU造成胃黏膜损伤的保护作用. 蛋白酶激活受体(protease/proteinase-activated receptors, PARs)属于与G蛋白相偶联、有7个跨膜单位的受体家族[1], PARs在血液循环、呼吸系统、神经系统和消化系统中都具有非常重要的作用, 其有4个成员: PAR-1, PAR-3和PAR-4是凝血酶受体[3-6], PAR-2是胰岛素、肥大细胞纤维蛋白溶酶、凝血因子Ⅶa和Ⅹa和其他未知蛋白水解酶的受体[3,8]. 通过蛋白水解方式把N端隐藏的激活受体暴露出来, 可激活PARs. 激活PARs后的普遍信号转导途径是由活化磷脂酶C通过Gq/11蛋白介导的[1,8]. PAR-2广泛分布于胃黏膜组织中[9]. 可通过激活辣椒素敏感性感觉神经元, 在不同类型的大鼠胃黏膜损伤模型中有胃黏膜保护作用. PAR-2激动剂可使离体大鼠胃小动脉扩张, 全身给药后, 可使麻醉大鼠胃黏膜血流量增加[10]. 目前, 国内外对预处理PAR-2激动剂后, 与预处理奥美拉唑有无区别, 以及预处理PAR-2激动剂后, 体内舒张和收缩血管因子、保护胃黏膜屏障指标有无变化研究甚少. 本实验通过预处理PAR-2激动剂后, 观察其舒张、收缩血管因子, 血栓形成因素和胃黏膜屏障等指标, 和奥美拉唑组、阴性对照组进行比较. 并通过预处理辣椒素, 观察PAR-2是否仍具有预防SU的作用.
胃黏液-碳酸氢盐屏障是构成胃黏膜防御机制的主要因素之一. 黏液覆盖于胃黏膜表面, 具有润滑作用, 可保护黏膜少受食物的机械刺激, 其黏度可使H+在黏液中的扩散速度比在水中减慢3-5倍, 从而减轻H+对黏膜的侵蚀. 黏液成分95%是水, 其他是多聚糖蛋白、电解质、肽、脂质等. 对糖蛋白组份的研究表明, 糖蛋白的碳水化合物成份有N-乙酰氨基己糖、半乳糖、N-乙酰氨基半乳糖和岩藻糖. 而N-乙酰氨基己糖含量约占23.3%[11], 测定氨基己糖含量可间接反映糖蛋白含量. 本实验结果为, 给予PAR-2激动剂后, 氨基己糖含量较阴性对照组明显升高, 和奥美拉唑组结果相近. 表明, PAR-2激动剂可以促进胃黏膜屏障分泌黏液, 其机制可能是通过激活感觉神经元后, 释放CGRP和神经激肽A, 通过CGRP1和NK2受体促进黏液分泌, 起到黏膜的细胞保护作用.
前列环素(prostacycline, PGI2)是由血管壁内皮细胞合成和释放的一种抗血小板聚集和舒张血管的生物活性物质. 生物半衰期约3 min, 迅速代谢生成6-Keto-PGF1a, 在正常生理状态下血浆或组织中血栓素A2 (thromboxaneA2, TXA2)和PGI2平衡, 失调是造成血小板凝集, 血管痉挛收缩或血栓形成的原因之一. 由于TXA2和PGI2的不稳定性, 目前难以直接测定, 故国内外均以测定TXB2和6-Keto-PGF1a作为判断其浓度的指标. 本实验证实, 给予PAR-2激动剂后, 6-K明显升高, TXB2明显下降, 表明PAR-2激动剂有明显的舒张血管作用.
pHi值作为研究胃肠功能变化的主要检测指标[12], 能够敏感反映胃肠黏膜缺氧情况, 较其他指标能更早提示病情的变化. 机体在维持其内环境和行使功能时所需要的能量直接来源于ATP的分解即ATP→ADP+Pi+H+. 当机体遭受创伤、失血感染等因素后, 组织细胞氧供缺乏, 可导致ATP的合成小于其分解而产生多余的H+, 大量的H+存在于胃黏膜内, 从而引起pHi下降. 组织细胞缺氧越严重, pHi值下降越显著. 因此, pHi值提供了部分器官组织氧合与否的判定依据. 实验结果显示, 阴性对照组pHi值明显下降, 可能是由于在SU过程中, 大鼠胃黏膜动脉收缩, 造成缺血缺氧, 导致ATP的合成小于分解而产生多余的H+, PAR-2激动剂组pHi较阴性对照组明显升高, 和奥美拉唑组比较无统计学差异, 表明, PAR-2激动剂同奥美拉唑都具有改善机体氧供缺乏的作用. PAR-2激动剂可能是通过促进NO生成, 抑制内皮素分泌, 起到扩张血管、增加组织供血供氧、增加胃黏膜血流量的作用, 并通过促进黏液分泌, 起到黏膜保护作用. 胃组织病理学观察: PAR-2组大鼠血管管径增宽, 管壁内有红细胞聚集, 但没有血栓形成, 也说明PAR-2激动剂有扩张血管的作用. 奥美拉唑是经典的质子泵抑制剂, 通过抑制胃酸的生成保护胃黏膜屏障. 在实验中发现, 奥美拉唑也可以减少黏液的耗损, 可能是因为黏液层厚度和H+浓度有关. 胃组织病理学观察, 奥美拉唑组大鼠血管内有红细胞聚集, 但没有血栓形成, 而阴性对照组血管内则有血栓形成. 通过肉眼观察Guth评分, 也可以证实PAR-2激动剂具有和奥美拉唑一样的预防应激性溃疡的作用.
总之, PAR-2激动剂是既可促进黏液、6-K分泌, 也可抑制TXB2分泌, 还可扩张血管, 改善胃黏膜血流量, 是一种潜在防治SU的药物.
患者在遭受各类重伤(包括大手术)、重病和其他应激情况下, 特别是在并发休克、出血、感染或肾、肺等脏器功能严重受损时, 均易患应激性溃疡, 出血率及病死率较高. 质子泵抑制剂可降低出血率, 但并不降低病死率.
本研究观察人工合成的PAR-2激动剂、辣椒素和奥美拉唑预防大鼠应激性溃疡效果是否有区别. 为应激性溃疡发生的神经内分泌学说提供新的理论依据, 为胃黏膜损伤的治疗提供一个重要治疗靶点.
本文实验研究结果提示蛋白激酶受体-2激动剂用于预防应激性溃疡的发生有一定效果, 该剂可能具有急性胃黏膜损伤治疗新靶点的潜在意义, 有一定新意及指导意义.
电编: 张敏 编辑:王晓瑜
| 1. | Kawabata A. PAR-2: structure, function and relevance to human diseases of the gastric mucosa. Expert Rev Mol Med. 2002;2002:1-17. [PubMed] |
| 3. | Ayala YM, Cantwell AM, Rose T, Bush LA, Arosio D, Di Cera E. Molecular mapping of thrombin-receptor interactions. Proteins. 2001;45:107-116. [PubMed] [DOI] |
| 4. | Ishihara H, Connolly AJ, Zeng D, Kahn ML, Zheng YW, Timmons C, Tram T, Coughlin SR. Protease-activated receptor 3 is a second thrombin receptor in humans. Nature. 1997;386:502-506. [PubMed] [DOI] |
| 5. | Landesberg R, Burke A, Pinsky D, Katz R, Vo J, Eisig SB, Lu HH. Activation of platelet-rich plasma using thrombin receptor agonist peptide. J Oral Maxillofac Surg. 2005;63:529-535. [PubMed] [DOI] |
| 6. | Leger AJ, Jacques SL, Badar J, Kaneider NC, Derian CK, Andrade-Gordon P, Covic L, Kuliopulos A. Blocking the protease-activated receptor 1-4 heterodimer in platelet-mediated thrombosis. Circulation. 2006;113:1244-1254. [PubMed] [DOI] |
| 7. | Cottrell GS, Amadesi S, Grady EF, Bunnett NW. Trypsin IV, a novel agonist of protease-activated receptors 2 and 4. J Biol Chem. 2004;279:13532-13539. [PubMed] [DOI] |
| 8. | Macfarlane SR, Seatter MJ, Kanke T, Hunter GD, Plevin R. Proteinase-activated receptors. Pharmacol Rev. 2001;53:245-282. [PubMed] |
| 9. | Nishikawa H, Kawai K, Nishimura S, Tanaka S, Araki H, Al-Ani B, Hollenberg MD, Kuroda R, Kawabata A. Suppression by protease-activated receptor-2 activation of gastric acid secretion in rats. Eur J Pharmacol. 2002;447:87-90. [PubMed] [DOI] |
| 10. | Kawabata A, Kinoshita M, Nishikawa H, Kuroda R, Nishida M, Araki H, Arizono N, Oda Y, Kakehi K. The protease-activated receptor-2 agonist induces gastric mucus secretion and mucosal cytoprotection. J Clin Invest. 2001;107:1443-1450. [PubMed] [DOI] |