修回日期: 2006-09-17
接受日期: 2006-09-28
在线出版日期: 2006-12-08
目的: 探讨中性粒细胞趋化因子(CINC)在急性胰腺炎相关的急性肺损害(ALI)中的作用.
方法: 分别采用ip雨蛙肽和胰胆管逆行注射50 g/L牛磺胆酸钠建立大鼠轻症、重症急性胰腺炎模型. 84只SD大鼠随机分为雨蛙肽组、生理盐水组、牛磺胆酸钠组和手术对照组. 分别检测各组不同时间点血清淀粉酶、肺干湿重比和肺组织病理学改变, 用免疫组织化学法和半定量逆转录聚合酶链反应(RT-PCR)法检测肺组织中CINC蛋白和CINC mRNA表达的变化情况.
结果: 雨蛙肽组各时间点CINC蛋白和CINC mRNA的表达与生理盐水组无明显差异(P>0.05); 牛磺胆酸钠组与手术对照组相比, 血清淀粉酶、肺干湿重比显著升高(P<0.05), 术后1 h肺组织CINC mRNA的表达开始升高(1 h: 0.23±0.07 vs 0.07±0.04,P<0.05; 3 h: 0.36±0.07 vs 0.06±0.04, P<0.05; 6 h: 0.56±0.07 vs 0.09±0.05, P<0.01; 12 h: 0.49±0.09 vs0.11±0.03, P<0.01), 术后3 h开始有CINC蛋白的表达, 随着时间的延长表达逐渐增强, 且与肺组织的病理改变呈正相关.
结论: CINC可能在胰腺炎相关的急性肺损害中起了重要的作用.
引文著录: 徐岷, 周国雄, 张尤历, 张建新, 何亚龙, 黄介飞, 张弘, 魏群. 中性粒细胞趋化因子在急性胰腺炎相关急性肺损害中的作用. 世界华人消化杂志 2006; 14(34): 3273-3277
Revised: September 17, 2006
Accepted: September 28, 2006
Published online: December 8, 2006
AIM: To investigate the role of cytokine-induced neutrophil chemoattractant (CINC) in the pathogenesis of acute lung injury (ALI) during acute pancreatitis (AP).
METHODS: AP model was induced by intraperitoneal injection of cerulein or retrograde infusion of 50 g/L sodium taurocholate into the bili-pancreatic duct in Sprague Dawley rats. A total of 84 rats were randomly divided into 4 groups: cerulein group, saline control group, sodium taurocholate group and operational control group. The level of serum amylase, the pulmonary dry/wet weight ratio and histological changes were measured at different time points in each group. The expression of pulmonary CINC protein and mRNA were detected by immunohistochemistry and semi-quantitative reverse transcriptase polymerase chain reaction (RT-PCR), respectively.
RESULTS: No significant difference was found between cerulein group and saline control group at different time points (P > 0.05). In comparison with those in operational control group, the level of serum amylase and pulmonary dry/wet weight ratio were significantly higher in sodium taurocholate group 1 h after operation (P < 0.01), and the expression of pulmonary CINC mRNA started to increase at the 1st h after operation (1 h: 0.23 ± 0.07 vs 0.07 ± 0.04, P < 0.05; 3 h: 0.36 ± 0.07 vs 0.06 ± 0.04, P < 0.05; 6 h: 0.56 ± 0.07 vs 0.09 ± 0.05, P < 0.01; 12 h: 0.49 ± 0.09 vs 0.11 ± 0.03, P < 0.01). The expression of pulmonary CINC protein was detected at 3rd h after operation, and then up-regulated gradually. Moreover, the expression of CINC was correlated with pulmonary histological changes.
CONCLUSION: CINC plays an important role in the pathogenesis of ALI during AP.
- Citation: Xu M, Zhou GX, Zhang YL, Zhang JX, He YL, Huang JF, Zhang H, Wei Q. Role of cytokine-induced neutrophil chemoattractant in acute lung injury during acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2006; 14(34): 3273-3277
- URL: https://www.wjgnet.com/1009-3079/full/v14/i34/3273.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i34.3273
急性胰腺炎(acute pancreatitis, AP)相关的急性肺损伤(ALI)常常是AP并发全身炎症反应综合征(SIRS)在肺部的表现, 严重者出现急性呼吸窘迫综合征(ARDS)、多器官功能不全(MODS). AP合并ALI, 病情凶险, 其病死率一般在40%-70%之间[1-5]. 本实验通过建立轻症急性胰腺炎(MAP)和重症急性胰腺炎(SAP)两种不同类型的AP模型, 比较不同类型模型中肺组织CINC的表达变化情况, 初步探讨CINC在AP相关的ALI中的作用.
健康♂SD大鼠84只, 清洁级, 体质量250±30 g, 由南通大学医学院动物实验中心提供. 雨蛙肽(Cerulein)和牛磺胆酸钠为美国Sigma公司产品, 兔抗大鼠GRO/CINC-1抗体为美国Assay Designs公司产品, ABC免疫试剂盒为武汉博士德公司产品, RT-PCR一步法试剂盒为芬兰Finnzymes公司产品.
1.2.1 动物模型的建立: (1)MAP模型: 雨蛙肽组和生理盐水组各18只大鼠, 禁食12 h和禁水6 h后, 雨蛙肽组大鼠给予ip雨蛙肽(浓度10 mg/L, 剂量20 mg/kg)每小时一次, 连续注射5次. 分别随机选取6只大鼠在第1次注射后6, 12, 24 h予安乐死, 心脏穿刺抽取血液3-5 mL, 4 ℃ 3000 g离心15 min, 离心后取血清, 在-70 ℃中保存; 取部分左肺组织用40 g/L中性甲醛固定24-48 h, 石蜡包埋; 部分左肺组织立即放入-70 ℃中保存. 生理盐水组给予ip与雨蛙肽组等量的无菌生理盐水, 标本采集同雨蛙肽组; (2)SAP模型: 牛磺胆酸钠组和手术对照组各24只大鼠, 大鼠术前禁食12 h和禁水6 h, 用20 g/L戊巴比妥钠(50 mg/kg) ip麻醉, 腹部皮肤消毒, 正中切口进腹, 胰胆管近端用无损伤金属夹夹闭, 向十二指肠开口方向插入注射器针头, 以0.1 mL/min的速度向胰胆管内注射50 wg/L牛磺胆酸钠, 剂量为1 mL/kg, 5 min后拔除注射针头, 松开金属夹, 缝合关腹. 手术对照组仅向胰胆管注射与牛磺胆酸钠组等量的无菌生理盐水. 分别随机选取6只大鼠在术后1, 3, 6, 12 h予安乐死, 标本采集同前.
1.2.2 标本处理: (1)血清淀粉酶测定: 采用酶法, 由美国Vitros-250型全自动生化分析仪测定; (2)肺组织病理学检查: 肺组织常规包埋切片, HE染色后行光镜观察; (3)肺干湿重比测定: 取大鼠的右肺组织, 拭去血迹后称重, 所得数值为湿重. 将肺组织放入60 ℃烤箱内72 h, 取出称重, 所得数值为干重. 肺干湿重比为肺湿重/肺干重, 反应肺组织水肿程度.
1.2.3 免疫组织化学检测: 石蜡包埋的组织标本4 mm连续切片, 常规脱蜡, 30 mL/L的H2O2阻断内源性过氧化物酶, 微波抗原修复, 三羟甲基氨基甲烷缓冲液(TBS)漂洗后, 与兔抗大鼠GRO/CINC-1抗体(工作浓度为1:50)孵育, 用TBS代替一抗作为空白对照, 再次TBS液漂洗, 用生物素化羊抗兔IgG二抗孵育, 再以TBS液漂洗, 并以0.5 g/L DAB-H2O2显色, 最后苏木素衬染及封片.
1.2.4 RT-PCR检测: 采用TRIzol试剂提取肺组织总RNA, 根据GenBank中基因序列自行设计引物(表1), 由上海生工生物工程公司合成. PCR循环条件: 55 ℃ RT反应45 min; 92 ℃预变性2 min; 92 ℃, 30 s, 55 ℃, 30 s, 72 ℃, 1 min; 循环40次; 72 ℃延伸5 min, 反应体系为50 mL. PCR产物在17 g/L凝胶上作电泳观察结果, 用凝胶图像扫描仪测定光密度值, 以GAPDH为内参照, 半定量测定CINC mRNA的表达情况.
| 基因 | GenBank_ID | 引物序列 | 产物 (bp) |
| CINC | NM_030845 | 5'- ATCGATGGTCGTTCAATTCC-3' | 310 |
| 5'- GGCATTGTGCCCTACAAACT-3' | |||
| GAPDH | X02231 | 5'- ATGGGAAGCTGGTCATCAAC-3' | 484 |
| 5'- TTCAGCTCTGGGATGACCTT-3' |
统计学处理 实验数据均用mean±SD表示, 用STATA 7.0统计软件, t检验对两组均数进行显著性检验, P<0.05为差异有显著性.
雨蛙肽组6 h淀粉酶明显升高, 12 h明显下降, 24 h已基本降至正常水平. 6 h和12 h淀粉酶均高于生理盐水组, 有显著性差异(P<0.01, 表2). 牛磺胆酸钠组术后1 h淀粉酶与手术对照组相比明显升高, 术后6 h达到高峰, 术后12 h稍有下降. 相同时间点牛磺胆酸钠组血清淀粉酶均高于手术对照组, 有显著性差异(P<0.01, 表3).
| 术后1 h | 术后3 h | 术后6 h | 术后12 h | |||||
| 手术对照 | 牛磺胆酸钠 | 手术对照 | 牛磺胆酸钠 | 手术对照 | 牛磺胆酸钠 | 手术对照 | 牛磺胆酸钠 | |
| 血清淀粉酶(nkat/L) | 43942±1950 | 69247±10385b | 57594±6951 | 156364±17203b | 43509±3417 | 207025±31923b | 33790±2784 | 165483±15770b |
| 肺干湿重比 | 3.89±0.25 | 3.97±0.21 | 3.96±0.21 | 4.31±0.25b | 3.83±0.19 | 4.74±0.38b | 3.80±0.22 | 4.93±0.39b |
| CINC mRNA | 0.07±0.04 | 0.23±0.07a | 0.06±0.04 | 0.36±0.07a | 0.09±0.05 | 0.56±0.07b | 0.11±0.03 | 0.49±0.09b |
肉眼观察: 雨蛙肽组、生理盐水组和手术对照组各时间点大鼠肺组织均未见异常. 牛磺胆酸钠组术后1, 3 h肺组织亦未见异常; 术后6 h可见肺充血水肿, 术后12 h胸腔有积液, 肺水肿加剧, 暗红色肺表面可见散在小出血点; 显微镜观察: 雨蛙肽组、生理盐水组和手术对照组各时间点镜下未见异常. 牛磺胆酸钠组术后3 h开始可见肺泡间质水肿, 少量炎性细胞浸润, 术后6 h见肺泡间隔明显增厚, 肺充血伴炎性细胞浸润, 术后12 h见肺泡内有明显出血, 肺泡间隔增宽, 灶性或片状肺不张, 大量炎性细胞浸润, 以中性粒细胞为主.
雨蛙肽组各时间点的肺干湿重比与生理盐水组相比差异无显著性(P>0.05, 表2). 牛磺胆酸钠组术后1 h的肺干湿重比与手术对照组术相比差异亦无显著性(P>0.05), 而牛磺胆酸钠组术后3-12 h的肺干湿重比均较手术对照组明显增高,有显著性差异(P<0.01, 表3) .
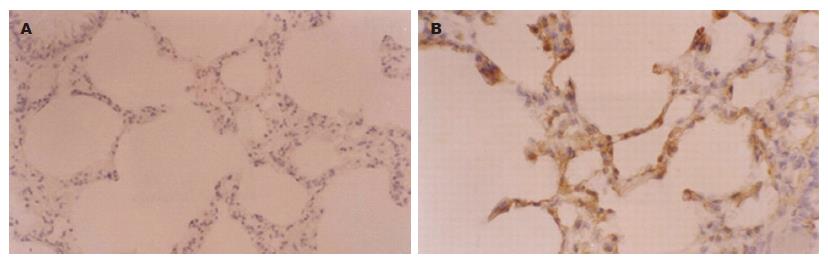
雨蛙肽组和生理盐水组各时间点均未见CINC蛋白的表达. 手术对照组亦未见CINC蛋白的表达(图1A),牛磺胆酸钠组术后3 h开始有CINC蛋白的表达, 随着时间的延长肺泡细胞中CINC蛋白的表达逐渐增强, 术后12 h表达情况与术后6 h类似(图1B).
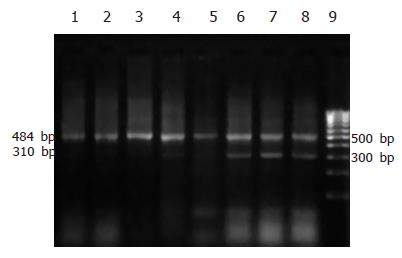
雨蛙肽组和生理盐水组之间不同时间点肺组织CINC mRNA表达无显著差异(P>0.05, 图2, 表2). 牛磺胆酸钠组不同时间点肺组织CINC mRNA表达均高于手术对照组(P<0.05或P<0.01), 且表达随时间变化逐渐增强(图3, 表3).
SAP并发MODS的机制尚不清楚, 在所有的SAP并发MODS的患者中, 都可以观察到不同程度的ALI或ARDS[6], 说明SAP早期诱发SIRS/MODS过程中, 肺脏常常是首先受损的靶器官[7]. ARDS、急性肾衰等是SAP致死的主要原因, 约60%患者1 wk内死亡原因与胰腺炎相关的ALI有关. 趋化因子(cwhemokine)是细胞因子超家族成员中一类具有白细胞趋化作用的小分子蛋白多肽, 分为CXC, CC, C和CX3C 4大类. 大鼠的CINC与人类生长相关基因蛋白-a(GRO-a)有相似的氨基酸序列, 相当于人类含ELR的CXC类趋化因子GRO-a, 以趋化中性粒细胞为主. CINC与CXC受体2有高度的亲和力, 该受体高度表达于中性粒细胞, 促使他们黏附上皮细胞、通过血管壁迁移、组织入侵, 产生氧自由基、脱颗粒和增加细胞内钙浓度, 进一步扩大炎症反应[8].
趋化因子在急性重症胰腺炎中起了重要的作用[9-12]. 研究表明SAP患者血浆中含ELR的CXC类趋化因子GRO-a, ENA-78水平明显高于轻症患者, 且上升较早, 提示血浆CXC类趋化因子的高水平似乎与SAP引起的SIRS, MODS和早期高死亡率有关[13-14]. 本实验结果显示, SAP大鼠术后1 h肺组织即有CINC mRNA表达的升高, 术后3 h免疫组化显示CINC蛋白表达升高, 同时肺干湿重比增大, 且在12 h内逐渐升高; 肺组织损伤程度以及肺干湿重比与CINC的表达呈正相关, 而手术对照组、生理盐水组和MAP大鼠肺组织CINC几乎无表达, 提示CINC的高表达可能是SAP发生ALI的原因之一, 与国外的文献报道一致[15].
我们推测, SAP通过肺组织CINC的高表达趋化了炎症细胞加重了局部炎症, 同时多形核白细胞(PMNs)在肺毛细血管聚集, 激活肺泡巨噬细胞大量释放CINC, TNF-α, IL-8, 血小板活化因子(PAF)等炎症介质, 两者互为因果关系, 形成恶性循环, 构成"第二次打击", 呼吸爆发、氧自由基、血小板聚集和微血栓形成造成肺内皮细胞、肺实质细胞和脂膜的损害, 形成瀑布效应, 最终导致SIRS和MODS[16-17]. Ulich et al[18]研究表明用抗CINC抗体能阻断60%-70%的气管内滴入LPS 所引起的肺部PMN浸润和局部炎症反应; Bhatia et al[19]用绵羊抗CINC抗体处理雨蛙肽诱导的大鼠AP模型, 虽然对胰腺局部的损害没有明显作用, 但减轻了相关的急性肺损害. 因此, 我们可以尝试通过用中和趋化因子或阻断趋化因子受体来抑制急性胰腺炎早期趋化因子的活性减少有害的免疫应答, 避免炎症反应的进一步加重, 从而到达治疗急性胰腺炎和减少并发症的目的[20].
急性胰腺炎发病率呈上升趋势, 重症患者可出现休克和腹膜炎, 病情凶险, 死亡率高.早期诊断、早期治疗仍然是临床难题. 中性粒细胞趋化蛋白(CINC)在急性胰腺炎中所起的作用逐渐受到人们的重视. CINC在急性胰腺炎的发病和病情演变过程中起何种作用, 及如何参与免疫介导的炎症反应尚不太清楚. CINC在胰腺炎相关的急性肺损害等并发症中所起作用研究甚少.
本文用两种不同的方法分别建立大鼠MAP和SAP模型, 采用免疫组化和RT-PCR等全面的检测在不同类型AP模型肺组织中CINC及其mRNA的表达情况.
本文有助于AP发病机制的认识, 为进一步阻断CINC治疗SAP提供理论依据, 为临床检测患者血液中CINC水平, 判断AP的严重程度及判断预后提供一个新的指标.
1 趋化因子是细胞因子超家族成员中一类小分子蛋白多肽(8-10 kDa),其氨基酸组成具有特异的半胱氨酸(Cys),根据其半胱氨酸排列位置的不同分为CXC、CC、C、CX3C四类, 主要生物学作用包括细胞的迁移、创伤的愈合、Th1/ Th2 细胞的发育、血管形成、肿瘤的生长和转移、感染、淋巴器官的发育、树突状细胞的成熟等.
2 中性粒细胞趋化因子(CINC)是含ELR的CXC类趋化因子,主要由激活的单核细胞、内皮细胞、成纤维细胞产生,受体是CXCR2,介导中性粒细胞的趋化、脱颗粒及呼吸爆发.中性粒细胞趋化因子(CINC)、巨噬细胞炎症蛋白-2(MIP-2)与人的GRO-α有相同的氨基酸序列,提示CINC、MIP-2是人类GRO-α同源的趋化因子,功能类似于GRO-α.
电编: 李琪 编辑:王晓瑜
| 1. | Beger HG, Rau B, Mayer J, Pralle U. Natural course of acute pancreatitis. World J Surg. 1997;21:130-135. [PubMed] [DOI] |
| 2. | Neoptolemos JP, Raraty M, Finch M, Sutton R. Acute pancreatitis: the substantial human and financial costs. Gut. 1998;42:886-891. [PubMed] [DOI] |
| 3. | McKay CJ, Evans S, Sinclair M, Carter CR, Imrie CW. High early mortality rate from acute pancreatitis in Scotland, 1984-1995. Br J Surg. 1999;86:1302-1305. [PubMed] [DOI] |
| 4. | Appelros S, Borgstrom A. Incidence, aetiology and mortality rate of acute pancreatitis over 10 years in a defined urban population in Sweden. Br J Surg. 1999;86:465-470. [PubMed] [DOI] |
| 5. | Shi C, Zhao X, Lagergren A, Sigvardsson M, Wang X, Andersson R. Immune status and inflammatory response differ locally and systemically in severe acute pancreatitis. Scand J Gastroenterol. 2006;41:472-480. [PubMed] [DOI] |
| 6. | Pearce CB, Zinkevich V, Beech I, Funjika V, Ruiz AG, Aladawi A, Duncan HD. Using the polymerase chain reaction coupled with denaturing gradient gel electrophoresis to investigate the association between bacterial translocation and systemic inflammatory response syndrome in predicted acute severe pancreatitis. World J Gastroenterol. 2005;11:7142-7147. [PubMed] [DOI] |
| 7. | Mandell GL. ARDS, neutrophils, and pentoxifylline. Am Rev Respir Dis. 1988;138:1103-1105. [PubMed] [DOI] |
| 8. | Adams DH, Lloyd AR. Chemokines: leucocyte recruitment and activation cytokines. Lancet. 1997;349:490-495. [PubMed] [DOI] |
| 9. | Hotz HG, Reber HA. Acute pancreatitis. Curr Opin Gastroenterol. 1999;15:392. [PubMed] [DOI] |
| 10. | Sun J, Bhatia M. Blockade of neurokinin 1 receptor attenuates CC and CXC chemokine production in experimental acute pancreatitis and associated lung injury. Am J Physiol Gastrointest Liver Physiol. 2006;292:G143-G153. [PubMed] [DOI] |
| 11. | Sugita H, Yamaguchi Y, Ikei S, Yamada S, Ogawa M. Enhanced expression of cytokine-induced neutrophil chemoattractant (CINC) by bronchoalveolar macrophages in cerulein-induced pancreatitis rats. Dig Dis Sci. 1997;42:154-160. [PubMed] [DOI] |
| 12. | Makhija R, Kingsnorth AN. Levels of the chemokines growth-related oncogene alpha and epithelial neutrophil-activating protein 78 are raised in patients with severe acute pancreatitis (Br J Surg 2002; 89: 566-72). Br J Surg. 2002;89:1194. [PubMed] [DOI] |
| 13. | Shokuhi S, Bhatia M, Christmas S, Sutton R, Neoptolemos JP, Slavin J. Levels of the chemokines growth-related oncogene alpha and epithelial neutrophil-activating protein 78 are raised in patients with severe acute pancreatitis. Br J Surg. 2002;89:566-572. [PubMed] [DOI] |
| 14. | Rau B, Baumgart K, Kruger CM, Schilling M, Beger HG. CC-chemokine activation in acute pancreatitis: enhanced release of monocyte chemoattractant protein-1 in patients with local and systemic complications. Intensive Care Med. 2003;29:622-629. [PubMed] [DOI] |
| 15. | Brady M, Bhatia M, Christmas S, Boyd MT, Neoptolemos JP, Slavin J. Expression of the chemokines MCP-1/JE and cytokine-induced neutrophil chemoattractant in early acute pancreatitis. Pancreas. 2002;25:260-269. [PubMed] [DOI] |
| 16. | Liu XM, Liu QG, Xu J, Pan CE. Microcirculation disturbance affects rats with acute severe pancreatitis following lung injury. World J Gastroenterol. 2005;11:6208-6211. [PubMed] [DOI] |
| 17. | Andican G, Gelisgen R, Unal E, Tortum OB, Dervisoglu S, Karahasanoglu T, Burcak G. Oxidative stress and nitric oxide in rats with alcohol-induced acute pancreatitis. World J Gastroenterol. 2005;11:2340-2345. [PubMed] [DOI] |
| 18. | Ulich TR, Howard SC, Remick DG, Wittwer A, Yi ES, Yin S, Guo K, Welply JK, Williams JH. Intratracheal administration of endotoxin and cytokines. VI. Antiserum to CINC inhibits acute inflammation. Am J Physiol. 1995;268:L245-L250. [PubMed] |
| 19. | Bhatia M, Brady M, Zagorski J, Christmas SE, Campbell F, Neoptolemos JP, Slavin J. Treatment with neutralising antibody against cytokine induced neutrophil chemoattractant (CINC) protects rats against acute pancreatitis associated lung injury. Gut. 2000;47:838-844. [PubMed] [DOI] |
| 20. | Bhatia M, Hegde A. Treatment with antileukinate, a CXCR2 chemokine receptor antagonist, protects mice against acute pancreatitis and associated lung injury. Regul Pept. 2007;138:40-48. [PubMed] [DOI] |