修回日期: 2006-09-17
接受日期: 2006-09-27
在线出版日期: 2006-12-08
目的: 研究实验性萎缩性胃炎(CAG)大鼠胃黏膜主细胞、壁细胞和G、D细胞及外周血胃泌素(GAS)、生长抑素(SS)的变化, 探讨CAG发生的可能机制.
方法: 综合采用1 mL/L的氨水和20 mmol/L去氧胆酸钠及600 mL/L的乙醇及建立大鼠CAG模型, 观察模型大鼠胃黏膜病理组织学的变化, 采用病理学方法和免疫组织化学方法观察大鼠胃黏膜主、壁细胞和G、D细胞的变化情况, 测定外周血GAS、SS水平.
结果: 模型大鼠胃窦黏膜炎症、腺体萎缩改变明显, 部分出现了肠上皮化生, 模型大鼠胃黏膜主细胞(7.94±2.36 vs 13.13±4.26, t = 3.014, P = 0.005)壁细胞(22.89±7.28 vs 39.07 ± 7.17, t = 4.479, P = 0.005)数及G、D细胞数(33.75±7.34 vs 68.76±21.75, t = 4.314, P = 0.025; 21.21±5.83 vs 31.37±7.80, t = 2.953, P = 0.01)较正常大鼠主、壁细胞,及G、D细胞数明显减少, 血清GAS含量(118.38±13.62 ng/L vs 139.25±17.32 ng/L, t = 2.679, P = 0.025)、血浆SS含量(570.04±64.37 ng/L vs 435.28±38.18 ng/L, t = 5.092, P = 0.0005)分别较正常大鼠降低和增高.
结论: 大鼠CAG的发生与胃黏膜屏障的破坏, 主、壁细胞和G、D细胞数的减少, 导致胃蛋白酶、胃酸分泌异常及GAS、SS等胃肠激素的神经内分泌调节机制紊乱有关.
引文著录: 朱方石, 姒健敏, 王良静, 王冬飞, 陈萍. 萎缩性胃炎大鼠胃黏膜主、壁细胞和G、D细胞及外周血胃泌素、生长抑素的变化. 世界华人消化杂志 2006; 14(34): 3261-3267
Revised: September 17, 2006
Accepted: September 27, 2006
Published online: December 8, 2006
AIM: To study the changes of chief, parietal cells and G, D cells in gastric mucosa as well as blood levels of gastrin (GAS) and somatostaitin (SS) in chronic atrophic gastritis (CAG) rats, and explore the possible mechanism of CAG generation.
METHODS: The rat models of CAG were made with 1 mL/L ammonia water, 20 mmol/L sodium deoxycholate and 600 mL/L ethanol, and the histopathological changes of gastric mucosa were observed. Pathological method and immunohistochemical staining were used to investigate the changes of chief, parietal cells and G, D cells in gastric mucosa and measure the blood levels of GAS and SS in CAG rats.
RESULTS: Obvious inflammation of gastric pyloric mucosa and glandular atrophy were observed, and intestinal metaphases occurred in some parts of mucosa. The numbers of gastric mucosal chief and parietal cells (7.94 ± 2.36 vs 13.13 ± 4.26, t = 3.014, P = 0.005; 22.89 ± 7.28 vs 39.07 ± 7.17, t = 4.479, P = 0.005) as well as the numbers of G and D cells (33.75 ± 7.34 vs 68.76 ± 21.75, t = 4.314, P = 0.025; 21.21 ± 5.83 vs 31.37 ± 7.80, t = 2.953, P = 0.01) were significantly decreased in the model rats as compared with those in the normal rats. The serum GAS level was markedly lower in the model rats than that in the normal ones (118.38 ± 13.62 ng/L vs 139.25 ± 17.32 ng/L, t = 2.679, P = 0.025), but the plasma SS level was notably higher in the model rats (570.04 ± 64.37 ng/L vs 435.28 ± 38.18 ng/L, t = 5.092, P = 0.0005).
CONCLUSION: The occurrence of CAG is associated with the damages of gastric mucosal barrier, decrease of mucosal chief and parietal cells, which leads to the abnormality and GAS and SS secretion.
- Citation: Zhu FS, Si JM, Wang LJ, Wang DF, Chen P. Changes of gastric mucosal chief and parietal cells and G, D cells as well as blood gastrin somatostaitin levels in rats with chronic atrophic gastritis. Shijie Huaren Xiaohua Zazhi 2006; 14(34): 3261-3267
- URL: https://www.wjgnet.com/1009-3079/full/v14/i34/3261.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i34.3261
自1980年"WHO专家会议"对"胃癌前病变的组织学定义"规定以来, 由慢性胃炎→胃黏膜萎缩肠化→异型增生→胃癌这一病变演化模式过程已为国内外众多学者所认同[1]. 因此, 探讨慢性萎缩性胃炎(chronic atrophic gastritis, CAG)的发生机制对CAG癌变的干预阻断研究和胃癌的一级预防有着重要意义. 近年来, 普遍研究认为CAG的发生、发展与胃黏膜腺体主细胞、壁细胞损害和G、D细胞密度及细胞数值的变化相关[2-4], 而对外周血中胃泌素(GAS)、生长抑素(SS)的含量变化与CAG的关系则认识不一. 我们通过模拟CAG发生的因素建立大鼠模型, 观察胃黏膜病理组织学的改变和主、壁细胞, G、D细胞的变化以及外周血GAS、SS的水平, 以探讨CAG发生的病理机制.
成熟SD大鼠, 清洁级, 一级质量标准, 体质量200±10 g, 由浙江学省实验动物中心提供, 空调下饲养, 温度20±1 ℃, 湿度50%-60%, 光照每12 h明暗交替, 通风8-15次/h, 食用浙江大学医学院实验动物中心提供的全营养颗粒饲料. NH3 25.0%-28.0%分析纯, 中国瓶窑医药化工试剂厂生产, 批号: 20000914. 去氧胆酸钠, Serva公司生产, 上海化学试剂采购供应站进口分装经销, 批号: 980511. DAKO免疫组织化学显色系统, 中山生物试剂公司. 兔抗大鼠GAS抗体, 武汉博士德公司, 批号: BA0245. 兔抗大鼠SS抗体, 第二军医大学经生物学教研室. 酶标记HRP二抗, 美国DAKO公司. GAS酶联免疫试剂盒, 美国Lifkey公司. SS放免试剂盒, 第二军医大学神经生物学教研室. Model-556型Bio-RAD酶标仪, 日本富生公司. XH-6020g放免计数仪及放免数据处理系统, 西安262厂. DMLB荧光显微镜及Lelca Qwin图像分析系统, 德国Leica公司.
1.2.1 造模与分组: 根据本课题组曾经报道的综合法(姒氏法)[5-6]制作CAG模型. 用含NH3 25.0%-28.0%分析纯, 配制成浓度为1 g/L的氨水自由饮用, 每天记录饮量; 用去氧胆酸钠加蒸馏水配制成20 mmol/L的溶液, 每日灌胃一次, 其中在每周一、四晚撤除饲料, 次日(周二、周五)上午9时行空腹灌胃, 对体质量<200 g, 200-250 g和>250 g的大鼠, 灌胃剂量分别为1.0, 1.5和2.0 mL; 用600 mL/L的乙醇每周二、五空腹灌胃, 剂量同上, 处理24 wk. 取同期饲养的正常SD大鼠8只设为正常对照组(A组), 另取造模成功的CAG大鼠8只设为模型组(B组), 与对照组大鼠同期处死, 取全胃标本.
1.2.2 标本制备: 剖腹取出全胃, 沿大弯侧切开, 生理盐水冲洗, 40 g/L中性甲醛固定、酒精脱水、二甲苯将组织透明, 后进行浸蜡、包埋, 制成4-5 mm的石蜡切片, 进行HE染色, 光镜下观察. 另在胃窦、体交接处取5 mm×5 mm标本, 25 g/L戊二醛和20 g/L 四氧化锇双重固定, 乙醇脱水, 醋酸异戊脂过度, 临界点干燥, 标本黏样, 留以电镜观察.
1.2.3 胃黏膜炎症观测: 参照1994年美国休斯顿胃炎诊断标准, 采用半定量法, 光镜低倍镜下观察整个胃黏膜. 在胃窦部取10个视野, 按炎细胞浸润的程度分为0-3 7个级别. (0级: 无炎症; 0.5级: 镜下观察炎症介于0与l之间; l级: 在胃小凹区或固有腺底部可见多个慢性炎性细胞浸润; 1.5级: 镜下观炎症介于l与2之间; 2级: 在胃黏膜小凹至黏膜肌层均有较多炎细胞浸润; 2.5级: 镜下观察炎症介于2与3之间; 3级: 胃黏膜内可见成堆炎细胞聚集灶). 记录胃大、小弯侧的炎症情况, 再将两者平均, 得出胃黏膜炎症级别. 此外, 测量L1/L2值(黏膜腺体厚度L1/黏膜肌层厚度L2)、统计胃窦部1 mm长度内腺体数. 每张切片取胃窦部黏膜5个视野, 用测微器测出每个视野的胃窦黏膜腺体厚度, 计平均值; 另测出距幽门环200-1200 mm之间(即1 mm范围)胃窦固有腺体总个数.
1.2.4 主、壁细胞及G、D细胞观察: 在荧光显微镜下(HE×400), 每张切片取胃窦部5个视野, 通过Lelca Qwin图像分析系统(定标测量每视野图实际面积为33 547.8 mm2), 读取主、壁细胞数, 由计算机软件系统, 分别统计每视野图中主、壁阳性细胞均数. 采用免疫组织化学方法(Envision系统二步法), 将石蜡切片烤片、二甲苯脱蜡、酒精脱水, 蒸馏水漂洗, 浸入TBS(洗涤液)中3 min, 加30 mL/L H2O2溶液阻断内源性过氧化酶, 蒸馏水漂洗后, 置入1 g/L柠檬酸缓冲液中, 在微波炉中95 ℃加热15 min抗原修复, 自然冷却, TBS漂洗10 min, 根据检测G、D细胞的不同, 各组切片上分别滴加GAS一抗(1:500)和SS一抗(1:600)各50 mL , 孵育30 min; 阴性对照片PBS代替一抗, TBS漂洗10 min, 滴加EnVision HRP(辣根过氧化酶)二抗100 mL, 孵育30 min, TBS漂洗10 min, 加DAB显色液, 孵育10 min, 蒸馏水漂洗, 苏木素复染20 s, 脱水、透明、封片. 在荧光显微镜下(×400), 每张切片取胃窦部5个视野, 通过Lelca Qwin图像分析系统(定标测量每视野图实际面积为373 800 mm2), 读取G、D阳性细胞数, 计算其免疫组织化学显色阳性细胞灰度值.
1.2.5 血清GAS含量检测: 采用ELISA法, 将两组大鼠断头处死, 取颈动脉血5 mL(分为2管, 各2.5 mL, 另一管加1 g/L肝素25 mL抗凝和抑肽酶1250 U用作血浆SS检测), 将1管1500 r/min离心5 min, 取10 mL血清, 分别加入包被好抗原的96孔酶标板的孔板中, 每孔中加入GAS抗体50 mL和POD(缓冲液)50 mL, 轻轻混匀30 s, 封住盖板, 室温孵育45 min, 弃除混合物, PBS洗涤5次, 甩尽板内液体, 用吸水纸拍干, 加入100 mL的TMB(酶底物), 轻轻混匀10 s, 室温孵育20 min, 加入100 mL终止液, 混匀30 s后, 在酶标仪450 nm波长下, 测A值, 计算血清中GSA含量.
1.2.6 血浆SS含量检测: 采用RIA法, 将加入肝素和抑肽酶的全血离心, 取血浆, 在试管上分别标上管号, 标准品管中各加入100mL不同浓度的标准品, 实验管中各加入300 mL待测血浆; 所有管中分别加入SS 抗血清100 mL和缓冲液200 mL, 4 ℃孵育24 h后, 分别加入125I-AVP 100 mL混匀, 再次4 ℃孵育24 h, 加分离剂500 mL, 混匀, 室温放置45 min后, 4000 r/min离心, 20 min, 弃上清, 上放免计数仪测定cpm值, 由放免数据处理系统绘制标准曲线并计算SS含量.
统计学处理 应用SPSS10.0统计学软件, 采用t检验处理分析各组实验数据, P<0.05为差异具有显著性.
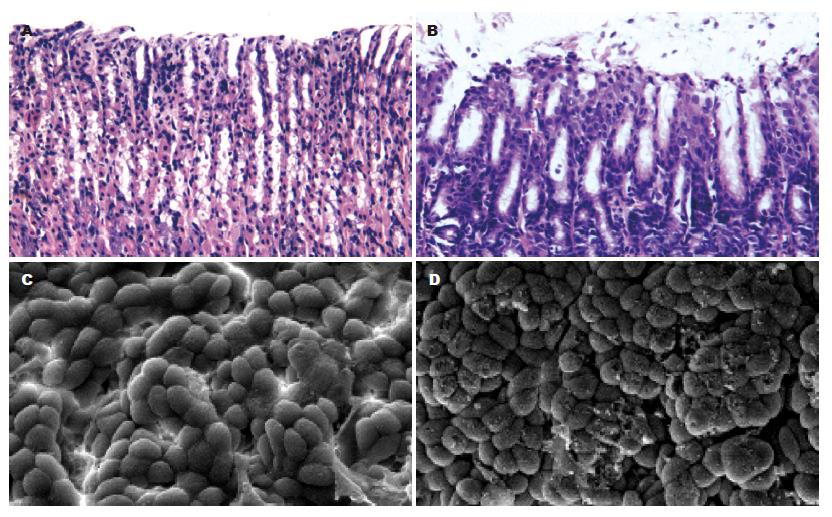
经HE染色光镜下观察, 正常组大鼠显示为正常的胃黏膜图像; 而模型组胃黏膜腺体减少, 排列紊乱, 黏膜肌层增厚, 向黏膜固有层伸展, 呈分枝状插入腺体之间, 并伴有明显炎性细胞浸润, 部分出现了肠化(图1A-B). 扫描电镜下, 模型组大鼠与正常胃黏膜比较, 见表面破溃脱落, 黏液减少(图1 C-D).
模型组大鼠的炎症级别和L1/L2值、1 mm长度内腺体数分别高于和低于正常大鼠(P<0.01); 模型组胃液pH值呈下降趋势, 但无显著性差异(P>0.05, 表1).
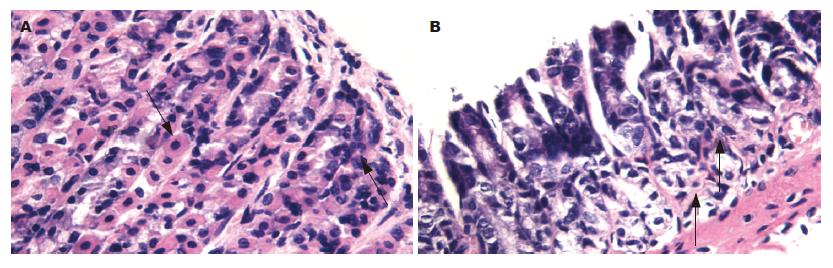
主细胞主要分布在胃腺体的下半部或下1/3管壁, 呈单层立方或柱状, 胞核呈球形, 细胞质为空泡状结构, 呈蓝色纹状(图2A中右侧箭头所指). 壁细胞呈锥形, 其长边在腺体基底膜侧, 尖顶呈楔形挤入邻近主细胞之间, 壁细胞与邻近主细胞或黏液细胞的边界较平整, 有典型的闭锁小带和桥粒, 通常有一个大的圆形核, 位于细胞中央呈蓝色,胞质呈桃红色(图2B中左侧箭头所指). 模型组大鼠较正常组大鼠胃黏膜主、壁细胞数明显下降, 两组比较有显著性差异(P<0.01,表2).
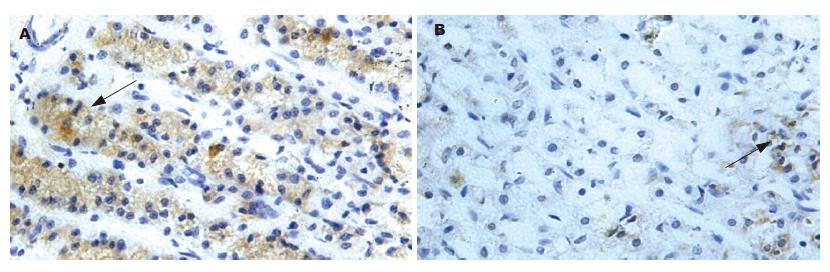
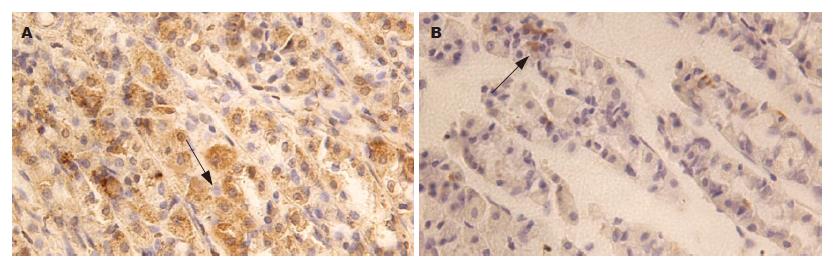
G、D细胞阳性反应为胞质内棕黄色或淡棕色颗粒, 部分呈棕褐色,细胞分布不均匀, 常单个或几个夹在腺细胞之间, 对照片为阴性. 胃窦部G细胞较多, 主要分布在胃窦黏膜腺体的中下1/3, 呈圆形、椭圆形、梭形或不规则,有的连续在一起形成团带状. D细胞数量较G细胞少, 分布稍弥散, 主要分布在胃窦黏膜的下1/3, 偶见于黏膜中上部. D细胞形态与G细胞相似, 有的发出细长突起, 伸向邻近细胞(图3-4). 模型组大鼠G、D细胞数及其阳性染色灰度值均较正常组大鼠明显降低, 两组比较有显著性差异(P<0.01和P<0.05, 表3).
1998年病理专家提出慢性萎缩性胃炎(CAG)以进行性胃腺体丢失和肠化为特征, 与胃癌发生密切相关, 并将其列为癌前状态[7], 其癌变率在2%-8%[8]. CAG的病因至今尚未完全明了, 一般认为由Hp杆菌感染、自身免疫机制和遗传因素、胃壁屏障功能降低如十二指肠液反流、胃黏膜损伤因子等多因素综合作用所致[9], 但公认的形成机制是各种致病因素的长期刺激或继发的宿主炎症反应, 导致胃黏膜深层损害和腺体的破坏, 使胃黏膜不能完全修复再生, 从而形成胃黏膜腺体萎缩和(或)肠化[10]. 我们采用综合法造成胃黏膜的损害, 建立了稳定的大鼠CAG模型, 病理组织学显示, 黏液分泌减少, 腺体数目和腺体厚度降低, 黏膜肌层增厚, 固有膜中有炎性细胞的浸润, 说明综合法造模对胃黏膜的刺激因素已损害了胃黏膜屏障, 导致了大鼠胃黏膜腺体的萎缩.
壁细胞主要由胃黏膜腺体峡部的干细胞增殖分化形成, 又称泌酸细胞, 主要分泌盐酸; 主细胞位于腺体基底部, 主要分泌胃蛋白酶原. 正常情况下, 二者共同参与了胃酸分泌和调节, 发挥其增强胃黏膜屏障机制的作用. 已有研究证实, CAG胃黏膜萎缩、胃液pH值增高的低酸状态与壁细胞数减少、盐酸分泌不足和主细胞数的降低、胃蛋白酶原分泌下降有关, 且超微结构研究显示壁细胞线粒体及主细胞溶酶体、高尔基体和酶原颗粒明显减少[2-3,11]. 由于壁细胞数的减少及细胞内成分结构的改变, 使盐酸分泌下降, 导致酸性黏液减少, 削弱了胃黏膜屏障的保护作用. 有人研究表明, 壁细胞数的下降伴随胃底腺消失、干细胞增多、主细胞和颈黏液细胞的减少而变化, 壁细胞数的减少直接影响主细胞和颈黏液细胞的分裂和迁移[12]; 同时, 主细胞数的下降, 胃蛋白酶原释放随之减少, 且由于低酸环境使胃蛋白酶原转变为活性胃蛋白酶的能力减退, 分解蛋白的作用随之下降, 加重了胃黏膜营养的吸收障碍和腺体的萎缩. 本研究结果CAG大鼠胃黏膜主、壁细胞较正常大鼠明显减少, 证实了胃黏膜腺体主、壁细胞数的变化与CAG发病相关的病理机制. 在人体胃窦部腺体中, 亦散在分布着较多的内分泌G、D细胞, G细胞分泌GAS, 以多种不同的分子形式, 储存于血液、组织及胃肠液中, 可刺激壁细胞和主细胞而促进胃酸、胃蛋白酶分泌, 增加胃肠黏膜细胞的分裂增殖, 增加DNA、RNA的合成及胃黏膜血流量, 并具有营养胃黏膜及壁细胞群的作用[4,13-14]; D细胞合成和分泌SS, 存在于胃肠壁神经丛、下丘脑、胃组织、胰液、胃肠液及血循环中, SS可抑制胃酸和胃蛋白酶分泌, 亦可抑制GAS释放, 二者在功能上相互协调, 共同维持着胃肠的生理功能[14-16]. 有研究表明, G、D细胞密度与胃窦黏膜萎缩程度相关, 随着胃黏膜腺萎缩程度的加重而明显减少, 甚至有学者认为, G细胞计数是一项反映肠化生严重程度的敏感指标[4]. 本研究结果显示CAG大鼠G、D细胞数较正常大鼠明显减少, 亦佐证了这一理论.
GAS是胃酸分泌的主要调节激素, 由G细胞分泌, 其分子量2100, 是含有l7个氨基酸的多肽, G细胞大部分位于胃窦腺体的颈部和基底部, 部分位于十二指肠近端黏膜中, 其分泌受多种因素的影响[17]. GAS通过直接刺激壁细胞的胃泌素受体而刺激壁细胞分泌胃酸, 也间接通过ECL细胞的胃泌素受体刺激ECL细胞释放组胺, 再以旁分泌方式激活壁细胞H受体而使之泌酸, 对胃黏膜具有营养和促增生作用[18]; GAS分泌受胃内pH、进食、胃内压变化、生长抑素和其他胃肠激素及交感神经兴奋等诸多因素的影响[19], 同时GAS分泌又可引起近端胃舒张、胃窦收缩的作用[20]. 而SS是一种对外分泌、内分泌、旁分泌及自分泌均起作用的调节肽[21], 对消化系统的生物学作用主要是抑制, 抑制胃泌素等各种胃肠激素的分泌, 亦可抑制胃肠运动和黏膜细胞的增生, 减少胃肠道壁血流量, 抑制胃酸、胃蛋白酶、胰液分泌. GAS可直接作用于D细胞而刺激SS分泌, 而SS又可抑制GAS的分泌, 二者间具有独特的区域性调节作用[20]. 但近年来对GAS、SS在CAG模型动物或患者外周血中含量水平高低有不同的认识, 其研究结果报道也不一致. 就GAS而言, 普遍认为, 当胃窦黏膜发生进行性萎缩时, G细胞的减少, 导致了GAS分泌下降, 使其含量减少[22-23]; 但亦有学者认为, 由于胃黏膜萎缩, 胃酸分泌减少, 可反馈性地作用于G细胞, 刺激了GAS释放, 使其含量增加[24]. 而对SS含量变化有不少研究表明, CAG外周血或胃黏膜中SS含量显著低于正常, SS含量下降的原因是D细胞数目减少, 使其分泌SS减少所致; 并发现随萎缩病变的加重, SS呈下降趋势[19,25]. 本研究显示, CAG大鼠血清GAS含量下降, 与多数报道一致; 而血浆SS含量增高, 与相关报道不一, 但与黄氏报道相同[26-27]. 本研究结果显示的D细胞减少, 而血浆SS却增高的机制尚不十分清楚. 从医学图像分析系统的灰度值来看, G、D细胞内GAS、SS的含量越高, 免疫组化染色越深, 则灰度值越大, 反之越小[28]; 也有人从D细胞形态学上观察证实, 随着萎缩及肠化的加重, 胞质内分泌颗粒也呈减少趋势[29], 因此, 似乎可以说明, CAG大鼠胃黏膜内D细胞内SS含量较正常下降, 但如何解释外周血中的SS增高现象? 我们分析认为, 可能是在CAG成模后的初期, 由于D细胞的减少, 脱颗粒的增加, 通过反馈性的调节, 促使D细胞反应性高功能, 再通过内分泌形式, 一过性地将SS释放到血液中, 且SS含量的一过性增高导致G细胞受抑制加强, 血清GAS下降, 也加剧了CAG的发展; 随着胃黏膜萎缩病变的加重, 反馈性调节机制的失代偿, SS含量则进一步降低. 这一认识尚有待于通过胃黏膜、胃液和外周血中SS含量对比的长期实验观察来进一步证实.
总之, 由于模拟CAG发生的因素损伤胃黏膜屏障, 使胃黏膜主、壁细胞减少, 导致胃蛋白酶分泌和盐酸分泌下降; 同时, 由于G、D细胞的减少变化, 导致了G、D细胞分泌GAS、SS异常, 是大鼠CAG的发生和发展的重要原因之一. 可以肯定, CAG的发生与主、壁细胞的损伤和泌酸功能下降及G、D细胞的减少变化导致GAS、SS等胃肠激素分泌异常的神经内分泌调节机制紊乱密切相关[4,23,30].
近年来, 普遍研究认为CAG的发生、发展与胃黏膜腺体主细胞、壁细胞损害和G、D细胞密度及细胞数值的变化相关, 而对外周血中胃泌素、生长抑素的含量变化与CAG的关系则认识不一. 通过模拟CAG发生的因素建立大鼠模型, 观察胃黏膜病理组织学的改变和主、壁细胞, G、D细胞的变化以及外周血GAS、SS的水平, 将从细胞水平及胃肠激素的内分泌机制角度来阐述CAG发生的病理机制.
CAG的病因至今尚未完全明了, 但公认的形成机制是各种致病因素的长期刺激或继发的宿主炎症反应, 导致胃黏膜深层损害和腺体的破坏, 而形成胃黏膜腺体萎缩和(或)肠化. 探讨主、壁细胞, G、D细胞及外周血GAS、SS含量的变化对胃黏膜腺体萎缩和(或)肠化的影响, 将有助于探讨CAG的神经内分泌调节机制紊乱的病理过程, 以期寻找阻断CAG发生、发展的有效手段方法.
由于对外周血中胃泌素、生长抑素的含量变化与CAG的关系则认识不一, 因此本文通过建立CAG大鼠模型, 从胃黏膜组织中的内分泌细胞学变化来客观阐述和分析胃肠激素分泌异常的神经内分泌调节紊乱的病理学机制.
通过了解CAG胃肠激素分泌异常的神经内分泌调节机制紊乱的病理学机制, 可进一步为寻求阻断CAG胃黏膜腺体萎缩防治研究提供方向和对策.
壁细胞由胃黏膜腺体峡部的干细胞增殖分化形成, 又称泌酸细胞, 主要分泌盐酸; 主细胞位于腺体基底部, 主要分泌胃蛋白酶原. 二者共同参与了胃酸分泌和调节. G、D细胞为胃窦部腺体散在分布的内分泌细胞, G细胞分泌GAS, 可刺激壁细胞和主细胞而促进胃酸、胃蛋白酶分泌, 具有营养胃黏膜及壁细胞群的作用; D细胞合成和分泌SS,可抑制胃酸和胃蛋白酶分泌, 亦可抑制GAS释放, 二者在功能上相互协调, 共同维持着胃肠的生理功能.
本文通过模拟CAG发生的因素建立大鼠模型, 观察胃黏膜病理组织学的改变和主、壁细胞, G、D细胞的变化以及外周血GAS、SS的水平, 从细胞水平及胃肠激素的内分泌机制角度来阐述CAG发生的病理机制, 具有先进性和科学性, 实验研究的结果合理, 有一定的理论价值.
电编: 张敏 编辑:王晓瑜
| 3. | Lacy ER, Cowart KS, King JS, DelValle J, Smolka AJ. Epithelial response of the rat gastric mucosa to chronic superficial injury. Yale J Biol Med. 1996;69:105-108. [PubMed] |
| 4. | 周 凡, 唐 福康, 武 一曼, 周 维湛, 王 若愚, 葛 振华. 人慢性胃炎神经内分泌G、D 细胞关系的研究. 中国组织化学与细胞化学杂志. 2000;9:161-163. |
| 6. | Xiang Z, Si JM, Huang HD. Chronic gastritis rat model and role of inducing factors. World J Gastroenterol. 2004;10:3212-3214. [PubMed] [DOI] |
| 7. | Genta RM. Atrophy and atrophic gastritis: one step beyond the Sydney system. Ital J Gastroenterol Hepatol. 1998;30 Suppl 3:S273-S275. [PubMed] |
| 12. | Karam SM. Cell lineage relationship in the stomach of normal and genetically manipulated mice. Braz J Med Biol Res. 1998;31:271-279. [PubMed] [DOI] |
| 13. | 谢 晶日, 沈 林艳, 刘 朝霞. 胃灵冲剂对大鼠慢性萎缩性胃炎黏膜G细胞及D细胞的影响. 中国中西医结合消化杂志. 2006;14:190~191. |
| 15. | Dick AC, Ardill J, Potts SR, Dodge JA. Gastrin, somatostatin and infantile hypertrophic pyloric stenosis. Acta Paediatr. 2001;90:879-882. [PubMed] [DOI] |
| 21. | 刘 全忠. 生长抑素的表达与胃黏膜上皮癌变的关系. 中国中西医结合消化杂志. 2006;14:102-104. |
| 22. | 李 红涛, 吴 开春, 李 彩宁, 乔 泰东, 郭 学刚, 王 新, 郝 志明, 宋 瑛, 丁 杰, 樊 代明. 血清胃泌素对老年人慢性萎缩性胃炎的诊断. 中华老年医学杂志. 2004;23:238-410. |
| 26. | 黄 妙珍. 慢性萎缩性胃炎与表皮生长因子和生长抑素的相关性研究. 杭州医学高等专科学校学报. 2003;24:205-207. |
| 28. | 林 静, 薄 爱华, 姚 希贤, 沈 金库, 张 林西, 刑 立强, 戴 洁, 夏 苓. 胃泌素、生长抑素和5-羟色胺与慢性萎缩性胃炎病变关系的研究. 胃肠病学与肝病学杂志. 1996;5:270-274. |