修回日期: 2006-09-17
接受日期: 2006-09-20
在线出版日期: 2006-12-08
目的: 建立人食管癌顺铂耐药细胞系Ec9706/ cDDP, 探讨其生物学特征.
方法: 采用顺铂(cDDP)中等浓度、间歇作用方法历时9 mo建立耐药细胞系Ec9706/cDDP, 采用MTT法测定其对cDDP的耐药指数, 观察冻存、撤药对耐药性的影响, 比较耐药与亲本细胞生长曲线、群体倍增时间及贴壁率的不同, 流式细胞仪测细胞周期, 软琼脂实验测细胞的恶性增殖能力, 罗丹明实验测其对药物的摄入、排出能力.
结果: 人食管癌顺铂耐药细胞系Ec9706/cDDP的耐药指数为15.7, 冻存对耐药性影响不大, 撤药培养可使耐药性降低, 耐药细胞群体倍增时间延长(29.79±0.48 h vs 25.79±0.45 h, P<0.05), 生长缓慢, G0/G1、S期细胞比例增加(63.18%±5.21% vs52.81%±4.36%, P<0.05; 36.49%±3.93% vs 26.70%±2.62%, P<0.05), G2期细胞减少(0.33%±0.02% vs 20.49%±3.71%,P<0.05), 克隆形成率明显高于亲本细胞(69% vs 24%, P<0.05), 对罗丹明的摄入减少, 排出增多.
结论: 成功建立了人食管癌顺铂耐药细胞系Ec9706/cDDP, 且耐药性较稳定.
引文著录: 李敏, 王志举, 李文涛, 董子明. 人食管癌顺铂耐药细胞系Ec9706/cDDP的建立及其生物学特征. 世界华人消化杂志 2006; 14(34): 3257-3260
Revised: September 17, 2006
Accepted: September 20, 2006
Published online: December 8, 2006
AIM: To establish a cisplatin-induced human esophageal carcinoma drug-resistant cell line Ec9706/cDDP and study its biological characteristics.
METHODS: The drug-resistant cell line Ec9706/cDDP was established in culture by exposing Ec9706 parent cells to moderate concentration of cisplatin (cDDP) over a period of 9 months. The resistance index to cDDP was determined by the methyl thiazolyl tetrazolium (MTT) assay. Cell growth curve was painted and the doubling time was accounted. Flow cytometry (FCM) was performed to determine cell cycle. Fluorescence activated cell analysis (FACS) was employed to determine the concentration of fluorescence dye of rhodamine 123 (Rh123) in the cells for the evaluation of drug-absorptive and expelling capacity.
RESULTS: The resistant index of Ec9706/cDDP was 15.7. When Ec9706/cDDP was stored with cDDP at -196 ℃ for 3 months and then back into the normal environment, its characteristic of anti-tumor drug resistance was still maintained. But after being cultured in RPMI-1640 without cDDP for a period of 1 month, Ec9706/cDDP showed a decrease in the resistant index. As compared with the parent cells, Ec9706/cDDP exhibited a prolonged doubling time (29.79 ± 0.48 h vs 25.79 ± 0.45 h, P < 0.05) and lower growth rate. The percentages of cells in S and G0/G1 phase were significantly increased in Ec9706/cDDP in comparison with those in Ec9706 (36.49% ± 3.93% vs 26.70% ± 2.62%, P < 0.05; 63.18% ± 5.21% vs 52.81% ± 4.36%, P < 0.05) while the percentage of G2-phase cells was decreased (0.33% ± 0.02% vs 20.49% ± 3.71%, P < 0.05). In soft agar growth test, Ec9706/cDDP cells formed more cell clones than Ec9706 cells (69% vs 24%, P < 0.05). Finally, the concentration of Rh123 in Ec9706/cDDP was lower than that in Ec9706.
CONCLUSION: The newly established stable cell line Ec9706/cDDP possesses typical multi-drug resistant characteristics and its drug-resistant phenotype is stable.
- Citation: Li M, Wang ZJ, Li WT, Dong ZM. Establishment of a cisplatin-induced human esophageal carcinoma drug-resistant cell line and its biological characteristics. Shijie Huaren Xiaohua Zazhi 2006; 14(34): 3257-3260
- URL: https://www.wjgnet.com/1009-3079/full/v14/i34/3257.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i34.3257
近年来人们发现肿瘤细胞不仅会对使用过的抗肿瘤药产生耐药性, 而且对很多未曾接触过的、甚至结构与作用机制不同的药物产生不同程度的耐药性, 即多药耐药性(multidrug resistance, MDR), 这是导致临床肿瘤化疗失败的重要原因之一[1-3]. 建立多药耐药细胞系是体外研究MDR的重要手段, 对指导临床医生选择合理的化疗方案和化疗药物具有重要意义[4]. 本研究采用顺铂(cDDP)中等浓度、间歇作用方法建立了人食管癌细胞的MDR细胞系Ec9706/cDDP, 旨在探讨其生物学特征及MDR机制, 为探索逆转肿瘤耐药的有效途径奠定基础.
人食管癌细胞株Ec9706由本校病理学教研室惠赠; cDDP山东齐鲁制药厂生产; RPMI 1640培养液Gibco/BRL公司生产; 四甲基偶氮唑蓝(MTT)为美国Sigma产品; 碘化丙啶(PI)、RNase购自Amresco公司.
1.2.1 耐药细胞株Ec9706/cDDP的建立: 采用cDDP中等浓度、间歇作用方法建株. 以终浓度为2 mg/L的cDDP培养液冲击对数生长期的Ec9706细胞, 48 h后弃含药培养液, PBS洗3遍, 换新鲜培养液. 1-2 d换液一次洗去死亡细胞, 待形成细胞克隆时传代, 恢复稳定生长后提高cDDP浓度再次冲击, 如此反复作用直至细胞可在浓度为0.5 mg/L的cDDP培养液中维持培养.
1.2.2 MTT法测定细胞对cDDP的敏感性: 常规MTT法检测, 酶标仪上以550 nm波长测吸光度值(A). 相对抑制率(%) = (1-加药孔A值/对照孔A值)×100%, IC50计算器软件计算50%细胞生长抑制时的药物浓度(IC50), 耐药指数(RI) = 耐药细胞IC50/亲本细胞IC50.
1.2.3 冻存、复苏及撤药对细胞耐药稳定性的影响: 将加有0.5 mg/L cDDP的细胞于-196 ℃冻存, 3 mo后复苏测RI. 同时观察细胞在不含药培养液中培养1 mo后RI的变化.
1.2.4 细胞形态学观察、生长曲线及倍增时间测定: 倒置显微镜观察细胞形态变化. 细胞以5×106个/L接种于24孔培养板中, 21孔/组, 每日消化3孔, 计数活细胞, 连续7 d. 绘制细胞生长曲线, 按Patterson公式计算群体倍增时间: Td = T×lg2/(lgN2-lgN1), N1为起始时间细胞数, N2为培养T小时后细胞数, T为N1到N2的时间(h).
1.2.5 细胞贴壁率及细胞周期的测定: 细胞以1×105个/孔接于21孔板, 12孔/组, 每隔2 h随机取3孔, 计数培养液中未贴壁细胞数, 共观察8 h, 细胞贴壁率(%) = (1-未贴壁细胞数/接种细胞总数)×100%; 取对数生长期细胞接种于不含血清的培养液中常规培养24 h使同步化, 换含100 mL/L血清的新鲜培养液, 待细胞达90%融合时收集, PBS洗涤, 700 mL/L乙醇固定, 1 g/L RNase 37 ℃作用30 min, 100 mg/L PI避光染色30 min, 置流式细胞仪检测.
1.2.6 双层软琼脂试验: 底层为50 g/L琼脂糖培养基, 上层为含不同细胞浓度的3 g/L琼脂糖培养基, 使每孔中细胞数分别为25, 50, 100, CO2箱中培养14 d左右, 计数细胞数大于50的克隆数.
1.2.7 罗丹明(Rh123)摄入/排出实验: Rh123摄入: 1×109个/L的单细胞悬液加Rh123至终浓度为1 mg/L, 培养箱中置30 min, 离心后PBS洗3次, 流式细胞仪检测细胞内Rh123的相对荧光强度; Rh123排出: 上法处理于PBS洗3次后重悬于不含Rh123的培养液培养1 h, PBS洗涤, 流式细胞仪检测细胞内滞留的Rh123的相对荧光强度.
统计学处理 采用统计学软件SPSS10.0进行分析, 实验结果用均数±标准差(mean±SD)表示, 组间差异比较用t检验.
MTT法检测结果表明, Ec9706/cDDP细胞对顺铂的耐药指数为15.7. 加药-196 ℃冻存3 mo复苏后其RI仍维持冻存前水平, 解除药物作用1 mo后RI为14.8, 抗药性下降约5.7%.
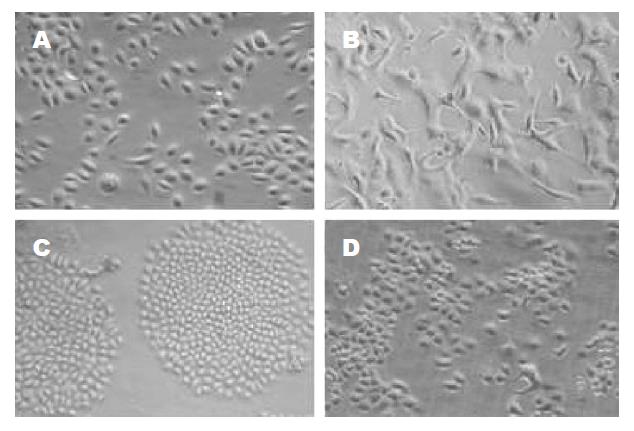
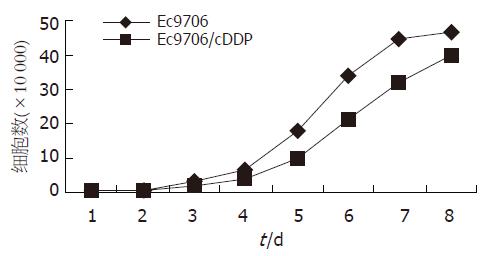
加入cDDP后24 h光镜下可见大部分细胞因死亡而漂浮起来, 培养液略浑浊, 残留贴壁细胞发生明显改变, 大小不均, 有巨细胞产生, 形态不规则, 细胞突起及部分细胞胞质中黑色颗粒较多, 生长缓慢, 于20 d左右可形成细胞克隆, 传代后逐渐基本接近原来形状(图1). 细胞生长曲线见图2. 耐药细胞较亲本细胞生长缓慢, 群体倍增时间延长,分别为29.79±0.48 h, 25.79±0.45 h, 差别具有统计学意义(P<0.05).
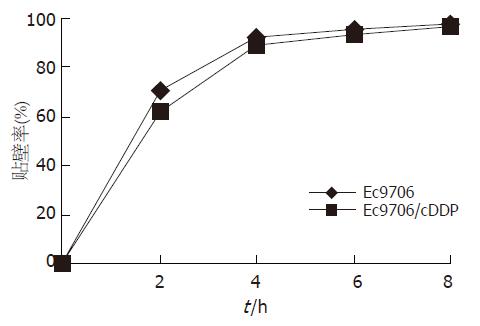
亲本细胞于0, 2, 4, 6, 8 h后的贴壁率分别为: 0, 70.13%, 92.32%, 95.52%, 97.85%; 耐药细胞在上述同一时间点的贴壁率则有所降低, 分别为0, 62.39%, 88.65%, 93.18%, 97.01%, 贴壁率变化曲线见图3, 但二者相比差别不明显, 无统计学意义(P>0.05). 耐药细胞G0/G1, S期细胞比例增加, G2/M期比例减少. 与亲本细胞相比差异有统计学意义(P<0.05, 表1).
Ec9706与Ec9706/cDDP的克隆形成率分别为: 24%, 69%, 耐药细胞的克隆形成率显著增加(P<0.05).
Ec9706/cDDP, Ec9706对Rh123的摄入量均值分别为: 36.82, 39.02, 滞留量分别为: 23.83, 29.70, 耐药细胞对Rh123的摄入少, 排出多, 二者差异有统计学意义(P<0.05).
体外建立耐药细胞系是研究肿瘤细胞耐药机制及攻克临床化疗失败这一难关的前提和基础, 而建立耐药细胞系的方法有体外抗癌药物诱导法和耐药基因转染法[5-6], 其中后者省时, 耐药机制单一, 在不含抗癌药的培养基中培养时, 耐药性稳定, 而前者是目前应用较为普遍的方法, 因其可以很好的模拟人类肿瘤化疗过程中出现的耐药现象, 该方法根据具体操作不同可分为药物浓度递增法、大剂量间歇冲击法等. 药物浓度递增法诱导过程缓慢, 耗时长; 大剂量冲剂法快速, 但对细胞损伤较大, 若剂量掌握不好, 有时致细胞全部死亡而中断实验. 目前有不少学者采用将药物浓度递增与间歇冲击结合法二者结合的方法来诱导耐药细胞. cDDP是细胞周期非特异性的细胞毒性药物, 为临床常用的化疗药物, 抗癌谱广, 可与蛋白质、DNA、RNA形成加成物, 致DNA链间或链内交联, 以及DNA-蛋白质交叉联结, 抑制DNA复制、RNA转录, 引起细胞死亡[7]. 因此, 建立cDDP诱导的肿瘤细胞系可模拟常见的临床耐药, 具有较好的代表性. 本研究采用cDDP中等浓度、间歇冲击方法对Ec9706细胞进行9 mo的体外诱导筛选获得了食管癌耐药细胞系Ec9706/cDDP, 耐药指数达15.7. 有学者按耐药指数的高低将耐药分为低度(<5)、中度(5-15)、高度(>15)[8].该耐药性在加药-196 ℃冻存状态下可长时间维持, 但在培养液中培养时需加入一定浓度的药物, 以维持其耐药性的稳定. 诱导耐药期间, 在加入cDDP早期时细胞形态有所变化, 包括突起及胞质中颗粒增多, 有学者认为可能与耐药细胞表面积增加, 以排除更多的药物有关, 而巨细胞的出现可能是细胞受到损伤及细胞分裂减少所致. 在软琼脂实验中耐药细胞的克隆形成率明显高于亲本细胞, 表明耐药细胞的恶性增殖能力大大增强. Rh123是一种疏水性荧光染料, 可被激发出红色荧光, 易于用流式细胞仪测定.同时其化学结构与很多抗癌药物相似, 是特异性较强的P-糖蛋白的底物, 可有效的被表达P-糖蛋白的细胞排出胞外, 对细胞毒性低, 故人们常用Rh123替代抗癌药物测定药物在胞内的蓄积情况. Rh123摄入/排出试验证实, Ec9706/cDDP对Rh123的蓄积比亲本细胞少, 表明耐药细胞膜上的泵机制可有效的将抗癌药排出胞外, 这可能是该细胞耐药机制之一. 肿瘤细胞的耐药机制有多种[9-12], 其详细的耐药机制需进一步探讨. 总之, 本研究所诱导的Ec9706/cDDP耐药细胞具有稳定的耐药表型, 是研究肿瘤细胞的耐药机制、筛选耐药逆转剂的理想模型
肿瘤细胞的多药耐药性(MDR)是导致临床肿瘤化疗失败的主要原因. 美国癌症协会研究表明, 90%以上的肿瘤患者不同程度上受耐药影响. 建立耐药细胞系是体外研究MDR的重要手段和前提, 有助于深入研究MDR的机制、有效逆转途径.
本文首次采用顺铂浓度递增法与间歇冲击法相结合的方法建立了Ec9706食管癌细胞的顺铂耐药细胞系.
本研究结果表明Ec9706/cDDP细胞具有较好的耐药表型, 可进一步用于研究肿瘤细胞MDR的机制及其有效逆转途径.
建立肿瘤耐药细胞系对于研究肿瘤细胞耐药机制和肿瘤化疗敏感性极其重要, 本文科学性强、设计合理、选用方法先进可行、结果准确可靠, 符合伦理要求.
电编: 张敏 编辑:王晓瑜
| 1. | Larsen AK, Escargueil AE, Skladanowski A. Resistance mechanisms associated with altered intracellular distribution of anticancer agents. Pharmacol Ther. 2000;85:217-229. [PubMed] [DOI] |
| 2. | Rajagopal A, Simon SM. Subcellular localization and activity of multidrug resistance proteins. Mol Biol Cell. 2003;14:3389-3399. [PubMed] [DOI] |
| 3. | 韩 全利, 丁 杰, 张 龙方, 王 新, 郭 长存, 乔 泰东, 张 学庸, 樊 代明. Ss-A/Ro核蛋白60 ku亚单位在胃癌多药耐药中的作用. 世界华人消化杂志. 2006;14:256-260. [DOI] |
| 4. | 布 立民, 孙 淑红, 华 建平, 韩 英, 赖 靖, 鲍 文漪. 人大肠癌HCT-8/5-FU耐药细胞株的建立及P-gp测定. 世界华人消化杂志. 2006;14:2082-2086. [DOI] |
| 5. | Yang LY, Trujillo JM. Biological characterization of multidrug-resistant human colon carcinoma sublines induced/selected by two methods. Cancer Res. 1990;50:3218-3225. [PubMed] |
| 6. | 樊 爱琳, 刘 国鹏, 郑 善銮, 马 静, 王 执民, 丁 振若, 杨 麦贵, 郝 晓柯. 逆转录病毒转染法建立兔VX-2多药耐药株. 第四军医大学学报. 2003;24:2129-2131. |
| 7. | Sorenson CM, Barry MA, Eastman A. Analysis of events associated with cell cycle arrest at G2 phase and cell death induced by cisplatin. J Natl Cancer Inst. 1990;82:749-755. [PubMed] [DOI] |
| 8. | Snow K, Judd W. Characterisation of adriamycin- and amsacrine-resistant human leukaemic T cell lines. Br J Cancer. 1991;63:17-28. [PubMed] [DOI] |
| 9. | Akiyama S. Mechanisms of drug resistance and reversal of the resistance. Hum Cell. 2001;14:257-260. [PubMed] |
| 10. | Scheffer GL, Scheper RJ. Drug resistance molecules: lessons from oncology. Novartis Found Symp. 2002;243:19-31; discussion 31-7, 180-185. [PubMed] |
| 11. | Gottesman MM. Mechanisms of cancer drug resistance. Annu Rev Med. 2002;53:615-627. [PubMed] [DOI] |