修回日期: 2006-10-08
接受日期: 2006-10-11
在线出版日期: 2006-11-28
目的: 探讨HSP70, HSP90在人结肠癌中的表达情况及其和结肠癌细胞生物学行为的相关性.
方法: 结肠癌患者手术标本40例, 分别以癌组织、癌旁2 cm组织和远离癌灶的正常黏膜组织作为病例组和对照组. 用亲和免疫组织化学技术方法检测HSP70和HSP90, 并收集该40例患者的临床Duke's分期, 分析HSP70和HSP90蛋白的阳性程度和结肠癌临床分期是否存在相关性.
结果: 癌组织HSP70和HSP90的表达明显增高, 癌组织、癌旁组织和正常黏膜组织三组之间HSP70和HSP90表达率有明显差异(HSP70: 82.5% vs 52.5% vs 25%, χ2 = 26.58, P = 0.000; 72.5% vs 42.5% vs 22.5%, χ2 = 20.41, P = 0.000); HSP70和HSP90蛋白的阳性程度和结肠癌临床分期存在相关性(HSP70: tau_b = 0.392, P = 0.006; HSP90: tau_b = 0.396, P = 0.006).
结论: 结肠癌细胞存在HSP70和HSP90蛋白的过度表达, HSP70, HSP90和结肠癌细胞的生物学行为存在相关性.
引文著录: 陈怡, 冉志华, 陈翔, 朱长清, 萧树东. HSP70, HSP90在结肠癌中表达及其和生物学行为的相关性. 世界华人消化杂志 2006; 14(33): 3201-3205
Revised: October 8, 2006
Accepted: October 11, 2006
Published online: November 28, 2006
AIM: To investigate the expression of heat shock protein (HSP) 70 and 90 as well as their correlations with the biological behavior of colon cancer.
METHODS: Specimens were collected from the cancerous lesions, paracancerous tissues (2 cm away from cancer lesion) and normal mucosal tissues of 40 patients with colon cancer after colon resection. The expression of HSP70 and HSP90 were detected using affinitive immunohistochemical technique. Meanwhile, Duke's staging for the 40 colon cancer patients was analyzed, and the relationship between the expression levels of HSPs and Duke's staging was further investigated.
RESULTS: The levels of HSP70 and HSP90 expression between the cancerous tissues, paracancerous tissues, and normal tissues (HSP70: 82.5% vs 52.5% vs 25%, χ2 = 26.58, P = 0.000; HSP90: 72.5% vs 42.5% vs 22.5%, P = 0.000). The positive rates of HSP70 and HSP90 had significant correlations with clinical staging of colon cancer (HSP70: tau_b = 0.392, P = 0.006; HSP90: tau_b = 0.396, P = 0.006).
CONCLUSION: HSP70 and HSP90 are over-expressed in colon cancer, which are correlated with the biological behavior of colon cancer.
- Citation: Yi-Chen, Ran ZH, Xiang-Chen, Zhu CQ, Xiao SD. Expression of heat shock protein 70 and 90 and their relationships with biological behaviors of colon cancer. Shijie Huaren Xiaohua Zazhi 2006; 14(33): 3201-3205
- URL: https://www.wjgnet.com/1009-3079/full/v14/i33/3201.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i33.3201
近年来结肠癌的发病人数明显增多, 对结肠癌的诊断及治疗技术的提高显得尤为重要. 研究发现热休克蛋白(HSP)的高表达与肿瘤的发生、发展关系密切, 其机制可能与增强了肿瘤细胞抗凋亡能力有关, 且HSP可能与肿瘤的恶性程度及预后相关, HSP的抗体或反义HSP能增加肿瘤细胞对治疗的敏感性, 为肿瘤的治疗提供了新的方向. 对HSP在结肠癌中的表达情况的研究可能对结肠癌的诊断、预后及治疗均存在意义. 在HSP家族中HSP70, HSP90是拮抗细胞凋亡的2种主要蛋白, 与肿瘤的发生、发展关系密切, 我们探讨了HSP70和HSP90蛋白在结肠癌中的表达情况及其和结肠癌生物学活性的相关性.
2002-11/2004-02仁济医院东部结肠癌患者手术标本40例. 每例患者取癌组织、癌旁2 cm组织及远离癌组织的正常肠黏膜组织各一块, 用亲和免疫组织化学方法对HSP70和HSP90蛋白进行检测. 一抗: anti-human HSP70, HSP90 antibody购自美国Santa Cruz公司, 二抗: UltraSensitive SP试剂盒及DAB显色试剂盒购自福州迈新生物公司.
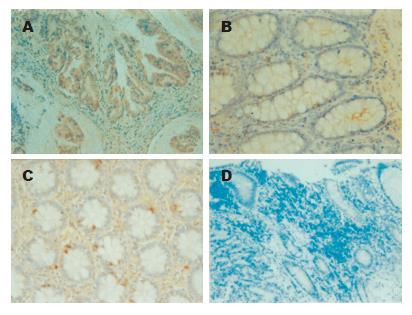
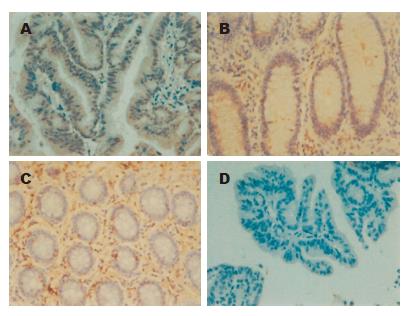
组织固定, 石蜡包埋, 切片. 烤片1 h脱蜡, 流水冲10 min, PBS浸泡5 min×3次, 滴加内源性过氧化物酶抑制剂保持10 min. PBS浸泡5 min×3次, 柠檬酸钠抗原修复缓冲液进行抗原微波热修复. 冷却到室温后再次PBS浸泡5 min×3次, 滴加非免疫动物血清保持30 min. 擦去血清后放置入冰箱4 ℃过夜. PBS浸泡5 min×3次, 滴加生物素标记第二抗体保持1 h. PBS浸泡5 min×3次, 滴加链霉素抗生物素蛋白-过氧化物酶保持1 h. PBS浸泡5 min×3次, 滴加DAB显色剂保持1 min. 流水冲10 min, 放入苏木素染色剂中保持15-30 s. 流水冲10 min, 盐酸酒精分化. 流水冲10 min, 风干、封片、镜检. 阳性统计方法: 染色深度: 无色0分, 浅黄色1分, 棕黄色2分, 褐色3分; 靶组织染色百分比: 根据靶组织着色范围随机取上、下、左、右、中各五个高倍视野, <10%为1分, 11%-50%为2分, 51%-75%为3分, >75%为4分. 取上面五个数字得到平均值和颜色深度的乘积得到最终积分: <2分为阴性, 2-4分为+, 4-6分为++, 6-9分为+++, 9-12分为++++.
统计学处理 用R×2列联表χ2检验(SPSS)分析HSP70, HSP90在癌组织、癌旁组织及正常结肠黏膜组织表达的差异, 并从病史室得到40位患者临床资料, 用Kendall等级计数相关分析(SPSS)计算HSP70, HSP90阳性程度与肿瘤Duke's分期的相关性. P<0.01有统计学意义.
HSP70, HSP90在肿瘤组织的胞质及胞核均有表达, 为弥漫性棕色染色颗粒,在40例结肠癌患者的肿瘤组织中阳性率分别达到82.5%和72.5%(图1A、图2A). 在癌旁组织中HSP70, HSP90主要表达在腺体及腺沟, 阳性率为52.5%和42.5%(图1B、图2B), 而在正常结肠黏膜组织中, HSP70, HSP90表达为腺体周围散在棕黄色颗粒, 阳性率为25%和22.5%(图1C、图2C). 结肠癌组织、癌旁组织及正常黏膜组织三组之间HSP70, HSP90表达率差异有统计学意义(P<0.01).
应用Kendall等级计数相关分析(SPSS)提示结肠癌HSP70, HSP90的阳性程度和Duke's分期存在相关性(表1-2), 即随着肿瘤浸润逐渐加深, HSP70, HSP90的表达增加(P<0.01).
| Duke's分期 | 阳性程度(半定量) | 总计 | ||
| - | +~++ | +++ | ||
| A | 3 | 5 | 0 | 8 |
| B | 3 | 10 | 1 | 14 |
| C | 1 | 9 | 3 | 13 |
| D | 0 | 3 | 2 | 5 |
| 总计 | 7 | 27 | 6 | 40 |
| Duke's分期 | 阳性程度(半定量) | 总计 | ||
| - | +~++ | +++ | ||
| A | 4 | 4 | 0 | 8 |
| B | 5 | 9 | 0 | 14 |
| C | 1 | 10 | 2 | 13 |
| D | 1 | 2 | 2 | 5 |
| 总计 | 11 | 25 | 4 | 40 |
HSP是一组结构保守广泛存在的蛋白质, 根据同源程度及分子量大小可分为HSP110, HSP90, HSP70, HSP60, HSP40, 小分子HSP, HSP10 (HSP60的辅因子)及泛素等亚家族[1]. 多年的研究发现, HSP在细胞内能帮助其他蛋白质进行正确的折叠与重构, 并能把受损害的蛋白质递呈给蛋白酶进行降解[2], 在保持细胞内的动态平衡中起重要作用, 因此被称为分子伴侣, 近年的研究提示, HSP的高表达能增强肿瘤细胞抗凋亡能力, 使细胞生长抑制效应与死亡减弱[3], 和肿瘤的发生、发展之间存在着联系. 在HSP家族中HSP70, HSP90是拮抗细胞凋亡的2种蛋白, 提示其可能在肿瘤的发生、发展中发挥重要作用. 曾有研究表明热休克蛋白家族中HSP70, HSP90在肺癌[4]、乳腺癌[5]、卵巢癌[6]、食道癌[7]、骨肉瘤[8]及淋巴细胞白血病[9]等许多肿瘤发生、发展中起作用, 其中也发现许多肿瘤中高表达的HSP与肿瘤的淋巴结转移存在相关性[10-14].
本研究显示, 结肠癌组织的HSP70, HSP90蛋白染色阳性率(分别达到82.5%和72.5%)显著高于各自的癌旁组织(52.5%和42.5%)及正常结肠腺体组织(25%和22.5%), 与既往研究发现结肠癌组织存在HSF1(热休克因子1)、HSP70以及HSP40的高表达相符合[15-16]. 结肠癌组织中HSP70, HSP90阳性结果表现为弥漫性的棕色染色颗粒, 证明其在细胞核、细胞质均有表达. 在癌旁组织中其主要表达在肠黏膜腺体、腺沟等部位, 可能与癌组织HSP70, HSP90的高表达以及蛋白转运与分泌有关, 也有可能和癌组织周边存在的炎性反应环境有关, 曾有研究发现在炎性肠病组织中也存在HSP70等HSP的过度表达并起到细胞保护作用[17]. 在正常肠黏膜中HSP70, HSP90即有一定表达, 提示其在正常细胞活动中亦有一定作用. 在癌组织, 癌旁组织中HSP70, HSP90的表达量均明显高于正常组织, 并且在癌组织中HSP70, HSP90的表达程度和结肠癌Duke's分期存在相关性, 即随着肿瘤浸润深度的增加, HSP70和HSP90表达增加, 提示其可能在结肠癌的发生、发展中起重要作用.
HSP70, HSP90在结肠癌组织中的高表达与其具有拮抗肿瘤细胞凋亡的能力有关. 1990年代以来细胞凋亡在肿瘤发病学和治疗学上的意义受到广泛重视. 细胞学研究发现, 肿瘤细胞能通过过度表达拮抗调亡的蛋白质而生存[18]. 而HSP70, HSP90等能抑制调亡, 在许多肿瘤细胞中有过度表达, 并且与多种肿瘤的分级、预后相关. 曾有研究发现在食道鳞状细胞癌中高表达的HSP70与肿瘤细胞淋巴结转移, 淋巴管浸润存在相关性[19], 研究者建议HSP70能作为食道癌术后患者的预后评价指标. Rashmi et al[20]发现HSP70的高表达与胃肠道肿瘤患者肿瘤细胞转移, 不良预后以及对放疗化疗的不敏感有关. 其机制可能为HSP70能抑制细胞色素c释放AIF活化并能抑制caspases-3和caspases-9的活性, 从而促进肿瘤细胞的发生与发展. 也有研究表明在结直肠癌中HSP70可能与P53形成复合物从而导致抑癌基因P53失活, 抑制肿瘤细胞凋亡[21]. Beliakoff et al[22]发现在乳腺癌中高表达的HSP90与肿瘤的进展有关, 其机制与HSP90能够通过激活Akt并导致抑癌基因P53失活来抑制肿瘤细胞凋亡有关. 可见HSP70, HSP90能通过各种途径抑制肿瘤细胞凋亡, 促进肿瘤细胞的发生、发展. HSP70, HSP90的高表达与结肠癌细胞的恶性增殖也密切相关. 肿瘤的形成过程中, 肿瘤细胞不断增殖, 合成代谢增强, 需要大量的HSP调节和稳定这一异常增殖过程, 而肿瘤组织生长旺盛, 其增生的血管存在相对血供不足, 缺氧与应激的细胞环境也反过来诱导了HSP的过度表达. HSP70, HSP90的高表达一方面介导癌基因及抑癌基因产物的构象成熟、跨膜转运, 另一方面介导错配蛋白的降解, 协调肿瘤细胞的蛋白质快速代谢平衡, 使肿瘤细胞得以无限增殖. Yokota et al[23]发现HSP的复合物在人结肠癌中的表达较正常组织显著增高, 并且其表达水平与PCNA(增殖细胞核抗原)相关, 而PCNA是细胞增殖的一个重要指标, 提示HSP的复合物的高表达与结肠癌细胞的快速增殖有关. 也有研究发现高表达的HSP70, HSP90能通过促进HER2与c-Myc等原癌基因的激活, 从而使肿瘤细胞自主增生, 促进肿瘤细胞的发生、发展[24].
近年来的研究发现, 在结肠癌的治疗中使用HSP70, HSP90的抗体或应用反义寡核苷酸技术抑制这些基因的表达, 能增加肿瘤细胞对治疗的敏感性, 从而为结肠癌的治疗提供了新的方向. HSP90的拮抗剂格尔德霉素(geldanamycin)能增加人结肠癌HT-29细胞对放疗的敏感性并减少放射剂量[25]. Zhao et al[26]研究发现, 反义HSP70能抑制人胃癌SGC-7901细胞HSP70的表达并能诱导肿瘤细胞的凋亡, 抑制肿瘤细胞的增生. HSP-多肽复合物可制成免疫疫苗, 为结肠癌提供肿瘤免疫疗法, Chen et al[27]研究发现, 从鼠肝癌细胞中提纯的HSP70-多肽复合物疫苗接种肝癌小鼠能提高其对肝癌细胞的免疫力, Mazzaferro et al[28]在29例结肠癌根治术后肝转移的患者中接种HSP-多肽复合物疫苗, 发现其能诱导CD8+ T细胞介导的免疫反应, 限制原发瘤的复发及转移, 并且未发现严重的毒性反应. 也有研究发现高热对BGC-823人胃癌细胞的杀伤作用明显, 而各加热组均可使BGC-823细胞高表达HSP70[29], 抑制HSP70能增加肿瘤细胞对热疗的敏感性并可能降低肿瘤热疗的温度[30], 以上的各种治疗方法在结肠癌的治疗均中存在应用前景.
总之, HSP70, HSP90在肿瘤增生和转移过程中可以通过多个角度发挥促进作用. 本项研究结果提示HSP70, HSP90的表达在结肠癌发生、发展和转移中发挥重要作用, 其表达与结肠癌的生物学行为存在正相关性. 对于研发药物来干预和治疗结肠癌提供了理论依据, 且通过对HSP70, HSP90的检测, 对判断结肠癌患者的预后具有意义.
近年来我国结肠癌的发病人数有明显增多, 对结肠癌的诊断及治疗技术的提高显得尤为重要, 而近年的研究发现HSP的高表达和肿瘤的发生、发展之间存在着联系, 对HSP在结肠癌中的表达情况的研究可能对结肠癌的诊断、预后以及治疗均存在意义.
目前对HSP的深入研究在于: 其促进肿瘤发生及转移的机制的深入探讨; 在肿瘤治疗中HSP90的抗体geldanamycin(格尔德霉素)以及应用反义寡核苷酸技术抑制HSP70, HSP90结合肿瘤化疗、放疗或热疗, 有些已在Ⅰ/Ⅱ期临床试验; 而HSP-肽类复合物可制成免疫疫苗在肿瘤免疫治疗中有应用前景.
HSP70, HSP90在结肠癌中的表达情况国内外研究较少, 近年发现HSP家族中HSP70, HSP90是拮抗细胞凋亡的两种主要蛋白质, 可能与肿瘤的发生、发展关系密切, 故本次研究同时选择这两种蛋白, 并分析其与结肠癌生物学行为的相关性.
本项研究结果提示, HSP70, HSP90的表达在结肠癌发生、发展和转移中发挥重要作用, 其表达与结肠癌的生物学行为存在着相关性, 对于研发药物来抑制HSP70, HSP90增加结肠癌细胞对放疗、化疗及热疗的敏感性提供了理论依据, 且通过对HSP70, HSP90的检测, 对判断结肠癌患者的预后具有意义.
热休克蛋白(HSP): 是应激状态下细胞产生的保护细胞免受损害的蛋白质, 在非应激状态下在细胞内亦有基本表达, 研究表明HSP能通过抑制细胞凋亡起到细胞保护作用, 而许多肿瘤细胞也能通过过度表达HSP从而使肿瘤细胞避免凋亡, 在HSP家族中HSP70, HSP90是拮抗细胞凋亡的两种蛋白质, 与肿瘤的发生、发展关系密切.
电编: 张敏 编辑:张焕兰
| 1. | Papp E, Nardai G, Soti C, Csermely P. Molecular chaperones, stress proteins and redox homeostasis. Biofactors. 2003;17:249-257. [PubMed] [DOI] |
| 2. | Helmbrecht K, Zeise E, Rensing L. Chaperones in cell cycle regulation and mitogenic signal transduction: a review. Cell Prolif. 2000;33:341-365. [PubMed] [DOI] |
| 3. | Jolly C, Morimoto RI. Role of the heat shock response and molecular chaperones in oncogenesis and cell death. J Natl Cancer Inst. 2000;92:1564-1572. [PubMed] [DOI] |
| 4. | Zhong L, Peng X, Hidalgo GE, Doherty DE, Stromberg AJ, Hirschowitz EA. Antibodies to HSP70 and HSP90 in serum in non-small cell lung cancer patients. Cancer Detect Prev. 2003;27:285-290. [PubMed] [DOI] |
| 5. | O'Neill PA, Shaaban AM, West CR, Dodson A, Jarvis C, Moore P, Davies MP, Sibson DR, Foster CS. Increased risk of malignant progression in benign proliferating breast lesions defined by expression of heat shock protein 27. Br J Cancer. 2004;90:182-188. [PubMed] [DOI] |
| 6. | Elpek GO, Karaveli S, Simsek T, Keles N, Aksoy NH. Expression of heat-shock proteins hsp27, hsp70 and hsp90 in malignant epithelial tumour of the ovaries. APMIS. 2003;111:523-530. [PubMed] [DOI] |
| 7. | Lambot MA, Peny MO, Fayt I, Haot J, Noel JC. Overexpression of 27-kDa heat shock protein relates to poor histological differentiation in human oesophageal squamous cell carcinoma. Histopathology. 2000;36:326-330. [PubMed] [DOI] |
| 8. | Uozaki H, Ishida T, Kakiuchi C, Horiuchi H, Gotoh T, Iijima T, Imamura T, Machinami R. Expression of heat shock proteins in osteosarcoma and its relationship to prognosis. Pathol Res Pract. 2000;196:665-673. [PubMed] [DOI] |
| 9. | Lauten M, Beger C, Gerdes K, Asgedom G, Kardinal C, Welte K, Schrappe M. Expression of heat-shock protein 90 in glucocorticoid-sensitive and -resistant childhood acute lymphoblastic leukaemia. Leukemia. 2003;17:1551-1556. [PubMed] [DOI] |
| 10. | Torronteguy C, Frasson A, Zerwes F, Winnikov E, da Silva VD, Menoret A, Bonorino C. Inducible heat shock protein 70 expression as a potential predictive marker of metastasis in breast tumors. Cell Stress Chaperones. 2006;11:34-43. [PubMed] [DOI] |
| 11. | Cappello F, David S, Rappa F, Bucchieri F, Marasa L, Bartolotta TE, Farina F, Zummo G. The expression of HSP60 and HSP10 in large bowel carcinomas with lymph node metastase. BMC Cancer. 2005;5:139. [PubMed] [DOI] |
| 12. | Hwang TS, Han HS, Choi HK, Lee YJ, Kim YJ, Han MY, Park YM. Differential, stage-dependent expression of Hsp70, Hsp110 and Bcl-2 in colorectal cancer. J Gastroenterol Hepatol. 2003;18:690-700. [PubMed] [DOI] |
| 13. | Noguchi T, Wada S, Takeno S, Moriyama H, Kimura Y, Uchida Y. Lymph node metastasis could be predicted by evaluation of macrophage infiltration and hsp70 expression in superficial carcinoma of the esophagus. Oncol Rep. 2003;10:1161-1164. [PubMed] [DOI] |
| 14. | Zuo DS, Dai J, Bo AH, Fan J, Xiao XY. Significance of expression of heat shock protein90alpha in human gastric cancer. World J Gastroenterol. 2003;9:2616-2618. [PubMed] |
| 15. | Kanazawa Y, Isomoto H, Oka M, Yano Y, Soda H, Shikuwa S, Takeshima F, Omagari K, Mizuta Y, Murase K. Expression of heat shock protein (Hsp) 70 and Hsp 40 in colorectal cancer. Med Oncol. 2003;20:157-164. [PubMed] [DOI] |
| 16. | Cen H, Zheng S, Fang YM, Tang XP, Dong Q. Induction of HSF1 expression is associated with sporadic colorectal cancer. World J Gastroenterol. 2004;10:3122-3126. [PubMed] [DOI] |
| 17. | Ohkawara T, Nishihira J, Nagashima R, Takeda H, Asaka M. Polaprezinc protects human colon cells from oxidative injury induced by hydrogen peroxide: Relevant to cytoprotective heat shock proteins. World J Gastroenterol. 2006;12:6178-6181. [PubMed] [DOI] |
| 18. | Tsujimoto Y. Bcl-2 family of proteins: life-or-death switch in mitochondria. Biosci Rep. 2002;22:47-58. [PubMed] [DOI] |
| 19. | Noguchi T, Takeno S, Shibata T, Uchida Y, Yokoyama S, Muller W. Expression of heat shock protein 70 in grossly resected esophageal squamous cell carcinoma. Ann Thorac Surg. 2002;74:222-226. [PubMed] [DOI] |
| 20. | Rashmi R, Kumar S, Karunagaran D. Ectopic expression of Hsp70 confers resistance and silencing its expression sensitizes human colon cancer cells to curcumin-induced apoptosis. Carcinogenesis. 2004;25:179-187. [PubMed] [DOI] |
| 21. | Shotar AM. P53 and heat shock protein 70 expressions in colorectal adenocarcinoma. Saudi Med J. 2005;26:1602-1606. [PubMed] |
| 22. | Beliakoff J, Whitesell L. Hsp90: an emerging target for breast cancer therapy. Anticancer Drugs. 2004;15:651-662. [PubMed] [DOI] |
| 23. | Yokota S, Yamamoto Y, Shimizu K, Momoi H, Kamikawa T, Yamaoka Y, Yanagi H, Yura T, Kubota H. Increased expression of cytosolic chaperonin CCT in human hepatocellular and colonic carcinoma. Cell Stress Chaperones. 2001;6:345-350. [PubMed] [DOI] |
| 24. | Calderwood SK, Khaleque MA, Sawyer DB, Ciocca DR. Heat shock proteins in cancer: chaperones of tumorigenesis. Trends Biochem Sci. 2006;31:164-172. [PubMed] [DOI] |
| 25. | Kobayashi S, Nantz R, Kitamura T, Higashikubo R, Horikoshi N. Combined inhibition of extracellular signal-regulated kinases and HSP90 sensitizes human colon carcinoma cells to ionizing radiation. Oncogene. 2005;24:3011-3019. [PubMed] [DOI] |
| 26. | Zhao ZG, Shen WL. Heat shock protein 70 antisense oligonucleotide inhibits cell growth and induces apoptosis in human gastric cancer cell line SGC-7901. World J Gastroenterol. 2005;11:73-78. [PubMed] [DOI] |
| 27. | Chen DX, Su YR, Shao GZ, Qian ZC. Purification of heat shock protein 70-associated tumor peptides and their antitumor immunity to hepatoma in mice. World J Gastroenterol. 2004;10:361-365. [PubMed] |
| 28. | Mazzaferro V, Coppa J, Carrabba MG, Rivoltini L, Schiavo M, Regalia E, Mariani L, Camerini T, Marchiano A, Andreola S. Vaccination with autologous tumor-derived heat-shock protein gp96 after liver resection for metastatic colorectal cancer. Clin Cancer Res. 2003;9:3235-3245. [PubMed] |
| 29. | 戴 洁, 邵 雪辉, 孙 黎, 薄 爱华, 刘 开洋, 李 海锋. 温热对BGC-823胃癌细胞HSP70表达及超微结构的影响. 世界华人消化杂志. 2005;13:913-915. [DOI] |
| 30. | Rossi A, Ciafre S, Balsamo M, Pierimarchi P, Santoro MG. Targeting the heat shock factor 1 by RNA interference: a potent tool to enhance hyperthermochemotherapy efficacy in cervical cancer. Cancer Res. 2006;66:7678-7685. [PubMed] [DOI] |