修回日期: 2006-09-17
接受日期: 2006-09-28
在线出版日期: 2006-11-18
目的: 探讨异硫氰酸萘酯(ANIT)所致刚断乳大鼠急性肝内胆汁淤积胃肠消化间期移行性肌电复合波(MMC)的变化.
方法: 56只刚断乳SD大鼠被随机分为正常对照组(n = 16)、中毒组(n = 40). 两组分别随机取8只在胃窦、十二指肠、空肠分别慢性埋置三对银丝电极; 其余大鼠同时行假手术. 术后7-10 d, 埋置电极组大鼠均在清醒、空腹、自由活动状态下记录胃肠道MMC. 中毒组按200 mg/kg一次性灌服ANIT诱发大鼠急性肝内胆汁淤积病变, 观察灌服ANIT后中毒组在48, 96, 144, 192 h胆汁流量、血中TB和ALT值及胃肠MMC的变化.
结果: 中毒组灌服ANIT后, 48 h时胆汁流量中断, 血清TB和ALT明显升高; 48 h后其胆汁流量逐渐增加, 血清TB和ALT逐渐下降, 于192 h基本恢复. 在ANIT灌胃前, 埋置电极的所有大鼠在清醒、禁食状态下均记录到典型的MMC节律性电活动, 正常对照组与中毒组之间差异无显著性意义; 中毒组灌服ANIT后, MMC节律完全消失, 代之以Ⅱ期样节律紊乱波; 144 h后, 中毒组MMC节律运动开始恢复; 192 h时中毒组MMC均为节律运动, 但中毒组MMC持续时间(911.67±140.47 s)较正常对照组(682.87±77.39 s)明显延长, 其中主要是Ⅱ期持续时间延长(414.12±69.21 vs 150.28±35.45 s), 而Ⅲ期持续时间略缩短(121.21±27.38 s vs 170.27±38.98 s), 差异有显著意义(P<0.05).
结论: 急性肝内胆汁淤积时胃肠MMC表现MMC节律短暂消失或MMC周期延长; 其部分原因可能与消化间期胆汁流量减少有关.
引文著录: 胡玉莲, 王晓东, 黄志华. 实验性急性肝内胆汁淤积幼年大鼠胃肠消化间期移行性肌电复合波的变化. 世界华人消化杂志 2006; 14(32): 3098-3102
Revised: September 17, 2006
Accepted: September 28, 2006
Published online: November 18, 2006
AIM: To investigate the changes of gastro-intestinal interdigestive migrating myoelectric complex (MMC) in the weaned rat models of acute intrahepatic cholestasis induced by alpha-naphthyl-isothiocyanate (ANIT).
METHODS: A total of 56 weaned Sprague Dawley rats were randomly divided into two groups: control group (n = 16) and toxication group (n = 40). Three pairs of bipolar silver electrodes were chronically implanted in the antrum, duodenum and jejunum of 8 rats from each group in random. Sham operation was performed in the other rats of both groups. Seven to ten days after the operation, MMC was recorded in all the rats with implanted electrodes. Then, all of the rats in toxication group received a single intragastric administration of ANIT (200 mg/kg) in order to induce acute intrahepatic cholestasis. The gastrointestinal MMC was recorded in conscious and fasting status 48, 96, 144, 192 h after ANIT was given. The levels of biliary flow, total bilirubin (TB) and alanine aminotransferase (ALT) were recorded at the same time.
RESULTS: Forty-eight hours after ANIT was given, the biliary flow of rats in toxication group was almost ceased completely while the levels of ALT and TB were increased remarkably. Then, they were all improved gradually till the 192th hour. A typical MMC pattern was seen in all the normal conscious and fasting rats, and disappeared temporarily after ANIT was given. One hundred and forty-four hours later, the MMC pattern began to restore gradually and recovered at the 192th hour. However, the prolonged cycle duration of MMC (911.67 ± 140.47 s vs 682.87 ± 77.39 s, P < 0.05) was observed in the toxication group at the 192th hour and characterized by an increased duration of phase Ⅱ-like activity (414.12 ± 69.21 s vs 150.28 ± 35.45 s, P < 0.05) and decreased duration of phase Ⅲ activity (121.21 ± 27.38 s vs 170.27 ± 38.98 s, P < 0.05).
CONCLUSION: MMC disappearance followed by a prolonged MMC is the pattern of MMC changes in the weaned rats with ANIT-induced intrahepatic cholestasis, and this may be related with the decrease of bile flow during the interdigestive periods.
- Citation: Hu YL, Wang XD, Huang ZH. Changes of gastrointestinal interdigestive migrating myoelectric complex in rat intrahepatic cholestasis induced by alpha-naphthyl-isothiocyanate. Shijie Huaren Xiaohua Zazhi 2006; 14(32): 3098-3102
- URL: https://www.wjgnet.com/1009-3079/full/v14/i32/3098.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i32.3098
胃肠消化间期运动表现为一种周期性、时相性、静息与收缩循环往复的运动, 称为消化间期移行性复合运动[1]. 以电活动为指标研究胃肠消化间期运动时, 将这种周期性变化称为消化间期移行性肌电复合波(migrating myoelectric complex, MMC). 近年来, 有关胆道阻塞时胃肠MMC变化的报道日益增多[2-3], 而婴儿期急性肝内胆汁淤积时胃肠MMC的变化尚未见报道. 我们以刚断乳的SD大鼠为对象, 在大鼠胃窦、十二指肠、空肠慢性埋置电极后7-10 d, 一次性给予异硫氰酸萘酯(ANIT)诱导大鼠急性肝内胆汁淤积模型, 观察急性胆汁淤积时胃肠道MMC、胆汁流量的变化, 并初步探讨胃肠MMC的变化与胆汁淤积的关系.
健康刚断乳的SD大鼠(体质量100-120 g)56只, 雌雄各半, 由华中科技大学同济医学院实验动物中心提供. 大鼠一天两次进食, 自由饮水. 所有鼠实验前均适应性喂养3 d. ANIT购自美国Sigma公司, 临用前用麻油按4 g/L的浓度配制; 聚四氟乙烯薄膜包绕的AF-250A特种导线, 购自上海信息产业部电子第23研究所; 多导生理记录仪(RM-6240), 购自中国成都仪器厂.
56只SD大鼠被随机分为正常对照组(16只)、中毒组(40只). 各组分别随机取8只在大鼠胃窦、十二指肠、空肠分别慢性埋置3对银丝电极; 其余大鼠同时行假手术. 电极的埋置方法如下: 将导线剪成约每根25 cm长, 每根导线距末端1 cm处小心的去除约1 mm长度的聚四氟乙烯外膜, 裸露出的银丝作为电极使用. 实验前晚导线用0.1 g/L新洁尔灭浸泡过夜. 大鼠实验前禁食12 h, 用氯胺酮(75 mg/kg, ip)麻醉后, 常规开腹, 以24 G的针头作套针正切的穿过肠壁浆肌层, 分别使每根导线的裸露段银丝停在胃肠肌层里作为记录电极. 将导线用丝线扎紧, 防止电极移动脱落. 每对电极相距约2 mm, 分别位于大鼠的胃窦(距幽门近端0.5 cm)、十二指肠(距幽门1.0 cm)、空肠(距幽门20 cm), 其连线与空腔脏器长轴垂直. 在肩胛间区及右上腹之间用手术钳做皮下隧道, 钳夹包有6根导线的硅胶管(内径0.4 cm)通过皮下隧道. 术中用生理盐水保持脏器湿润, 关腹前向腹腔内注入3 mL生理盐水以补充术中所丧失的液体量, 用1号丝线逐层关闭腹壁. 术中严格遵循无菌操作. 术后大鼠置37 ℃温室内2-4 h后将其分笼单独饲养. 假手术组大鼠术前禁食12 h, 用氯胺酮(75 mg/kg, ip)麻醉后, 常规开腹, 翻动胃肠, 暴露腹腔约半小时后, 向腹腔内注入3 mL生理盐水以补充术中所丧失的液体量, 用1号丝线逐层关闭腹壁. 术中严格遵循无菌操作. 术后按手术组同样条件饲养.
术后7-10 d, 埋置电极大鼠均在清醒、空腹、自由活动状态下记录MMC. 每次进行肌电活动记录前均禁食16-18 h, 置大鼠于一小笼内, 可自由活动, 在清醒状态下进行记录, 每只大鼠每次记录1 h以上, 期间至少记录到2-3个MMC. 采用计算机控制的多道生理记录仪记录胃肠肌电活动. 参数设置为: 采样频率1 kHz, 时间常数0.02 s, 滤波频率100 Hz, 信号幅度以μV记. 然后, 按200 mg/kg一次性给中毒组大鼠灌服ANIT来诱发大鼠急性肝内胆汁淤积病变. ANIT按4 g/L的浓度溶于麻油, 正常对照组同时给予等量的麻油灌胃. 于ANIT灌胃后48, 96, 144和192 h记录中毒组及正常对照组埋置电极大鼠胃肠MMC, 并观察其变化. 正常对照假手术组(8只)在ANIT灌胃后48 h, 中毒组假手术大鼠在48, 96, 144和192 h各时间点(每一时间点8只为一亚组)、经水合氯醛(250 mg/kg, ip)麻醉后, 胆总管插管引流胆汁并经股静脉采血1 mL, 置少量肝素钠抗凝试管内, 3000 r/min分离血浆采血, 送检谷丙转氨酶(ALT)及总胆红素(TB). 所有假手术组大鼠在相应的时间点引流胆汁、采血后处死.
统计学处理 观察肝内胆汁淤积前后MMC变化、记录MMC周期恢复时间并在ANIT造模后192 h测量胃窦、十二指肠、空肠的MMC周期持续时间及Ⅰ、Ⅱ、Ⅲ相的时程、Ⅲ相的幅度等参数. 数值以mean±SD表示. 分析采用SPSS 12.0软件包进行显著性检验, P<0.05为有统计学意义.
喂养ANIT后的实验组大鼠均不同程度的表现为精神萎靡、毛发零乱失去光泽、活动量减少、食欲减退、尿色变黄等变化; 对照组无明显变化.
正常大鼠胆汁引流量为1.56±0.27 mL/h; ANIT灌胃后48 h中毒组胆汁引流量为0, 48 h后逐渐恢复. ANIT灌胃后ALT, TB逐渐上升, 于48 h达高峰, 其后逐渐恢复, 在192 h时基本恢复正常(表1).
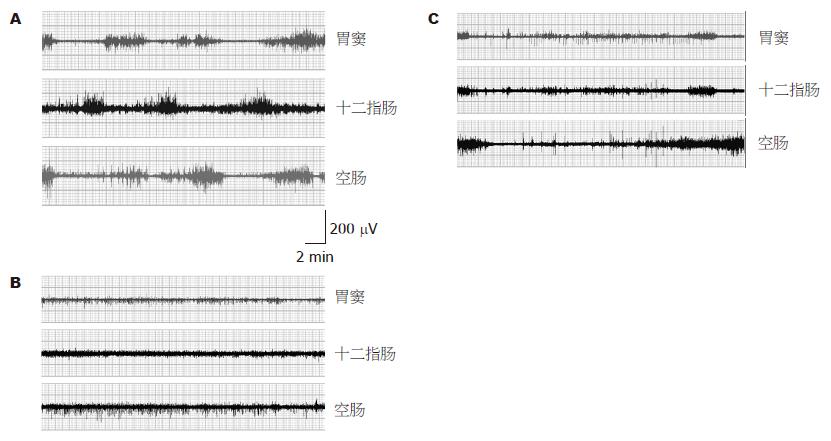
胃肠典型的MMC可人为地划分为四相: Ⅰ相为静止相, 没有或仅有极少的峰电活动; Ⅱ相有间歇的、不规律的峰电活动; Ⅲ相有规律的、密集的、高波幅的峰电爆发; Ⅳ相峰电频率及波幅逐渐降低至Ⅰ相水平. ANIT灌胃前, 埋置了电极的所有大鼠在清醒、空腹、自由活动状态下, 在胃窦、十二指肠、空肠均可清楚的记录到比较典型的MMC胃肠肌电活动(图1A), 其MMC周期持续时间(682.87±77.39 s)、Ⅰ, Ⅱ, Ⅲ, Ⅳ相的时程(分别为313.36±63.10 s, 150.28±35.45 s, 170.27±38.98 s, 50.62±17.68 s)、Ⅲ相最大波幅(196.67±19.94 μV).
ANIT灌胃后胃肠肌电活动紊乱, 表现为MMC节律完全消失, 代之以Ⅱ相样节律紊乱波(图1B), 持续一段时间后, MMC节律逐渐恢复; 192 h时中毒组所有大鼠MMC节律恢复后, 其周期与对照组比较, 提示MMC周期延长, 主要表现为Ⅱ相明显延长, 而Ⅲ相持续时间略缩短(表2, 图1C).
| 参数 | 胃窦 | 十二指肠 | 空肠 | |||
| 正常对照组 | 中毒组 | 正常对照组 | 中毒组 | 正常对照组 | 中毒组 | |
| MMC周期持续时间(s) | 683.25±79.88 | 891.38±129.67a | 686.38±82.19 | 917.63±165.94a | 686.38±82.19 | 917.63±165.94a |
| Ⅱ期持续时间(s) | 150.47±37.09 | 404.50±69.61a | 156.75±40.53 | 410.88±80.48a | 156.75±40.53 | 410.88±80.48a |
| Ⅲ期持续时间(s) | 179.81±53.02 | 113.75±27.75a | 162.75±31.24 | 122.13±29.15a | 162.75±31.24 | 122.13±29.15a |
| Ⅲ期波幅(µV) | 195.87±23.56 | 179.63±23.56 | 202.65±21.99 | 186.91±15.91 | 202.65±21.99 | 186.91±15.91 |
由于ANIT诱发肝损伤的生物化学和病理改变与人肝内胆汁淤积性肝病相似, 所以被广泛用于诱导肝内胆汁淤积模型[4]. ANIT进入大鼠体内后, 首先在肝脏内与谷胱甘肽结合并失去毒性. 随后, ANIT-谷胱甘肽复合物被分泌到胆汁中. 由于他们不太稳定, 很快就发生分离. 胆汁中出现高浓度的ANIT, 直接损伤胆管上皮细胞. 同时肝细胞和胆道上皮细胞间的紧密连接的通透性增加, 一些具有渗透活性的物质从胆汁反流入血浆, 引起肝细胞的损害. Kosser et al[4]发现, ANIT引起的胆汁淤积有时相性变化. 给予ANIT16-24 h后, 表现为胆流几乎中断、血浆中胆汁成分增加, 48 h时血浆中总胆红素、谷丙转氨酶达峰值, 然后逐步恢复. 我们的结果与此一致.
同时, 我们的实验结果还提示: 在急性肝内胆汁淤积的大鼠, 他们的胃肠MMC发生了明显的改变: 给予ANIT后48 h, 胃肠MMC节律性运动完全消失, 代之以持续、不规则、低波幅的Ⅱ期样运动. 持续4-6 d后, MMC节律性运动逐渐恢复, 但MMC周期较正常对照组明显延长, 其中主要为Ⅱ期延长的结果.
自从1969年Szurszewski第一次详细的描述了狗的MMC以来, 人们对他进行了深入的研究[1]. 但有关其产生和调节的机制目前仍不是很清楚. 近年的研究表明在消化间期, 胆汁排泌进入十二指肠及胆汁酸的肠肝循环在胃窦及十二指肠MMC Ⅲ期的产生及调节中起重要作用. Ozeki et al[5]完全外引流狗胆汁后, 发现狗十二指肠无MMC发生, 3天后空肠出现MMC并向远端传导; 恢复正常的胆汁流, 或者在引流胆汁情况下, 十二指肠或空肠内灌注狗自己或其他狗的胆汁, 十二指肠出现规律的MMC. 切除了十二指肠的狗, 其胃窦MMC完全消失, 代之以不规则、稀疏的Ⅱ相样波[6], 直接证明胆汁及其肝肠循环为启动MMC所必需的. Kajiyama et al[7]完全外引流狗胆汁后胃肠MMC节律运动消失, 而外周静脉及门静脉输入熊去氧胆酸均能使胃肠MMC节律恢复. 他们推测在狗门静脉或肝胆道内, 存在感知一定胆酸浓度阈的感受器, 十二指肠的胆汁被小肠输送到回肠吸收. 吸收后的胆酸作用于这种感受器, 激发胃肠正常周期运动. Fang et al[3]结扎大鼠胆总管造成胆汁阻塞后, 早期胃窦、十二指肠MMC节律消失, 代之以空肠起源的MMC; 4 d后十二指肠MMC节律逐渐恢复, 但MMC周期延长, 以Ⅱ相延长为主. 在人类, 也有类似的发现: 十二指肠引流可使MMCⅢ相减少, MMC周期延长[8-9]; 用消胆胺人工清除健康人十二指肠胆酸盐后, 发现MMC周期及Ⅱ相明显延长[10]. 我们的实验证明, ANIT(200 mg/kg)灌胃后48 h时胆流中断, 胆汁引流量为0; 此时胃肠MMC节律消失, 这类似于胆汁完全外引流的状况; 随着肝脏损害的逐步恢复, 胆汁引流量逐步增加, 96 h时平均为0.34±0.11 mL/h, 排入肠腔的胆汁仍少, 此时MMC节律未恢复; 144 h时增加为平均0.71±0.16 mL/h, 此时部分大鼠MMC节律随着胆汁流量的增加, 开始恢复; 在中毒后192 h, 胆汁引流量为1.19±0.27 mL/h, 已明显恢复, 此时所有大鼠可见MMC节律, 但MMC周期延长, 以Ⅱ相延长为主, Ⅲ相略缩短. 由于大鼠胆汁淤积时胃肠MMC的改变与胆汁流量的变化在时间上的一致性, 因此我们推测: 急性肝内胆汁淤积时, 肝细胞、毛细胆管受损, 胆流明显减少或中断, 消化间期进入十二指肠的胆汁过少, 从而到达回肠胆汁相应的减少, 致胆汁酸重吸收减少, 不能激活相应的胆酸盐受体, 从而不能引起MMC Ⅲ相有关. MMC Ⅲ相消失后表现为Ⅱ相样运动的原因与MMC各相的产生机制有关[11]. 在MMCⅠ, Ⅱ, Ⅲ, Ⅳ相中, Ⅱ相活动是胃肠消化间期的背景活动. 在神经、激素、肠腔内化学物质等的刺激下, 胃肠道产生MMC Ⅲ相活动, 他通过小肠-小肠反射在一定距离的胃肠近端产生抑制作用, 引起MMCⅠ相活动, 而MMCⅣ相可能是抑制作用逐渐解除的结果. 故当十二指肠内胆汁减少时, 胃肠道由于不能产生Ⅲ相活动, 从而不能引起Ⅰ、Ⅳ相活动, 表现出Ⅱ相样活动.
Ozeki et al[5]研究结果表明, 无论是完全外引流胆汁, 还是结扎胆总管, 其胃肠MMC节律消失3-4 d后, 空肠首先出现MMC节律运动, 其后十二指肠MMC可逐渐恢复. 有学者认为, 胃窦MMC是由胆汁排泌入十二指肠, 刺激胃动素释放引起的; 而十二指肠MMC的起源有多种机制[12]. 空肠MMC在胃十二指肠节律消失后可代偿性出现[3]. 本实验结果显示, 胃肠MMC节律消失时间持续较长, 而且胃窦、十二指肠、空肠节律同时恢复. 我们推测, 尚有其他的机制参与了急性肝内胆汁淤积时胃肠MMC的改变. 有研究认为TNF-α, IL -1β等前炎症因子可抑制胃肠MMC活动[13-14]; 结合我们前期的实验结果, ANIT诱导的急性肝内胆汁淤积在48 h, IL-6与TNF-α等前炎症因子含量就明显升高[15], 故我们推测, 急性肝内胆汁淤积时由于前炎症因子的增加, 进一步抑制了胃肠MMC.
总之, 急性肝内胆汁淤积时, 胃肠MMC节律消失或周期延长. 其原因可能与消化间期排泌入胃肠的胆汁流量减少及TNF-α, IL-1β等前炎症因子增多有关, 但尚需进一步的深入研究.
近年来, 胃肠动力学研究是消化系统的一个新的研究热点. 消化间期移行性复合运动是胃肠消化间期的一种特征性的运动形式, 由于他在消化间期可周期性的出现, 从而被用作反映胃肠运动状况的特异指标. 消化间期MMC的启动及调节包括神经及体液等多种因素. 有研究认为, 胆汁在胃肠MMC的启动及调节中起重要的作用. 有关消化间期胆汁排泌进入十二指肠对消化间期MMC的启动及调节作用, 人们进行了大量的研究, 但由于动物的种类不同、实验方法不同等各种原因, 目前仍没有完全统一的结论.
本文以幼年刚断乳的大鼠为研究对象, 以期初步了解婴儿期急性肝内胆汁淤积时胃肠MMC的变化, 这在国内目前尚未见报道. 同时, 本篇文章利用ANIT在动物体内形成胆汁淤积具有时相性, 先引起胆流中断, 后胆流逐渐恢复的特点, 在不同胆汁流量的情况下观察了胆汁对胃肠MMC的影响.
本文以刚断奶的大鼠为研究对象, 初步探讨了婴儿胆汁淤积时胃肠MMC的变化及部分可能的机制, 为临床干预婴儿肝内胆汁淤积时存在的胃肠功能的改变有一定的指导意义.
消化间期移行性肌电复合波(MMC): 是消化间期胃肠平滑肌存在的周期性肌电活动, 他也分为四期. Ⅰ期: 带锋电位的慢波少于5%; Ⅱ期锋电位逐渐增多, 带锋电位的慢波达5%-95%; Ⅲ期锋电位的频率和振幅明显增加, 几乎每个慢波都带锋电位, 收缩运动强烈; Ⅳ期锋电位的数目突然减少, 是由第三期转入新周期的移行阶段. 他与消化间期移行性复合运动完全吻合, 只有在消化间期移行性复合肌电周期中出现峰电活动时才出现胃肠的机械收缩, 而且胃肠机械收缩的力量、时间与峰电位的频率、数量、振幅有关.
文章探讨急性肝内胆汁淤积胃肠消化间期移行性肌电复合波的变化, 以此证明肝内胆汁淤积对胃肠动力的影响, 提供了有意义的信息, 具有重要的意义及价值, 内容较新, 符合伦理学的要求.
编辑: 张焕兰 电编:李琪
| 1. | Szurszewski JH. A migrating electric complex of canine small intestine. Am J Physiol. 1969;217:1757-1763. [PubMed] |
| 2. | Nieuwenhuijs VB, van Dijk JE, Gooszen HG, Akkermans LM. Obstructive jaundice, bacterial translocation and interdigestive small-bowel motility in rats. Digestion. 2000;62:255-261. [PubMed] |
| 3. | Fang P, Dong L, Zhang WJ, Luo JY. Relationship between entero-hepatic bile acid circulation and interdigestive migrating myoelectrical activity in rats. World J Gastroenterol. 2005;11:5377-5380. [PubMed] |
| 4. | Kossor DC, Meunier PC, Handler JA, Sozio RS, Goldstein RS. Temporal relationship of changes in hepatobiliary function and morphology in rats following alpha-naphthylisothiocyanate (ANIT) administration. Toxicol Appl Pharmacol. 1993;119:108-114. [PubMed] |
| 5. | Ozeki K, Sarna SK, Condon RE, Chey WY, Koch TR. Enterohepatic circulation is essential for regular cycling of duodenal migrating motor complexes in dogs. Gastroenterology. 1992;103:759-767. [PubMed] |
| 6. | Suzuki H, Mochiki E, Haga N, Shimura T, Itoh Z, Kuwano H. Effect of duodenectomy on gastric motility and gastric hormones in dogs. Ann Surg. 2001;233:353-359. [PubMed] |
| 7. | Kajiyama Y, Irie M, Enjoji A, Ozeki K, Ura K, Kanematsu T. Role of bile acids in duodenal migrating motor complexes in dogs. Dig Dis Sci. 1998;43:2278-2283. [PubMed] |
| 8. | Nilsson I, Svenberg T, Hedenborg G, Lordal M, Hellstrom PM. Inhibition of the migrating motor complex by duodenal drainage in man. Neurogastroenterol Motil. 1995;7:31-37. [PubMed] |
| 9. | Nilsson I, Svenberg T, Hellstrom PM. Duodenal drainage reduces cycling frequency of the migrating motor complex in humans. Acta Physiol Scand. 1993;149:525-526. [PubMed] |
| 10. | Portincasa P, Peeters TL, van Berge-Henegouwen GP, van Solinge WW, Palasciano G, van Erpecum KJ. Acute intraduodenal bile salt depletion leads to strong gallbladder contraction, altered antroduodenal motility and high plasma motilin levels in humans. Neurogastroenterol Motil. 2000;12:421-430. [PubMed] |
| 11. | Lang IM, Sarna SK, Condon RE. Generation of phases I and II of migrating myoelectric complex in the dog. Am J Physiol. 1986;251:G201-G207. [PubMed] |
| 12. | Stolk MF, van Erpecum KJ, Smout AJ, Akkermans LM, Jansen JB, Lamers CB, Peeters TL, vanBerge-Henegouwen GP. Motor cycles with phase III in antrum are associated with high motilin levels and prolonged gallbladder emptying. Am J Physiol. 1993;264:G596-G600. [PubMed] |
| 13. | Huang ZH, Huang X, Li Y. Changes and significance of tumor necrosis factor-alpha and interleukin-6 level in plasma and bile during the formation of acute intrahepatic cholestasis in New Zealand white rabbits. Zhonghua Gan Zang Bing Za Zhi. 2003;11:313. [PubMed] |
| 14. | Guerrero-Lindner E, Castro M, Munoz JM. Central tumour necrosis factor-alpha mediates the early gastrointestinal motor disturbances induced by lipopolysaccharide in sheep. Neurogastroenterol Motil. 2003;15:307-316. |
| 15. | Fargeas MJ, Fioramonti J, Bueno L. Central action of interleukin 1b on intestinal motility in rats: mediation by two mechanisms. Gastroenterology. 1993;104:377-383. |