修回日期: 2006-09-10
接受日期: 2006-09-21
在线出版日期: 2006-11-18
目的: 通过观察TNF-α对肾组织中Ⅰ型IP3R表达的影响来探讨肝肾综合征的发病机制.
方法: 制备大鼠离体肾灌注模型, 随机分成对照组(A组)、肝素处理组(B组)、TNF-α处理组(C组), 留取的标本应用免疫组织化学技术、Western blot及实时定量PCR检测肾组织Ⅰ型IP3R蛋白的定位、表达及mRNA的变化.
结果: Ⅰ型IP3R主要分布于肾小球系膜细胞和血管平滑肌细胞的胞质内. 免疫组化结果显示, C组与A组相比棕褐色颗粒着色的阳性细胞明显增多, 有显著性差异(U = 2.26, P<0.05); B组与A组相比阳性染色细胞无明显减少(P>0.05); Western blot结果与免疫组织化学结果相一致: C组与A组相比Ⅰ型IP3R蛋白表达水平明显增高, 有显著性差异(1.89±0.11 vs 0.55 ± 0.03, P<0.05); B组与A组相比无显著性差异(P>0.05); 实时定量PCR结果显示: C组与A组相比Ⅰ型IP3R mRNA的表达水平明显增高, 有显著性差异(7.99±0.12 vs 1.00±0.05, P<0.05); B组与A组相比无显著性差异(P>0.05).
结论: TNF-α可增强肾小球系膜细胞和血管平滑肌细胞Ⅰ型IP3R蛋白的表达, 且Ⅰ型IP3R mRNA也呈增加趋势.
引文著录: 闻颖, 马力, 刘沛. 肿瘤坏死因子-α增强肝肾综合征时肾脏I型1, 4, 5-三磷酸肌醇受体表达. 世界华人消化杂志 2006; 14(32): 3088-3092
Revised: September 10, 2006
Accepted: September 21, 2006
Published online: November 18, 2006
AIM: To clarify the mechanisms of renal vasoconstriction in hepatorenal syndrome (HRS) by investigating the effect of tumor necrosis actor-α (TNF-α) on the expression of type 1 inositol 1,4,5-triphosphate receptors (IP3R) in renal tissues.
METHODS: Ex vivo perfused rat kidney model was used in this study. Male Wistar rats were randomly divided into 3 groups: control group (group A), heparin (10 mg/L) treatment group (group B), and TNF-α (1 μg/L) treatment group (group C). After perfusion, immunohistochemical staining, Western blot, and real-time quantitative polymerase chain reaction (RTQ-PCR) were used to detect the distribution and expression of type 1 IP3R in renal tissues.
RESULTS: Immunohistochemical staining showed that type 1 IP3R protein was localized at the plasma region of glomerular mesangial cells and vascular smooth muscle cells in rat kidney, and the number of positive cells was significantly higher in group C than that in group A (U = 2.26, P < 0.05). However, there was no marked difference between group A and B (P > 0.05). Western blot demonstrated a consistent result with immunohistochemistry did. The protein expression of type 1 IP3R was significant higher in group C than that in group A (1.89 ± 0.11 vs 0.55 ± 0.03, P < 0.05), and there was no marked difference between group A and B (P > 0.05). RTQ-PCR showed that the mRNA expression of type 1 IP3R was dramatically increased in group C as compared with that in group A (7.99 ± 0.12 vs 1.00 ± 0.05, P < 0.05), and no marked difference exists between group A and B (P > 0.05).
CONCLUSION: TNF-α can enhance the protein and mRNA expression of type1 IP3R in glomerular mesangial cells and vascular smooth muscle cells from kidney.
- Citation: Wen Y, Ma L, Liu P. Tumor necrosis factor-α enhances the expression of type 1 inositol 1,4,5-triphosphate receptors. Shijie Huaren Xiaohua Zazhi 2006; 14(32): 3088-3092
- URL: https://www.wjgnet.com/1009-3079/full/v14/i32/3088.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i32.3088
肝肾综合征(hepatorenal syndrome, HRS)是重型肝炎严重并发症之一, 是由多种因素引起肾脏血流灌注减少所致的功能性肾衰竭, 其发病机制至今尚未完全阐明. 目前认为, 外周动脉扩张是导致肾功能损害的始动因素[1], 肾血管收缩引起肾皮质血流量减少促进HRS的发生、发展[2]. 肿瘤坏死因子-α(tumor necrosis actor-a, TNF-α)是引起重型肝炎发生的重要因子[3]. TNF-α可引起肾血管收缩[4]. 1,4,5-三磷酸肌醇受体(inositol 1, 4, 5-triphosphate receptors, IP3R)可介导细胞内钙释放和细胞外钙内流从而引起肾血管收缩[5-6]. 已知很多细胞因子可上调或下调IP3R蛋白的表达[7]. 为了弄清TNF-α能否影响肾脏Ⅰ型IP3R表达, 为了排除血浆中其他生物活性物质干扰, 我们应用离体灌注肾技术[8](isolated perfused kidney technique, IPK)观察TNF-α处理后大鼠肾脏Ⅰ型IP3R表达的变化, 探讨TNF-α在肝肾综合征肾血管收缩机制中的作用.
♂Wistar大鼠60只, 周龄10-12 wk、体质量260-320 g(由中国医科大学实验动物中心提供). TNF-α(Sigma公司); Ⅰ型IP3R抗体(组化用, Santa Cruz公司); Ⅰ型IP3R抗体(Western用, US biological); 免疫组化试剂盒(北京中山生物技术有限公司); DAB显色试剂盒(武汉博士德生物工程有限公司); 逆转录试剂盒ExScriptTM RT Reagent Kit、PCR试剂盒SYBR® premix EX TaqTM(TaKaRa); 大鼠Ⅰ型IP3R及GAPDH标准品、引物均由大连宝生物工程有限公司制备; BCA蛋白浓度测定试剂盒(碧云天公司); BCIP/NBT liquid substrste system(Sigma公司).
1.2.1 离体灌注肾模型制备[8]: 制备离体灌注肾模型及配制Kreb's灌流液. 动物随机分3组, 每组20只, 即: 单纯Kreb's液灌流(A组)、10 mg/L肝素Kreb's液灌流(B组)、1 μg/L TNF-αKreb's液灌流(C组), 灌流120 min. 本实验离体肾灌流120 min内血流动力学稳定, 即灌注压稳定在80 mmHg左右, 肾脏的水肿率<30%; 且灌流后的肾脏标本经病理检查均未发现明显的器质性损伤. 灌流结束时, 1/2肾标本用40 g/L的多聚甲醛固定24 h, 石蜡包埋备组化用; 1/2肾标本置-70 ℃冰箱保存备组织蛋白及RNA的提取.
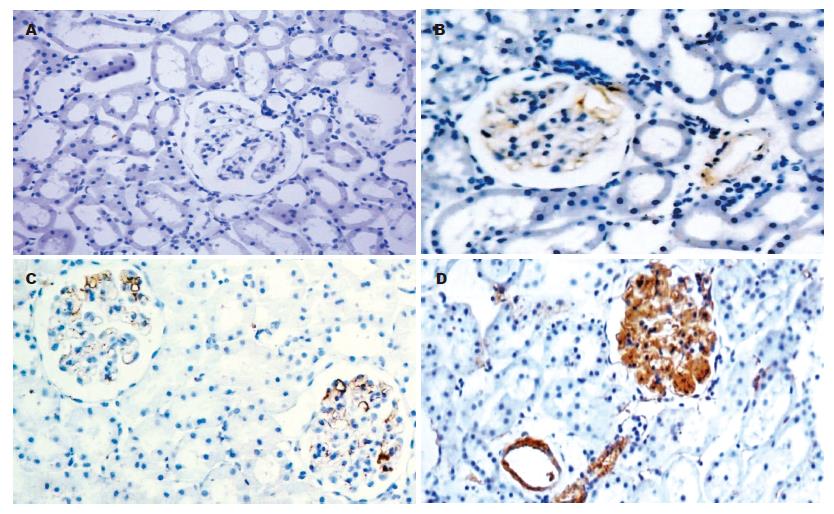
1.2.2 免疫组化染色检测Ⅰ型: IP3R用PBS液代替一抗做空白对照. 石蜡切片脱蜡水化; 30 mL/L双氧水室温20 min, PBS洗片; 1 g/L胰蛋白酶室温15 min, PBS洗片; 正常兔血清封闭37 ℃ 20 min, 勿洗; 一抗1:100(4 ℃, 过夜), PBS洗片; 二抗(生物素化兔抗羊IgG)37 ℃ 30 min, PBS洗片; SABC液(辣根酶标记链霉卵白素工作液)37 ℃ 15 min, PBS洗片; DAB显色室温10 min, 水洗; 苏木素复染, 脱水透明, 树胶封片. 免疫组化结果判断: 细胞胞质内棕褐色颗粒为阳性细胞. 在高倍镜下选择有代表性视野计数1000个肾皮质细胞中的阳性细胞数. 结果分为4级: 未见阳性细胞为(-), 阳性细胞数在0-250之间为(+), 阳性细胞数在250-500之间为(++), 阳性细胞数>500为(+++).
1.2.3 Western blot分析: Ⅰ型IP3R蛋白表达组织蛋白抽提: 100 mg新鲜组织剪碎, PBS洗两次. 加蛋白裂解液, 超声波匀浆4 ℃过夜, 12 000 g离心1 h, 收集上清液, -80 ℃保存. BCA法进行蛋白浓度测定. 用蒸馏水将蛋白样品调成相同浓度, 加入相同体积上样缓冲液, 沸水煮5 min进行蛋白变性. 加样孔注入提取液(蛋白30 μg)及标准分子量蛋白, 100 V电泳3 h. 将电泳凝胶上的蛋白质电转印到PVDF上, 50 V电泳2 h; PBST洗膜两次, 用含50 g/L脱脂奶粉的PBST封闭过夜. PBST洗4 次; PVDF膜上加一抗(1:1000兔抗大鼠Ⅰ型IP3R)在室温孵育2 h; PBST洗膜; 加二抗(1:2000碱性磷酸酶标记的羊抗兔IgG), 室温孵育2 h; PBST洗膜; 加BCIP/NBT底物显色, 观察相对分子质量230 kDa处蓝紫色蛋白印迹. 以β-actin作为内参, 相对分子质量45 kDa. IP3R蛋白含量 = 样本IP3R蛋白灰度值/同一样本β-actin灰度值.
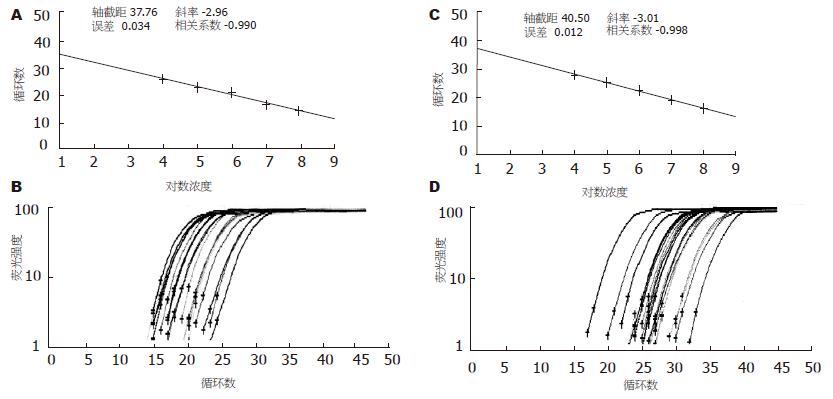
1.2.4 实时定量PCR组织总RNA提取: TRIzol一步法提取总RNA, 分光光度法测定RNA纯度和量, 用RNA稀释液稀释成100 g/L. 采用SYBR GreenⅠ荧光染料嵌合法按照试剂盒说明两步法扩增Ⅰ型IP3R基因, GAPDH作内参. 先将构建的目的基因(Ⅰ型IP3R基因)和管家基因(GAPDH)的RNA标准品梯度稀释(108, 107, 106, 105, 104 copies/μL)作为模板进行Real Time RT-PCR反应, 制作标准曲线. 再利用标准曲线对样品中的目的基因和管家基因分别进行定量. 通过管家基因的校正, 检测各组肾组织中Ⅰ型IP3R基因的相对表达量. Ⅰ型IP3R mRNA的相对表达量 = Ⅰ型IP3R基因拷贝数/GAPDH基因拷贝数, 校正结果以对照组为1, 其余组与之相比较. 引物序列如下: GAPDH-F: 5'-GACAACTTTGGCATCGTGGA-3', GAPDH-R: 5'-ATGCAGGGATGATGTTCTGG-3', 产物片段133 bp; IP3R-F: 5'-GGAAACAGCAGCCAAGAAGG-3', IP3R-R: 5'-ACACACCTCTGGACTTGGATGA-3', 产物片段122 bp. RT反应条件: 42 ℃ 10 min; 95 ℃ 2 min. PCR反应条件: 95 ℃ 10 s; 95 ℃ 5 s, 60 ℃ 20 s, 45 cycles. 制作溶解曲线: 上述PCR产物进行60 ℃ 1 min; 95 ℃ 20 s, 在60-95 ℃之间梯度升温0.2 ℃/s绘制溶解曲线. Ⅰ型IP3R及GAPDH的溶解曲线均为单峰, 证明PCR产物单一.
统计学处理 计量资料实验数据以均值±标准差表示, 各组间的比较采用两样本等方差t检验, P<0.05具有统计学意义. 等级资料(免疫组化法检测Ⅰ型IP3R)设4个强度, 采用非参数统计方法-校正公式的秩和检验, P<0.05具有统计学意义.
棕褐色的阳性颗粒主要分布在肾小球系膜细胞和血管平滑肌细胞的胞质内. 与对照组相比, TNF-α处理组Ⅰ型IP3R的表达明显增强(U = 2.26, P<0.05); 而肝素处理组与对照组相比, Ⅰ型IP3R的表达未见明显减弱(P>0.05, 表1, 图1).
各组均可见230 kDa处特异性Ⅰ型IP3R的蛋白条带及45 kDa处β-actin蛋白条带, 对各条带进行灰度分析发现: C组与A组相比Ⅰ型IP3R蛋白的表达明显增高, 有显著性差异(1.89±0.11 vs 0.55±0.03, P<0.05); B组与A组相比无显著性差异(P>0.05, 表2, 图2).
重型肝炎和肝硬化晚期常并发HRS, 预后极差. 普遍认为, HRS发生是肾血管收缩造成的肾脏血流量锐减所致. HRS患者血清中许多缩血管活性物质(如儿茶酚胺、血管紧张素Ⅱ、血管加压素、血栓素A2、内皮素、白三烯等)均明显增高, 提供了HRS肾血管收缩的前提[9-10]. 内皮素等缩血管活性物质是通过刺激胞内第二信使1,4,5-三磷酸肌醇(IP3)产生发挥作用的[11]. IP3R是胞内钙贮库, 存在于内质网中. IP3R与IP3结合后发生构象改变[12], 导致通道开放, 内质网中的储备钙被释放到细胞质中, 胞质游离Ca2+浓度升高引起细胞收缩[13]. 细胞膜上也有IP3R, 可直接或间接介导钙内流. 因此肾脏IP3R表达的多少与肾脏对缩血管物质的敏感性有着密切联系. IP3R共有4种类型, 肾脏的Ⅰ型IP3R主要存在于肾小球系膜细胞、血管平滑肌细胞[14]. 血管平滑肌细胞收缩引起肾血流量减少; 肾小球系膜细胞收缩不仅使肾小球血管阻力增加, 还可导致肾小球滤过面积减少; 两者均收缩导致肾小球滤过率急剧减少[15]. HRS患者血中TNF-α浓度升高并参与肾血管收缩[16]; TNF-α能增加肾脏对缩血管物质的敏感性[17]; TNF-α可增加细胞外Ca2+内流[18]; TNF-α可参与胞内钙释放[19]. TNF-α增加肾小球前小动脉平滑肌细胞IP3R蛋白和IP3RmRNA表达[20]. 因此弄清TNF-α与IP3R的关系, TNF-α是否通过上调Ⅰ型IP3R表达来增加肾脏对缩血管物质的敏感性是我们的研究方向. 本实验设立肝素处理组旨在与TNF-α处理组形成对照, 因为肝素是IP3R的竞争性抑制剂, 可抑制IP3与IP3R的结合, 舒张血管平滑肌[21]. 本实验结果如下: Ⅰ型IP3R主要存在于肾小球系膜细胞、血管平滑肌细胞的胞质内. TNF-α灌流组免疫组化染色显示Ⅰ型IP3R表达明显增强, 且与Western blot半定量检测结果一致, 这证实了TNF-α可通过上调Ⅰ型IP3R表达来增加肾脏对缩血管物质的敏感性. 实时定量PCR检测结果显示, TNF-α处理组Ⅰ型IP3R mRNA水平明显升高, 提示TNF-α能增强转录Ⅰ型IP3R的mRNA. 而肝素虽能舒张肾血管, 却对Ⅰ型IP3R蛋白及mRNA的表达无影响, 提示肝素对IP3R的抑制不是通过影响Ⅰ型IP3R的表达来起作用的.
总之, TNF-α可增强肾脏Ⅰ型IP3R蛋白的表达, 且Ⅰ型IP3R mRNA水平也呈上调趋势, 提示Ⅰ型IP3R蛋白的增加极可能是在转录水平进行调节的. 因此HRS患者血中高浓度TNF-α上调了肾脏Ⅰ型IP3R的表达, 增加了肾脏对缩血管物质的敏感性, 细胞内Ca2+水平骤然增高, 使肾小球前小动脉平滑肌细胞与肾小球系膜细胞收缩, 导致肾血流减少及肾小球滤过面积减少, 肾小球滤过率降低, 引发HRS.
肝肾综合征(HRS)时肾脏血流量明显减少, 其主要原因是肾脏血管收缩, 具体机制不十分清楚. 肾血管平滑肌细胞及肾小球系膜细胞内有丰富的IP3R. IP3与IP3R结合, 促进细胞内储备Ca2+释放, 引起肾血流减少. TNF-α是引起重症肝炎发生的重要因子. 那么TNF-α能否上调肾脏I型IP3R表达引起肾血管收缩呢? 本文就这一问题研究了TNF-α对肾脏I型IP3R表达的影响.
肾血管收缩是肝肾综合征时肾血流减少的主要原因, 但其发生机制是目前研究的热点. 许多因素参与其中, TNF-α占有重要地位, 但具体作用机制不清.
HRS患者血中TNF-α浓度升高. 许多文献报道TNF-α可通过多种机制参与各种病理状态时的血管收缩, 如活化PKC及抑制NO等. I型IP3R是胞内钙释放的通道, 其表达量的多少直接与肾血管收缩相关.
目前, 对肝肾综合征时肾血管收缩机制的研究主要集中在多种神经体液因素对血流动力学的影响方面上, 而对其分子水平发病机制及胞内信号转导还知之甚少. 关于肝肾综合征时TNF-对I型IP3R表达的影响还没有相应报道.
本文发现TNF-α明显增加Ⅰ型IP3R蛋白及mRNA表达, 为进一步深入研究肾血管收缩机制提供了帮助.
1, 4, 5-三磷酸肌醇受体(IP3R): IP3R共有4种类型, 各组织及细胞内IP3R的数量及类型不同. Ⅰ型IP3R主要分布于肾小球系膜细胞、血管平滑肌细胞, 其收缩引起GFR明显下降.
本文立题新颖, 学术价值较好, 实验方法较先进, 实验结果能客观证实研究结论, 研究结论对于探讨肝肾综合征的发病机制有一定的理论价值.
编辑: 张焕兰 电编:李琪
| 1. | Liu H, Gaskari SA, Lee SS. Cardiac and vascular changes in cirrhosis: Pathogenic mechanisms World. J Gastroenterol. 2006;12:837-842. |
| 3. | Takeuchi S, Goto T, Mikami K, Miura K, Ohshima S, Yoneyama K, Sato M, Shibuya T, Watanabe D, Kataoka E. Genipin prevents fulminant hepatic failure resulting in reduction of lethality through the suppression of TNF-alpha production. Hepatol Res. 2005;33:298-305. [PubMed] |
| 4. | LaMarca BB, Bennett WA, Alexander BT, Cockrell K, Granger JP. Hypertension produced by reductions in uterine perfusion in the pregnant rat: role of tumor necrosis factor-alpha. Hypertension. 2005;46:1022-1025. [PubMed] |
| 5. | Michikawa T, Hamanaka H, Otsu H, Yamamoto A, Miyawaki A, Furuichi T, Tashiro Y, Mikoshiba K. Transmembrane topology and sites of N-glycosylation of inositol 1,4,5-trisphosphate receptor. J Biol Chem. 1994;269:9184-9189. [PubMed] |
| 6. | Dellis O, Dedos SG, Tovey SC, Taufiq-Ur-Rahman , Dubel SJ, Taylor CW. Ca2+ entry through plasma membrane IP3 receptors. Science. 2006;313:229-233. [PubMed] |
| 7. | McGowan TA, Sharma K. Regulation of inositol 1,4,5-trisphosphate receptors by transforming growth factor-beta: implications for vascular dysfunction in diabetes. Kidney Int Suppl. 2000;77:S99-S103. [PubMed] |
| 8. | Taft DR. The isolated perfused rat kidney model: a useful tool for drug discovery and development. Curr Drug Discov Technol. 2004;1:97-111. [PubMed] |
| 9. | Anand R, Harry D, Holt S, Milner P, Dashwood M, Goodier D, Jarmulowicz M, Moore K. Endothelin is an important determinant of renal function in a rat model of acute liver and renal failure. Gut. 2002;50:111-117. [PubMed] |
| 10. | Zaza S, Bonny O, Liaudet L. Hepatorenal syndrome in patients with liver cirrhosis. Nephrol Ther. 2005;1:174-182. [PubMed] |
| 11. | Zhu Z, Arendshorst WJ. Angiotensin II-receptor stimulation of cytosolic calcium concentration in cultured renal resistance arterioles. Am J Physiol. 1996;271:F1239-F1247. [PubMed] |
| 12. | Hamada K, Miyata T, Mayanagi K, Hirota J, Mikoshiba K. Two-state conformational changes in inositol 1,4,5-trisphosphate receptor regulated by calcium. J Biol Chem. 2002;277:21115-21118. [PubMed] |
| 13. | White C, McGeown JG. Inositol 1,4,5-trisphosphate receptors modulate Ca2+ sparks and Ca2+ store content in vas deferens myocytes. Am J Physiol Cell Physiol. 2003;285:C195-C204. [PubMed] |
| 14. | Monkawa T, Hayashi M, Miyawaki A, Sugiyama T, Yamamoto-Hino M, Hasegawa M, Furuichi T, Mikoshiba K, Saruta T. Localization of inositol 1,4,5-trisphosphate receptors in the rat kidney. Kidney Int. 1998;53:296-301. [PubMed] |
| 15. | Kuo HT, Shin SJ, Kuo MC, Chen HC. Effects of specific endothelin-1 receptor antagonists on proliferation and fibronectin production of glomerular mesangial cells stimulated with Angiotensin Ⅱ. Kaohsiung J Med Sci. 2006;22:371-376. [PubMed] |
| 16. | Giardina JB, Green GM, Cockrell KL, Granger JP, Khalil RA. TNF-alpha enhances contraction and inhibits endothelial NO-cGMP relaxation in systemic vessels of pregnant rats. Am J Physiol Regul Integr Comp Physiol. 2002;283:R130-R143. [PubMed] |
| 17. | Wen Y, Wang JY, Liu P. Tumor necrosis factor-alpha enhances the effect of endothelin on renal vasoconstriction in isolated perfused rat kidney. Zhonghua Gan Zang Bing Za Zhi. 2003;11:583-585. [PubMed] |
| 19. | Yao YM, Hu SJ, Huang YW, Yang CH, Sun J, Zhu ZH, Wu T. Effects of tumor necrosis factor alpha on expression of phospholamban and intracellular calcium in cardiomyocytes. Zhongguo Yi Xue Ke Xue Yuan Xue Bao. 2005;27:767-771. [PubMed] |
| 21. | Ahmed T, Syriste T, Mendelssohn R, Sorace D, Mansour E, Lansing M, Abraham WM, Robinson MJ. Heparin prevents antigen-induced airway hyperresponsiveness: interference with IP3-mediated mast cell degranulation? J Appl Physiol. 1994;76:893-901. [PubMed] |