修回日期: 2006-07-20
接受日期: 2006-08-14
在线出版日期: 2006-11-08
目的: 分析肝癌组织与正常肝组织中血衍吗啡素类肽含量的差异并探究其意义.
方法: 肝癌患者12例, 利用弱酸洗涤法从肝癌细胞和肝细胞表面提取肽段, 然后用高压液相(HPLC)和质谱分析这些肽段并进行差异比较, 筛选肿瘤特异性肽段. 用这些肽段(0, 10-7, 10-8, 10-9, 10-10, 10-11, 10-12 mol/L)处理人肝癌细胞株HLE, 采用MTT法、流式细胞仪法观察其对肝癌细胞的生长、细胞凋亡的影响.
结果: 从7例患者的肝癌细胞表面成功检测出一条天然的类阿片肽--Leu-Val-Val(LVV)-血衍吗啡素-6(Mr1160.76). 不同浓度LVV-血衍吗啡素-6均对HLE细胞有抑制作用, 并且当浓度为10-7和10-8 mol/L时有显著意义(24 h: 10-7vs 10-8: P = 0.044, 10-8vs 10-9: P = 0.047; 48 h: 10-7vs 10-8: P = 0.031, 10-8vs 10-9: P = 0.040). 同时, LVV-血衍吗啡素-6可诱导HLE细胞发生凋亡(浓度为0, 10-7, 10-8, 10-9 mol/L时的凋亡率分别为0.38%±0.09%, 20.23%±1.25%, 12.64%±2.15%, 1.65%±0.34%), 而阿片受体阻断剂naloxone能够逆转这种抑制效应(以上对应浓度时凋亡率分别为0.41%±0.11%, 1.23%±0.45%, 0.98%±0.55%, 1.34%±0.43%). 两组在LVV-血衍吗啡素-6浓度为10-7和10-8 mol/L时有显著差异(P<0.05).
结论: LVV-血衍吗啡素-6为肝癌细胞的病理产物, 可激活阿片受体对肝癌细胞产生抑制作用.
引文著录: 周迈, 彭吉润, 钟朝辉, 涂向群, 常迎彬, 焦岗军, 冷希圣. 肝癌组织内类阿片肽LVV-血衍吗啡素-6的作用. 世界华人消化杂志 2006; 14(31): 3020-3025
Revised: July 20, 2006
Accepted: August 14, 2006
Published online: November 8, 2006
AIM: To assay the content differences of hemorphins between hepatocellular carcinoma (HCC) and normal liver tissues, and to explore the role of hemorphins in HCC.
METHODS: The tissue samples were obtained from 12 patients with HCC, and peptides were isolated by mild acid elution from the surfaces of hepatocarcinoma and normal hepatic cells. The mixtures of peptides were analyzed by high performance liquid chromatography (HPLC) and mass spectrometer (MS). A differential comparison was made on the fractions of peptides between HCC and normal liver cells to screen some tumor-specific peptides. Finally, human hepatocarcinoma cell line HLE was treated with different concentrations of the obtained peptides (0, 10-7, 10-8, 10-9, 10-10, 10-11, 10-12 mol/L), and the growth and apoptosis of HLE cells were detected by MTT assay and flow cytometry (FCM), respectively.
RESULTS: An opioid peptide Leu-Val-Val (LVV)-hemorphin-6 with Mr1160.76 was identified on the surfaces of HCC cells in 7 patients. LVV-hemorphin-6 inhibited the growth of HLE cells at different concentrations, especially at 10-7 and 10-8 mol/L (24 h: 10-7vs 10-8: P = 0.044, 10-8vs 10-9: P = 0.047; 48 h: 10-7vs 10-8: P = 0.031, 10-8vs 10-9: P = 0.040). Meanwhile, LVV-hemorphin-6 induced apoptosis of HLE cells and the apoptosis rates were 0.38% ± 0.09%, 20.23% ± 1.25%, 12.64% ± 2.15%, 1.65% ± 0.34%, when 0, 10-7, 10-8, 10-9 mol/L LVV-hemorphin-6 were used, respectively. However, naloxone could inhibit the above effect and the apoptosis rates were 0.41% ± 0.11%, 1.23% ± 0.45%, 0.98% ± 0.55%, 1.34% ± 0.43%, when the corresponding concentrations were used. The apoptosis rates were significantly different between the two groups (P < 0.05) as 10-7 and 10-8 mol/L LVV-hemorphin-6 were used.
CONCLUSION: LVV-hemorphin-6 may be a product in the pathophysiological process of hepatocellular carcinoma, and it has suppressive effects on HCC cells by activating opiate receptors.
- Citation: Zhou M, Peng JR, Zhong ZH, Tu XQ, Chang YB, Jiao GJ, Leng XS. Role of opioid peptide Leu-Val-Val-hemorphin-6 in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(31): 3020-3025
- URL: https://www.wjgnet.com/1009-3079/full/v14/i31/3020.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i31.3020
阿片类物质有着多种生物学活性, 他们对细胞的生长和死亡有着重要影响[1]. 血衍吗啡素(hemorphins)是近年发现的一个具有阿片样活性的肽家族, 他们的序列结构相近, 都是由血红蛋白降解产生. 该家族中, 具有生物活性的最小肽段是Tyr-Pro-Trp-Thr(hemorphin-4), 他是人类血红蛋白β链的残余片段. 家族的其他成员均是以这段序列为核心, 向C端和/或N端增加氨基酸而成[2-5]. 组织蛋白酶(cathepsin)等是其主要生成酶. 在正常情况下血衍吗啡类肽的分布具有组织特异性, 即不同组织中血衍吗啡素类肽的种类和含量均不同[2-3]. 肿瘤、炎症等病变可以引起组织或细胞状态发生改变, 导致组织中蛋白降解片段的种类和含量的改变[2-3,6-7], 血衍吗啡素类肽的含量也会发生变化. 因此, 组织中血衍吗啡素类肽的变化常常可以反应出机体的某些病变.
已有证据提示血衍吗啡素类肽可能与肿瘤的病理生理过程存在某种关联, 实验发现在肺癌、嗜铬细胞瘤等肿瘤组织中hemorphin-7含量增高[4,8]. 有学者甚至认为血清中hemorphin-7的水平可以作为判断乳癌预后的一项指标[6]. 多数学者认为血衍吗啡素的增高与肿瘤组织中组织蛋白酶的活性和含量增加有关[4,9]. 但血衍吗啡素类肽在肿瘤中的作用机制尚不明确. 我们分析肝癌(hepatocellular carcinoma, HCC)组织与正常肝组织中血衍吗啡素类肽含量的差异, 并探讨其意义.
柠檬酸、Na2HPO4和NaOH购自北京化学公司. 色谱级三氟乙酸、乙睛购自Sigma公司. 超滤离心管(Centriplus YM-3型)购自美国Millipore公司. C-18 Spe-Pak柱(经典型)购自美国Waters公司. 噻唑蓝(MTT)、碘化吡啶(PI)、纳洛酮(naloxone)系美国Sigma公司产品. RPMI 1640为Gibco公司产品. 人肝癌细胞株HLE, HepG2购自中国科学院上海细胞所. 人工合成肽LVVYPWTQR购自北京华大科技公司. 男性肝癌患者12例, 分别切取肿瘤组织和等量周围无瘤肝组织(<30 g 4例, 30-50 g 7例, >100 g 1例). 切下的组织立即用0 ℃ PBS冲洗. 使用机械法分离肿瘤细胞和肝细胞: 组织用剪刀绞碎, 然后在金属网上轻轻研磨, 500 r/min×5 min离心3次, 共获得肿瘤细胞1×109-6×109和肝细胞1×109-8×109.
用弱酸洗涤法从肿瘤和肝细胞表面提取结合肽, 肽混合液分别用反相HPLC系统(安捷伦, HP1100型)进行分馏. 样品注入C18柱(4.6 mm×150 mm, Waters), 进行梯度洗脱, B液为0-1000 g/L乙睛, A液为1 g/L三氟乙酸, 梯度设置如下: 0 to 0 B 10 min, 0 to 600 g/L B 60 min, 600 g/L to 1000 g/L B 10 min, 1000 g/L to 1000 g/L B 10 min, 流速1 mL/min. 紫外检测215, 254 and 280 nm. 每分钟收集一个馏分, 冻干, -20 ℃保存. 将肿瘤细胞和肝细胞的色谱图进行比较, 挑选肿瘤特异的峰段. 将含有肿瘤特异峰段的馏分, 注入带有电喷雾离子源的Micromass Q-TOF型串联质谱仪(Waters)中. 质谱仪的扫描范围500-15 000, 用于测定每个样品中肽段的分子质量和质荷比. 为了对天然肽进行MS测序, 每个肽段的撞击诱导解离(CID)的质谱结果都按单电荷的离子形式记录. 肽段的序列对比利用互联网上的序列查询软件(NCBI-Blast)进行.
1.2.1 MTT比色试验: 人肝癌HLE细胞株在37 ℃, 50 mL/L CO2条件下, 用含100 mL/L胎牛血清和青霉素、链霉素各100 kU/L的RPMI 1640液培养2-3 d, 取对数生长期细胞用于实验. 将肝癌细胞稀释成1×107/L, 以每孔200 μL接种于4块96孔板, 分为实验组、纳洛酮组, 每组设5个复孔. 培养24 h后更换培养液, 实验组加入不同浓度的合成LVV-血衍吗啡素-6; 纳洛酮组先加入10-7 mol/L纳洛酮与细胞培养1 h, 再加入不同浓度的合成LVV-血衍吗啡素-6; 对照组不加药. 分别于加药后24, 48 h, 加入MTT 20 μL, 继续培养4 h, 加入DMSO 150 μL震荡溶解10 min, 用酶联免疫检测仪测定每孔吸光度值(A值), 代表活细胞数量.
1.2.2 流式细胞仪检测: 将肝癌细胞接种于12孔板, 分为对照组和实验组, 每组设5个复孔. 实验组加入合成LVV-血衍吗啡素-6, 浓度分别为10-7 mol/L, 10-8 mol/L, 10-9 mol/L, 纳洛酮组和对照组同前. 培养48 h后, 收集细胞, 用PBS洗2遍, 700 mL/L预冷乙醇固定, 4 ℃过夜. 用PBS洗涤, 调整细胞浓度为109/L, 加入RNase和PI, 避光30 min, 用流式细胞仪进行细胞凋亡测定.
统计学处理 结果以均数±标准差(mean± SD)表示, 采用SPSS软件进行分析, 相关变量采用t检验. P<0.05为差异有显著性标准.
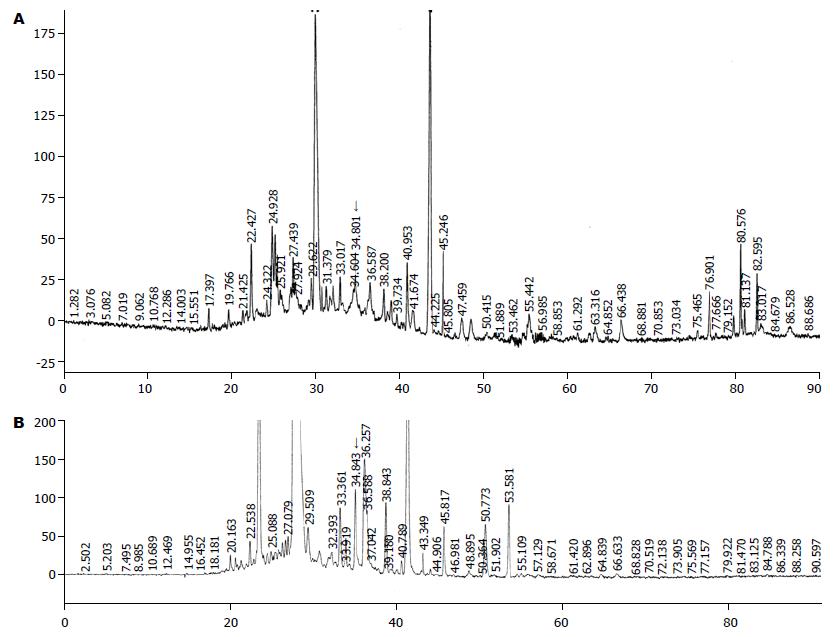
弱酸洗涤法从细胞表面分离所得肽混合物分别用带有C18柱的反相HPLC进行分馏, 用215, 254, 280 nm进行紫外监测. HCC的HPLC色谱图与相应的肝细胞色谱图进行比对, 一些肿瘤特异性峰段被发现. 这一现象提示, 在组织特异性肽池内发生了一些肿瘤诱导的改变. 我们发现, 在12例HCC患者的样品中, 有7例在34-35时段内出现一特异性峰段(图1).
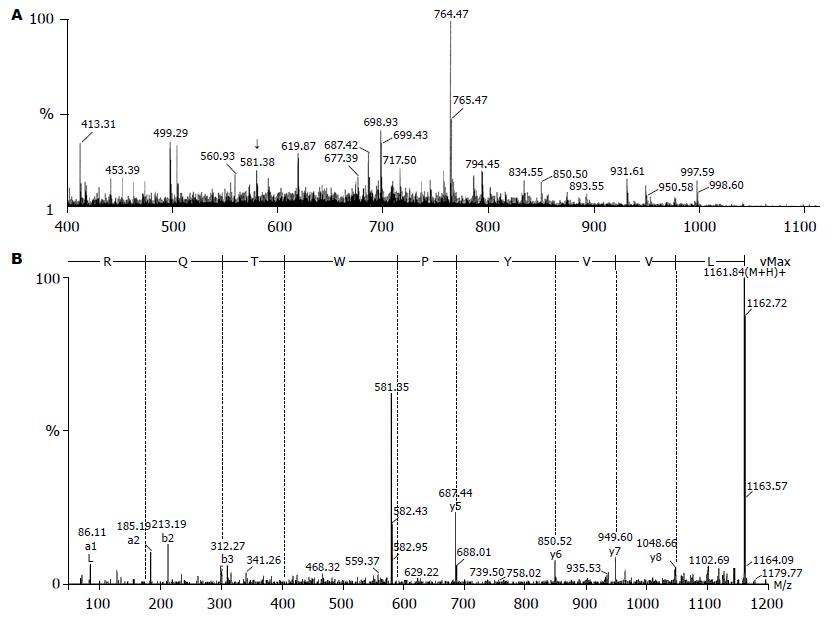
对上述肿瘤细胞特异峰段进行质谱分析, 有一条质量相同的肽段被检出, 而且仅出现于HCC样品中, 在肝细胞的相应峰段中没有发现. 这条肽经质谱测序为LVVYPWTQR(Mr 1160.76或[M+2H]2+的m/z为581.38). 经序列对比证实他源自β-血红蛋白, 并与LVV-血衍吗啡素-6完全吻合(图2).
分别用不同浓度的LVV-血衍吗啡素-6(10-12-10-7 mol/L)作用肝癌细胞HLE, 结果表明LVV-血衍吗啡素-6对肝癌细胞有抑制作用. 该作用与浓度密切相关, 当培养基中LVV-血衍吗啡素-6浓度大于10-8 mol/L时, 能产生明显的抑制效应[实验组24 h (2) vs (3), P = 0.044; (3) vs (4), P = 0.047; 48 h (2) vs (3), P = 0.031; (3) vs (4), P = 0.040]. 但阿片受体阻断剂naloxone能够逆转这种抑制效应(表1).
| 浓度(mol/L) | 24 h | 48 h | ||
| 实验组 | naloxone组 | 实验组 | naloxone组 | |
| (1)0 | 1.110±0.231 | 1.212±0.232 | 1.212±0.212 | 1.224±0.230 |
| (2)10-7 | 0.638±0225a | 0.911±0.205 | 0.598±0211a | 0.861±0.247 |
| (3)10-8 | 0.714±0.198a | 0.908±0.233 | 0.688±0.267a | 0.890±0.211 |
| (4)10-9 | 0.857±0.301 | 0.898±0.222 | 0.841±0.255 | 0.915±0.291 |
| (5)10-10 | 0.879±0.213 | 0.864±0.231 | 0.941±0.198 | 0.914±0.221 |
| (6)10-11 | 0.874±0.301 | 0.926±0.251 | 0.823±0.316 | 0.962±0.253 |
| (7)10-12 | 0.884±0.261 | 0.952±0.314 | 0.891±0.321 | 0.889±0.356 |
用流式细胞仪分析, 用不同浓度的LVV-血衍吗啡素-6作用肝癌细胞HLE后, 凋亡率随浓度的增加而逐渐上升, 表明随着LVV-血衍吗啡素-6浓度的增大, 凋亡细胞也明显增多[实验组(2) vs (3), P = 0.035; (3) vs (4), P = 0.044]. 但naloxone能够明显减少细胞的凋亡率(表2).
目前尚未见到有关HCC与血衍吗啡素的研究报道, 但大量研究表明, 在HCC组织中cathepsin D表达量普遍增高[10-11], 该酶主要生成血衍吗啡素-6, 血衍吗啡素-7等类似肽[12], 故可以推断LVV-血衍吗啡素-6及其类似肽在HCC组织中含量增加是具有普遍性的. 本结果也证实了上述推断. 血衍吗啡素在肿瘤组织中的作用目前尚不明确. 有学者认为, 血衍吗啡素可能通过抑制血管紧张素转换酶, 而增加肿瘤组织的血流量, 促进肿瘤生长[4]. 另有研究表明, 血衍吗啡素是具有阿片样活性的, 而许多肿瘤细胞都高密度表达阿片受体[2-3], 那么在HCC组织中, 血衍吗啡素是否会通过阿片受体介导而发挥其相应活性? 这就首先需要明确HCC细胞表面是否结合有血衍吗啡素(阿片受体均位于细胞膜的表面). 因此本实验没有象以往实验那样只是检测组织中血衍吗啡素的含量, 而是先将肝癌组织和癌旁肝组织进行处理, 分离纯化出HCC细胞和肝细胞, 利用弱酸洗涤法[13-14]提取细胞表面所有的结合肽, 然后利用HPLC和MS进行纯化和筛选. 结果我们在HCC细胞表面分离、鉴定出天然肽LVVYPWTQR(LVV-血衍吗啡素-6), 而在对照的肝细胞表面却没有发现, 从而证明HCC细胞表面确实结合有LVV-血衍吗啡素-6. 在随后的实验中我们发现, LVV-血衍吗啡-6能够在体外抑制人肝癌细胞株HLE的生长, 诱导其凋亡, 这两种作用均表现出一定的剂量依赖性, 而阿片受体阻断剂naloxone能够逆转这种抑制效应, 从而证实LVV-血衍吗啡-6对HCC细胞的抑制作用是通过阿片受体介导.
许多实验证明, 内外源性阿片类物质可以抑制肿瘤细胞的增生, 并其诱导凋亡[15-17]. 阿片类物质的抗肿瘤作用主要通过阿片受体(μ, δ, κ)途径介导, 并可与其他膜受体系统(如生长抑素受体、肾上腺素能受体)交叉作用[18-19]. 近来研究提示阿片类物质的抗肿瘤机制与抑制转录因子NF-κB和激活转录因子AP-1有关, NF-κB活性的降低与AP-1的活化可以诱导凋亡和抑制肿瘤坏死因子-α(TNF-α)基因的表达[20-21]. 阿片类物质的抗肿瘤作用在体内研究也得以证实[22], 尽管机制尚未完全明确, 但阿片肽系统在细胞癌变过程中所起的作用已日益受到人们的重视[23-25].
本实验不但首次从HCC细胞表面分离出血衍吗啡素类肽, 而且还证实其对HCC细胞具有一定的抑制作用, 提示血衍吗啡素, 这一类天然的内源性阿片肽可能在肿瘤治疗方面所具有潜在的应用价值, 对该领域进行深入的探索和研究将有助于我们更好地了解机体与肿瘤间的相互作用.
由于每种组织都包含一系列特定蛋白, 这些蛋白完成功能后被蛋白裂解酶降解, 从而产生一大族肽, 这类肽被定义为"组织特异性肽池". 组织特异性肽池中各种肽的含量和组成是组织状态的重要特征, 机体的病变常常可以导致组织特异性肽池的变化. 血红蛋白的降解产物, 如血衍吗啡素, 是肽池重要的组成部分, 目前相关的研究尚不多见, 且主要集中于神经系统和内分泌领域. LVV-血衍吗啡素-6, 是本文在对HCC细胞表面的抗原表位进行鉴定时, 无意中发现的, 虽然本实验通过体外试验, 对该肽与HCC细胞的作用机制进行了初步探讨, 但对其尚缺乏全面深入的了解, 特别该肽是在体内的作用机制方面.
对血衍吗啡素及组织特异性肽池进行深入的研究将有助于更好地了解机体与肿瘤间的相互作用, 并有可能为我们提供新的肿瘤诊断、治疗途径.
本研究证明HCC细胞存在LVV-血衍吗啡素-6, 并且发现LVV-血衍吗啡-6体外可抑制人肝癌细胞株HLE生长, 诱导其调亡, 并证明此抑制作用通过阿片受体介导, 研究具有创新性与科学性.
编辑: 潘伯荣 电编:张敏
| 1. | Tegeder I, Geisslinger G. Opioids as modulators of cell death and survival-unraveling mechanisms and revealing new indications. Pharmacol Rev. 2004;56:351-369. [PubMed] |
| 2. | Karelin AA, Blishchenko EYu, Ivanov VT. A novel system of peptidergic regulation. FEBS Lett. 1998;428:7-12. [PubMed] |
| 3. | Fruitier I, Garreau I, Lacroix A, Cupo A, Piot JM. Proteolytic degradation of hemoglobin by endogenous lysosomal proteases gives rise to bioactive peptides: hemorphins. FEBS Lett. 1999;447:81-86. [PubMed] |
| 4. | Duethman D, Dewan N, Conlon JM. Isolation of the opioid peptide Leu-Val-Val-hemorphin-7 from bronchoalveolar lavage fluid of a patient with non-small cell lung cancer. Peptides. 2000;21:137-142. [PubMed] |
| 5. | Dagouassat N, Garreau I, Sannier F, Zhao Q, Piot JM. Generation of VV-hemorphin-7 from globin by peritoneal macrophages. FEBS Lett. 1996;382:37-42. [PubMed] |
| 6. | Cohen M, Fruitier-Arnaudin I, Sauvan R, Birnbaum D, Piot JM. Serum levels of Hemorphin-7 peptides in patients with breast cancer. Clin Chim Acta. 2003;337:59-67. [PubMed] |
| 7. | Blishchenko EY, Sazonova OV, Kalinina OA, Yatskin ON, Philippova MM, Surovoy AY, Karelin AA, Ivanov VT. Family of hemorphins: co-relations between amino acid sequences and effects in cell cultures. Peptides. 2002;23:903-910. [PubMed] |
| 8. | Poljak A, McLean CA, Sachdev P, Brodaty H, Smythe GA. Quantification of hemorphins in Alzheimer's disease brains. J Neurosci Res. 2004;75:704-714. [PubMed] |
| 9. | Rochefort H, Garcia M, Glondu M, Laurent V, Liaudet E, Rey JM, Roger P. Cathepsin D in breast cancer: mechanisms and clinical applications, a 1999 overview. Clin Chim Acta. 2000;291:157-170. [PubMed] |
| 10. | Leto G, Tumminello FM, Pizzolanti G, Montalto G, Soresi M, Ruggeri I, Gebbia N. Cathepsin D serum mass concentrations in patients with hepatocellular carcinoma and/or liver cirrhosis. Eur J Clin Chem Clin Biochem. 1996;34:555-560. [PubMed] |
| 11. | Huang XF, Wang CM, Dai XW, Li ZJ, Pan BR, Yu LB, Qian B, Fang L. Expressions of chromogranin A and cathepsin D in human primary hepatocellular carcinoma. World J Gastroenterol. 2000;6:693-698. [PubMed] |
| 12. | Fruitier I, Garreau I, Piot JM. Cathepsin D is a good candidate for the specific release of a stable hemorphin from hemoglobin in vivo: VV-hemorphin-7. Biochem Biophys Res Commun. 1998;246:719-724. [PubMed] |
| 13. | Sugawara S, Abo T, Kumagai K. A simple method to eliminate the antigenicity of surface class I MHC molecules from the membrane of viable cells by acid treatment at pH 3. J Immunol Methods. 1987;100:83-90. [PubMed] |
| 14. | Storkus WJ, Zeh HJ 3rd, Salter RD, Lotze MT. Identification of T-cell epitopes: rapid isolation of class I-presented peptides from viable cells by mild acid elution. J Immunother. 1993;14:94-103. [PubMed] |
| 15. | Kampa M, Papakonstanti EA, Alexaki VI, Hatzoglou A, Stournaras C, Castanas E. The opioid agonist ethylketocyclazocine reverts the rapid, non-genomic effects of membrane testosterone receptors in the human prostate LNCaP cell line. Exp Cell Res. 2004;294:434-445. [PubMed] |
| 16. | McLaughlin PJ, Levin RJ, Zagon IS. Opioid growth factor (OGF) inhibits the progression of human squamous cell carcinoma of the head and neck transplanted into nude mice. Cancer Lett. 2003;199:209-217. [PubMed] |
| 17. | Lin X, Chen Q, Xue LY, Ma XJ, Wang R. Endomorphins, endogenous opioid peptides, induce apoptosis in human leukemia HL-60 cells. Can J Physiol Pharmacol. 2004;82:1018-1025. [PubMed] |
| 18. | Wu WR, Zheng JW, Li FY, Li Y, Zhang KR, Bai HQ. Involvement of mu-opioid receptors and alpha-adrenoceptors in the immunomodulatory effects of dihydroetorphine. Eur J Pharmacol. 1998;353:79-85. [PubMed] |
| 19. | Cadet P, Rasmussen M, Zhu W, Tonnesen E, Mantione KJ, Stefano GB. Endogenous morphinergic signaling and tumor growth. Front Biosci. 2004;9:3176-3186. [PubMed] |
| 20. | Diao CT, Li L, Lau SY, Wong TM, Wong NS. kappa-Opioid receptor potentiates apoptosis via a phospholipase C pathway in the CNE2 human epithelial tumor cell line. Biochim Biophys Acta. 2000;1499:49-62. [PubMed] |
| 21. | Sueoka E, Sueoka N, Kai Y, Okabe S, Suganuma M, Kanematsu K, Yamamoto T, Fujiki H. Anticancer activity of morphine and its synthetic derivative, KT-90, mediated through apoptosis and inhibition of NF-kappaB activation. Biochem Biophys Res Commun. 1998;252:566-570. [PubMed] |
| 22. | Zagon IS, Hytrek SD, Smith JP, McLaughlin PJ. Opioid growth factor (OGF) inhibits human pancreatic cancer transplanted into nude mice. Cancer Lett. 1997;112:167-175. [PubMed] |
| 23. | Fichna J, Janecka A. Opioid peptides in cancer. Cancer Metastasis Rev. 2004;23:351-366. [PubMed] |
| 24. | Spadaro A, Ajello A, Luigiano C, Morace C, Resta ML, Berlinghieri G, Campo S, Scisca C, Alibrandi A, D'Arrigo G. Low utility of plasma Nociceptin/orphanin FQ in the diagnosis of hepatocellular carcinoma. World J Gastroenterol. 2006;12:4716-4720. [PubMed] |
| 25. | Szalay F, Hantos MB, Horvath A, Lakatos PL, Folhoffer A, Dunkel K, Hegedus D, Tekes K. Increased nociceptin/orphanin FQ plasma levels in hepatocellular carcinoma. World J Gastroenterol. 2004;10:42-45. [PubMed] |