修回日期: 2006-09-29
接受日期: 2006-10-05
在线出版日期: 2006-10-28
肠息肉是一类从黏膜表面突出到肠腔内的隆起状病变的临床诊断. 在最近的研究中陆续证实, 其发生和发展的原因和机制, 是由于Bmpr1a, APC, SMAD4, PTEN, STK11等基因突变而使各种细胞信号分子通过影响BMP信号通路, PTEN信号通路及Wnt信号通路所组成的生长信号调控网络, 造成β-catenin在肠干细胞中的过度积聚, 使得肠干细胞功能紊乱, 导致其自我更新、克隆增殖、分化和凋亡失去平衡的结果.
引文著录: 姚蓝, 宋家武. 肠息肉发生的细胞和分子生物学研究进展. 世界华人消化杂志 2006; 14(30): 2958-2961
Revised: September 29, 2006
Accepted: October 5, 2006
Published online: October 28, 2006
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2006; 14(30): 2958-2961
- URL: https://www.wjgnet.com/1009-3079/full/v14/i30/2958.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i30.2958
肠息肉是一类从黏膜表面突出到肠腔内的隆起状病变的临床诊断. 他是一种较常见的新生物. 大约有30%的人在一生中会有肠息肉的形成, 且随着年龄的增长, 发生肠息肉的风险越大. 而大部分患肠息肉的患者因无任何症状都不会发现有肠息肉的存在, 常常是在死亡后尸体解剖时才会被发现. 在中国, 约1.4%-20.4%的肠息肉患者其肠息肉会转变为恶性[1], 且因早期症状不明显, 常不能及时发现而耽误病情. 特别是对于肠息肉病(肠息肉综合征)的患者, 不仅因肠息肉数目过多(常>100个), 并具有特殊的临床表现, 常对日常生活造成极大的困扰, 且息肉癌变的风险也大大增加, 威胁生命. 因而, 从细胞和分子生物学水平上研究肠息肉发生的根本机制及原因, 对于肠息肉病的早期诊断与寻找新的治疗方法和新的靶点具有非常重要的意义.
在临床上, 肠息肉常因各自特殊的临床表现和组织结构学上差异, 给予了不同的临床疾病名称和组织学分类. 如根据其组织结构的特点划分, 肠息肉主要分为腺瘤型肠息肉和错构瘤型肠息肉. 前者除了包括大部分散发的肠息肉外, 还包括家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)、加德纳综合征(Gardner's syndrome, GS)、特科特综合征(Turcot's syndrome), 以其息肉在组织学上为腺瘤样, 有较高的恶变倾向为特点. 第二类是错构瘤型肠息肉, 主要包括色素沉着息肉综合征(Peutz-Jegher syndrome, PJS)、幼年性息肉病综合征(juvenile polyposis syndrome, JPS)、Cowden综合征(CS)、BRR综合征(Bannayan-Riley-Ruvalcaba syndrome, BRRS)[2-3].
最近的细胞生物学研究表明, 肠息肉的形成, 是由于肠干细胞细胞生物学功能紊乱, 导致其自我更新和克隆增殖、分化和凋亡失去平衡的结果. 在生理条件下, 小肠表面上存在着一种简单的柱状细胞, 这种细胞是内陷的, 存在于肠隐窝中, 是肠隐窝中主要的增殖细胞. 他们以发芽的方式进行增殖, 分化形成绒毛状的肠功能细胞. 同时, 某些间充质细胞, 例如, 成纤维细胞沿着肠隐窝-绒毛轴梯度堆积细胞外基质物, 小肠上皮组织下隐窝周围的肌纤维母细胞辅助肠隐窝的形成等, 共同促进了小肠表面最重要的小肠上皮组织的主要结构-肠隐窝和绒毛的形成. 通常, 1个绒毛来源于6-10个肠隐窝[4], 而1个肠隐窝就是由1个肠干细胞增殖扩增所形成的. 这种相对未分化肠干细胞, 常位于近肠隐窝底部倒数第3或第4个细胞位置, 位于潘氏细胞之上[5-6]. 而对于结肠来说, 因其不存在绒毛及潘氏细胞, 其肠干细胞常位于隐窝的底部[6]. 肠干细胞在自我更新时, 呈不对称分裂, 即在产生1个自身细胞(保留同源染色体最初的模板链, 并停留在肠隐窝底部附近)的同时产生另1个增殖性祖细胞(proliferative progenitor). 而该祖细胞相对于干细胞, 只存在着相当有限的自我更新能力, 当他们经过3-4次细胞分裂后, 他们的子代将沿着肠隐窝-绒毛轴逐渐移行到绒毛顶端, 并不断的分化成熟成下面4种类型:肠吸收细胞, 分泌黏液的杯状细胞, 分泌激素的肠激素细胞, 抗微生物的潘氏细胞[4,7]. 其中分化成熟的潘氏细胞不在长轴上, 而逐渐移行到隐窝底部, 在此生存约3 wk[4]. 其他分化的细胞在24-48 h后将移行到绒毛顶端并逐渐凋亡脱落. 而对于缺乏绒毛的结肠来说, 增殖的子细胞位于结肠隐窝的下2/3, 而分化成熟的细胞位于结肠隐窝的上1/3和肠上皮组织[6], 在组织结构上相当于小肠的绒毛结构, 并有着同样的细胞增殖灭活的生理过程. 只有当肠干细胞的不断增殖分化和移行与肠道上皮组织细胞不断的灭活相互平衡时, 才能共同维持肠道正常的生理结构. 当肠干细胞因某种原因突变, 通过肠隐窝的过度分裂, 不断进行自我更新、克隆、增殖分化, 超过了正常肠上皮组织细胞灭活的速度, 打破了生理平衡, 导致肠上皮组织上不断的细胞扩增, 并超过临近的正常肠隐窝时, 就导致了肠息肉的形成[5,8]. 因此, 肠道干细胞的异常克隆增殖在肠息肉形成过程中起着关键作用.
β-catenin在肠干细胞中的过度积聚是导致肠干细胞过度克隆增殖和肠息肉形成的主要因素. 早在1990年代, 已有多个研究发现, 在APC基因敲除小鼠中存在β-catenin在肠息肉中的过度积聚, 证实了β-catenin在肠息肉发生机制中的重要性[9]. 而近年, He et al[5]又在Bmpr1a基因突变小鼠的实验中进一步证实了肠息肉组织中β-catenin不仅积累显著增多, 并且证实了其积聚主要存在于肠干细胞中, 阐明了肠干细胞中β-catenin过度积聚在肠息肉发病中的重要作用. 当肠干细胞胞质中β-catenin过度堆积后, 将促进其转移到细胞核中, 与细胞核中的TCF(T-cell factor)相结合, 并与染色质构型重塑蛋白(the choromatin-remodeling protein)p300和Brg-1共同激活c-myc, cyclinD1, matrilysin, gastrin, ITF-2等特异靶基因的转录[10-11], 通过β-catenin/TCF转录通路导致肠干细胞的过度增殖与分化[5], 从而打破增殖与凋亡的平衡, 导致肠息肉形成.
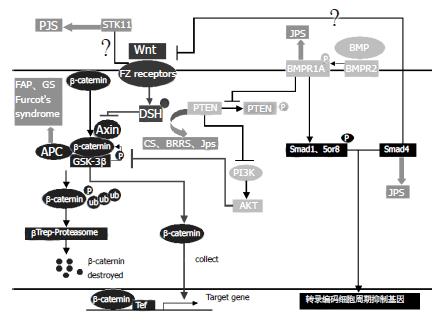
肠干细胞中β-catenin的调节, 与BMP信号通路, PTEN信号通路或Wnt信号通路息息相关, 而这3条通路又相互作用, 相互影响, 共同平衡细胞的更新和凋亡.
3.2.1 Wnt通路: 研究证实, Bmpr1a, APC, SMAD4, PTEN, STK11(丝氨酸/苏氨酸激酶11)等细胞信号分子都可通过各自相应的信号途径影响Wnt通路,调节肠干细胞中β-catenin的代谢, 导致肠息肉的发生. 因而, Wnt通路是众多细胞信号分子调节肠干细胞增生,导致肠息肉形成的共同通路. 当该途径中的Wnt配体与细胞膜上的FZ 受体相结合后, 使得DSH磷酸化[12], 而磷酸化DSH则与Axin结合, 阻止β-catenin与GSk3b、Axin、APC形成复合物[10-11], 导致β-catenin不能被GSk3b磷酸化以及被BTrCp泛素化[12], 抑制了β-catenin在细胞质中的水解而逐渐积聚, 最终β-catenin可转位进入细胞核, 激活β-catenin/TCf依赖的转录, 促进肠道干细胞的不断更新及增殖分化. 同时有研究发现, STK11也参与了Wnt-β-catenin途径的调节, 与肠息肉发生相关, 但具体机制尚不清楚[3].
3.2.2 PTEN通路: 在PTEN通路中, PTEN可抑制PI3K-AKT途径, 使得AKT不能抑制GSk3b . 从而影响Wnt通路, 间接促进β-catenin, GSk3b, Axin, APC复合物的形成, 加快了β-catenin磷酸化和泛素化, 以及在细胞质中的分解, 与Wnt通路共同平衡细胞的更新和凋亡[5,8,13].
3.2.3 BMP通路: BMP通路则通过BMP2或BMP4与BMPRⅡ结合后磷酸化Bmpr1a, 从而激活Bmpr1a. 激活后的Bmpr1a一方面可磷酸化SMAD1, SMAD5或SMAD8, 而磷酸化的SMAD8或SMAD1, 5又与SMAD4组成化合物, 从细胞质转移到细胞核, 与DNA结合蛋白结合, 共同调节转录编码细胞周期的抑制基因, 从而调节细胞凋亡[3,14]. 而这一机制在肠息肉的发生机制中尚未得到完全证实, 不同研究机构在此点上仍有分歧. 除此以外, BMP通路中的SMAD4似乎可阻止Wnt配体与FZ受体的结合, 通过Wnt信号通路调节β-catenin, 从而调节细胞的更新与凋亡, 但其具体机制亦尚不清楚[13], 有待进一步研究. 而另一方面, 激活后的Bmpr1a还可影响PTEN通路. 其激活后的Bmpr1a可通过促进PTEN抑制PI3K-AKT通路, 进而影响Wnt通路, 共同调节β-catenin的代谢, 平衡细胞的更新和凋亡[5,8,13]. 因此, 这3条通路共同构成了一个网络系统, 调节β-catenin在细胞中的降解和积累, 控制肠道干细胞的增殖分化和肠隐窝的分裂, 与肠息肉的发生密切相关(图1).
近年来研究发现, 大约有60%的BRRS患者, 80%-85%的CS患者不仅有PTEN基因的突变[3,12], 并且与PTEN基因的突变密切相关[14]. 而PTEN基因作为一种肿瘤抑制基因, 位于10q23[3]. 除了外显子1, 4, 9外, PTEN基因的其他各个部位都可发现有突变. 突变类型主要包括有意义的突变、无意义的突变、缺失、插入、剪切位点突变等类型. 并且众多研究还证实, 其外显子5是PTEN基因突变的热点[3-12], 而该区域则主要编码PTEN蛋白作为磷酸酶的核心部位, 该部位在PTEN通路中起着重要作用, 调节β-catenin在肠干细胞中的降解代谢[3]. 且尽管BRRS与CS都存在PTEN的变异, 但二者在临床表现等各方面仍有所不同, 因此可能在每一种综合征中存在着其某种独立基因的突变[3], 但现在机制尚不清楚. 而另外一种观点则认为BRRS和CS是同一种类型的不同表现, 统称二者为"PTEN错构瘤综合征"[3]. 且这个称呼从细胞分子发生机制上看似乎更为确切[14].
对于腺瘤中的FAP、Gardner综合征(GS)、Furcot's综合征则主要与wnt通路中的APC基因的变异有关[15]. APC亦是一种肿瘤抑制基因, 位于5q21[12]. 当其基因突变造成APC某功能结构异常后, 可影响β-catenin的代谢, 造成β-catenin在肠道干细胞中的过度积聚, 与肠息肉的发生密切相关. 其中对于FAP的患者来说, 常常可发现有其中一个等位基因的突变. 突变类型以点突变, 插入, 缺失为主, 而1-8个碱基对之间的插入和丢失所造成的基因移码是最常见的, 他们常导致异常的终止密码子和功能失活的截断蛋白的产生. 其中有20%的突变在外显子15的5'区(1000-1600密码子)之间, 33%的突变在1061, 1309, 1465密码子[16]. 且不同的密码子基因的突变, 对于肠息肉发生的部位、数量、癌变倾向等似乎都有相应关系, 例如, 编码APC蛋白羧基端终末部分的2644密码子的突变只会造成部分的结肠息肉[12], 3'端至1250密码子之间基因的突变则更易出现腺瘤癌变[17]. 对于GS的患者, 虽在临床表现上与FAP稍有差异, 但在分子基因发生机制上, 亦与FAP一样, 同APC基因的突变密切相关. 因此, 现有观点认为GS与FAP是同一种疾病发展的不同阶段. 而Furcot's综合征, 则不仅与APC基因的突变相关, 并且还可见hMLH1、hMLH2基因突变[15], 但现研究较少, 具体机制尚不完全清楚.
对JPS来说, 约有20%-30%的JPS患者与Bmpr1a基因的突变相关. 且He et al[5]在所研究设计的杂和Bmpr1a基因突变模型老鼠中, 发现了该小鼠所形成的肠息肉在组织学上与幼年性息肉综合征及其相似, 且细胞的扩增主要源于隐窝数量的增加. 而Bmpr1a基因则主要位于10q23[3,18]. 其基因的突变可通过影响PTEN-Wnt通路造成β-catenin在肠道干细胞中的积聚, 打破肠道上皮细胞增生与凋亡的平衡. 现研究已不仅证实了JPS与Bmpr1a基因的突变密切相关, 并且发现其突变主要有以下4种: (1)外显子1中44_47delTGTT, 导致35-36密码子的终止. (2) 外显子7G-C的交换导致Gln239Stop. (3)外显子7G-A的交换导致Trp271Stop. (4)外显子8中一个碱基的丢失-961delC[12,19-20]. 而对SMAD4来说, 在功能上也是一种抑癌基因. 约20%的JPS患者中有SMAD4的突变[20]. 且Takaku et al[21]曾在研究设计的杂合子SMAD4基因敲除模型老鼠中, 发现其在1.5-2年可出现类似JPS的表现, 进一步证实了JPS的发生与SMAD4基因的突变密切相关. 而SMAD4基因则位于18q21.1, 一共有15个外显子, 其突变主要位于8个外显子中. 其突变类型主要包括丢失、插入、替换, 不包括剪接位点突变. 常见的SMAD4的突变除了Howe et al[22]发现的1244delACAC, 还包括414-416密码子的4个碱基对的缺失, 348密码子2个碱基对的缺失和229密码子1个碱基对的插入[3]. 这些突变都可引起SMAD4蛋白的功能缺失, 通过wnt通路阻碍β-catenin的降解. 而除此以外, 也有研究曾发现部分JPS的患者中存在着PTEN基因的突变, 但后来证实这部分JPS患者最后大部分被确诊为CS或BRRS患者, 因此PTEN基因的突变与JPS是否有关, 尚在研究中[20,23].
STK11作为一种肿瘤抑制基因, 主要位于19q13.3. 437氨基酸蛋白的截断及基因的缺失、插入、异常终止密码子、剪切位点的突变都曾报道与PJS的发生有关[12]. 其中, Kruse et al[24]曾对部分PJS的患者的外周血进行STK11基因测序, 明确发现STK11基因突变有以下4种: (1)外显子4中(474-480del)所导致的移码突变; (2)外显子1中(125-137del) 所导致的移码突变; (3)外显子4中(516-517insT)所导致的移码突变; (4)外显子5中(Q220X)的无意义突变. 而在PJ患者中发现除了有STK11基因的突变, 同时也可存在其他基因的突变, 如p53的突变, β-catenin的突变等. 并在最近的一个研究中发现, 在所有的PJ患者的肠上皮细胞中都可见有β-catenin在细胞核中的堆积. 这提示, STK11涉及到多种途径, 包括Wnt/β-catenin/TCF-4途径, 是PJ综合征的"看门人"[3]. 但STK11参与各种途径的具体机制现还尚不清楚, 有待进一步研究.
总之, 近年来的研究证实, 肠息肉的研究不仅在细胞和分子生物学发生机制上取得了巨大的进展和成就, 阐明了许多以肠息肉发生为主要表型的疾病的病因, 而且其信号通道网络分子及基因突变在肠息肉发病间联系的证实, 为息肉发病机制的最终阐明, 必将做出重要的贡献. 并在不远的将来, 可为肠息肉病的早期诊断以及为寻找新的治疗靶点及方法, 提供重要的理论指导.
肠息肉是一类从黏膜表面突出到肠腔内的隆起状病变的总称, 是一类发病率高, 危害程度重, 部分具有肯定的恶变趋向的疾病. 由于其发生和发展的原因和机制一直少有突破, 诊疗上亦少有进展.
明确肠息肉的发病机制, 是当前研究的难点和热点. 近年来, 随着分子遗传学进步, 特别是细胞内分子信号传导以及干细胞技术的进步, 其相关研究有重大突破. 有望成为阐明其发病机制的新的突破口.
本文较系统、全面的从细胞学、分子生物学及基因水平上, 对该疾病的发病机制进行了阐述. 特别是在肠干细胞及其细胞内信号分子方面, 如BMP信号通路, PTEN信号通路及Wnt信号通路所组成的生长信号调控网络,造成β-catenin在肠干细胞中的过度积聚, 导致肠干细胞增殖、分化和凋亡失去平衡的结果, 系统阐述了肠息肉发生的机制让读者对肠息肉的发生和发展机制最新进展有较全面的认识.
肠息肉的细胞和分子生物学发生机制, 可为肠息肉病的早期诊断以及为寻找新的治疗靶点及方法, 提供重要的理论指导.
本文对肠息肉发生和发展的原因和机制进行了较全面而详细的综述, 基本反映本专题的研究进展. 结构合理, 逻辑性强, 具有较高的科学性和应用性.
电编: 李琪 编辑:张焕兰
| 1. | Zhang YL, Zhang ZS, Wu BP, Zhou DY. Early diagnosis for colorectal cancer in China. World J Gastroenterol. 2002;8:21-25. [PubMed] [DOI] |
| 2. | Luk GD. Diagnosis and therapy of hereditary polyposis syndromes. Gastroenterologist. 1995;3:153-167. [PubMed] |
| 3. | John M. Carethers MD. Hamartomatous polyposis syndromes: genetic pathways. Current Opinion in Gastroenterology. 2002;18:60-67. [PubMed] [DOI] |
| 4. | Hauck AL, Swanson KS, Kenis PJ, Leckband DE, Gaskins HR, Schook LB. Twists and turns in the development and maintenance of the mammalian small intestine epithelium. Birth Defects Res C Embryo Today. 2005;75:58-71. [PubMed] [DOI] |
| 5. | He XC, Zhang J, Tong WG, Tawfik O, Ross J, Scoville DH, Tian Q, Zeng X, He X, Wiedemann LM. BMP signaling inhibits intestinal stem cell self-renewal through suppression of Wnt-beta-catenin signaling. Nat Genet. 2004;36:1117-1121. [PubMed] [DOI] |
| 6. | Radtke F, Clevers H. Self-renewal and cancer of the gut: two sides of a coin. Science. 2005;307:1904-1909. [PubMed] [DOI] |
| 7. | He XC, Zhang J, Li L. Cellular and molecular regulation of hematopoietic and intestinal stem cell behavior. Ann NY Acad Sci. 2005;1049:28-38. [PubMed] [DOI] |
| 8. | van den Brink GR. Linking pathways in colorectal cancer. Nat Genet. 2004;36:1038-1039. [PubMed] [DOI] |
| 9. | Bienz M, Clevers H. Linking colorectal cancer to Wnt signaling. Cell. 2000;103:311-320. [PubMed] [DOI] |
| 10. | Wang D, Mann JR, DuBois RN. WNT and cyclooxygenase-2 cross-talk accelerates adenoma growth. Cell Cycle. 2004;3:1512-1515. [PubMed] [DOI] |
| 11. | Kolligs FT, Bommer G, Goke B. Wnt/beta-catenin/tcf signaling: a critical pathway in gastrointestinal tumorigenesis. Digestion. 2002;66:131-144. [PubMed] [DOI] |
| 12. | Cohen MM Jr. Molecular dimensions of gastrointestinal tumors: some thoughts for digestion. Am J Med Genet A. 2003;122:303-314. [PubMed] [DOI] |
| 13. | Tian Q, He XC, Hood L, Li L. Bridging the BMP and Wnt pathways by PI3 kinase/Akt and 14-3-3zeta. Cell Cycle. 2005;4:215-216. [PubMed] [DOI] |
| 15. | Strate LL, Syngal S. Hereditary colorectal cancer syndromes. Cancer Causes Control. 2005;16:201-213. [PubMed] [DOI] |
| 16. | Lal G, Gallinger S. Familial adenomatous polyposis. Semin Surg Oncol. 2000;18:314-323. [PubMed] [DOI] |
| 17. | Friedl W, Caspari R, Sengteller M, Uhlhaas S, Lamberti C, Jungck M, Kadmon M, Wolf M, Fahnenstich J, Gebert J. Can APC mutation analysis contribute to therapeutic decisions in familial adenomatous polyposis? Experience from 680 FAP families. Gut. 2001;48:515-521. [PubMed] [DOI] |
| 18. | Astrom AK, Jin D, Imamura T, Roijer E, Rosenzweig B, Miyazono K, ten Dijke P, Stenman G. Chromosomal localization of three human genes encoding bone morphogenetic protein receptors. Mamm Genome. 1999;10:299-302 10051328. [PubMed] [DOI] |
| 19. | Howe JR, Bair JL, Sayed MG, Anderson ME, Mitros FA, Petersen GM, Velculescu VE, Traverso G, Vogelstein B. Germline mutations of the gene encoding bone morphogenetic protein receptor 1A in juvenile polyposis. Nat Genet. 2001;28:184-187. [PubMed] [DOI] |
| 20. | Merg A, Howe JR. Genetic conditions associated with intestinal juvenile polyps. Am J Med Genet C Semin Med Genet. 2004;129:44-55. [PubMed] [DOI] |
| 21. | Takaku K, Oshima M, Miyoshi H, Matsui M, Seldin MF, Taketo MM. Intestinal tumorigenesis in compound mutant mice of both Dpc4 (Smad4) and Apc genes. Cell. 1998;92:645-656. [PubMed] [DOI] |
| 22. | Howe JR, Shellnut J, Wagner B, Ringold JC, Sayed MG, Ahmed AF, Lynch PM, Amos CI, Sistonen P, Aaltonen LA. Common deletion of SMAD4 in juvenile polyposis is a mutational hotspot. Am J Hum Genet. 2002;70:1357-1362. [PubMed] [DOI] |
| 23. | Chow E, Macrae F. A review of juvenile polyposis syndrome. J Gastroenterol Hepatol. 2005;20:1634-1640. [PubMed] [DOI] |