修回日期: 2006-08-26
接受日期: 2006-09-16
在线出版日期: 2006-10-28
目的: 检测四株结肠癌细胞株中癌胚抗原(carcinoembryonic antigen, CEA)的表达, 并探讨其意义.
方法: 四株人结肠腺癌细胞(LS174T, LoVo, SW480及HCT-8)分别应用ELISA法测定细胞培养上清中CEA含量; 免疫组化检测细胞CEA蛋白表达; 半定量RT-PCR检测细胞CEA mRNA表达丰度.
结果: LS174T和SW480细胞在蛋白和mRNA水平均可检测到CEA的表达且前者表达量高于后者(细胞培养上清中CEA含量: 1050±25.0 ng/107 cells vs 66±5.6 ng/107 cells, P<0.0001; 半定量检测CEA mRNA表达丰度: 1.137±0.155 vs 0.399±0.135, P = 0.003); 而LoVo细胞在蛋白和和mRNA水平均未检测到CEA的表达; HCT-8细胞免疫组化有弱阳性染色.
结论: 四株结肠癌细胞株的实际CEA表达情况与既往文献报道不尽相同. 这种细胞株CEA表达特性的改变有可能影响其体外生物学行为从而导致实验结果的不确定性.
引文著录: 王立峰, 刘宝瑞, 钱晓萍, 殷海涛, 禹立霞, 魏嘉. 四株人结肠腺癌细胞CEA表达水平的检测及其意义. 世界华人消化杂志 2006; 14(30): 2933-2937
Revised: August 26, 2006
Accepted: September 16, 2006
Published online: October 28, 2006
AIM: To investigate the expression of carcinoembryonic antigen (CEA) and its significance in the four different colon adenocarcinoma cell lines.
METHODS: Enzyme-linked immunosorbent assay (ELISA) was used to measure the expression of CEA in the cell culture medium and the immunohistochemistry was used to detect the protein expression of CEA in LS174T, SW480, LoVo and HCT-8 cell lines, separately. Semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR) for the expression of CEA mRNA in the four kinds of cell lines was also carried out.
RESULTS: A great variation in CEA content was found among the four kinds of colon cancer cell lines. The expression of CEA was detectable at the protein and mRNA level in LS174T and SW480 cell lines, and moreover, it was higher in the former (culture supernatant fluid: 1050 ± 25.0 ng/107 cells vs 66 ± 5.6 ng/107 cells, P < 0.0001; mRNA: 1.137 ± 0.155 vs 0.399 ± 0.135, P = 0.003). Meanwhile, CEA was negatively expressed in LoVo cells no matter at the protein or mRNA level, and HCT-8 cells were only found with weakly-positive immunohistochemical staining.
CONCLUSION: There is a great variation in CEA expression among the four kinds of human colon cancer cell lines as compared with the reported results previously. The expression change of CEA in the different cell lines may affect its in vitrobiological behavior and further lead to the uncertainty of the experiment.
- Citation: Wang LF, Liu BR, Qian XP, Yin HT, Yu LX, Wei J. Expression of carcinoembryonic antigen in four different human colon adenocarcinoma cell lines. Shijie Huaren Xiaohua Zazhi 2006; 14(30): 2933-2937
- URL: https://www.wjgnet.com/1009-3079/full/v14/i30/2933.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i30.2933
癌胚抗原(carcinoembryonic antigen, CEA)是一相对分子质量约为200 kDa的糖蛋白. 作为一广谱肿瘤相关抗原, CEA在临床中有着广泛的应用, 尤其在监测肠癌的复发、转移方面更有着独特的价值[1-6]. 血浆CEA升高可见于多种恶性肿瘤如肺癌、肠癌、胰腺癌、乳癌以及妇科肿瘤等[7]. 随着对该蛋白特性的不断深入了解, CEA目前的应用主要集中于肿瘤的监测与预后复发、免疫治疗、靶向影像及治疗领域[8-12].
由于原代培养肿瘤细胞尤其是上皮来源性肿瘤细胞耗时长、繁琐且容易因污染导致培养失败, 在体外进行的大多数研究都是采用已建系的肿瘤细胞株. 目前已建系的肠癌细胞株已有近百种, 因在抗原表达、遗传特性及生物学行为等方面的不同而在不同的研究中被广泛使用. 然而这些细胞系大多来源于不同的实验室, 对其生物学特性的检测手段不尽相同; 加上长时间体外培养时肿瘤细胞时常表现出遗传学的不稳定性, 从而可能影响实验结果. 由于CEA所具有的重要生物学功能: 促进细胞黏附、抑制细胞死亡、介导信号转导及激发肿瘤免疫[13-17]以及其在肠癌中的应用价值, 我们推测目前被广泛采用的肠癌细胞系有可能部分细胞株的CEA表达水平与既往文献不尽相同; 这种CEA表达的改变有可能影响肿瘤细胞在体内/体外的生物学行为, 如果研究者在一些相关生物学功能研究中未加验证的选用某种CEA表达已发生变化的细胞系则有可能产生不确信的结果. 在本实验中我们选取了LS174T、LoVo、SW480及HCT-8四株肠癌细胞, 分别从蛋白水平、分子生物学水平检测CEA的表达, 发现与既往的文献报道不尽相同, 提示在选择细胞系前对其重要的生物学指标加以验证是完全必要的.
TRIzol试剂及细胞培养液为Invitrogen公司产品, 逆转录PCR 试剂盒及Taq 酶购于日本TaKaRa公司; ELISA检测CEA试剂盒购于美国Lifekey公司; 免疫组化用CEA mAb、 EnVision试剂盒均购自DAKO公司.
LoVo细胞株购于中科院上海细胞库; LS175T, HCT-8和SW480购于南京凯基生物有限公司. 所用细胞于含100 mL/L小牛血清的RPMI1640培养液中37 ℃、50 mL/L CO2条件下常规培养.
1.2.1 夹心ELISA法检测培养上清CEA的表达: 四株细胞以相同密度接种至T75培养瓶中, 3-5 d后收集上清. 按CEA ELISA 试剂盒说明检测培养上清液中的CEA, 每样品均设3个复孔, 以试剂盒中的CEA做标准曲线, 定量.
1.2.2 免疫组化检测细胞的CEA表达: 四株细胞分别以胰酶消化后PBS洗涤3遍, 调整密度后甩片, 40 g/L多聚甲醛固定30 min后免疫组化检测. 免疫组化标记采用EnVision二步法, 具体操作按试剂盒说明书进行. CEA一抗为鼠抗人mAb.
1.2.3 半定量RT-PCR TRIzol: 一步法分别抽提LS175T, HCT-8, SW480和LoVo细胞的总RNA, 反转录为cDNA, 体系如下: 5×M-MLV Buffer 4 mL, dNTP 1 mL, Oligo dT 1 mL, M-MLV逆转录酶0.5 mL, RNase抑制剂0.5 mL, 总RNA 2-3 mg, 加水至20 mL. 42 ℃ 15 min, 95 ℃ 2 min. 产物保存于-20 ℃.
CEA及内参β-actin基因片段的引物由上海博亚生物技术有限公司合成. CEA mRNA的特异性引物序列按文献所述[18-20]: 上游序列5'-TGTAGCTGTTGCAAATGCTTTAAG GAAGAAGC-3'; 下游序列5'-GGGCCACTGTCGGCATCATGATTGG-3'. β-actin引物序列, 上游序列5'-CTACAATGAGCTGCGTGTGGC-3'; 下游序列5'-CAGGTCCAGACG CAGGATGGC-3'. 反应体系如下: 5 mL cDNA , 5 mL 10×PCR缓冲液, 0. 2 mL Ex Taq 酶, 4 mL dNTPs, 25 mmol/ L的MgCl2 4 mL, 引物各1 mL , 加水至50 mL. CEA cDNA PCR反应条件: 95 ℃预变性5 min, 95 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸1 min, 30个循环, 最后72 ℃终延伸9 min. β-actin cDNA PCR反应条件: 95 ℃预变性5 min, 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸45 s, 30 个循环, 最后72 ℃终延伸5 min. 扩增产物经15 g/L琼脂糖凝胶电泳Image-Pro plus图像分析软件进行光密度积分值分析, 计算出CEA与β-actin光密度积分值之比, 重复3次.
统计学处理 所有数据采用SPSS 10.0统计软件分析, 以均数±标准差(mean±SD)表示, 各组之间比较采用t检验.
ELISA结果表明LS174T高表达CEA(1050±25.0 ng/107 cells); SW480细胞也有CEA的表达(66±5.6 ng/107 cells)但其表达量远低于前者(P<0.0001); 而LoVo和HCT-8细胞培养上清中的CEA含量在检测下限(<1 ng)
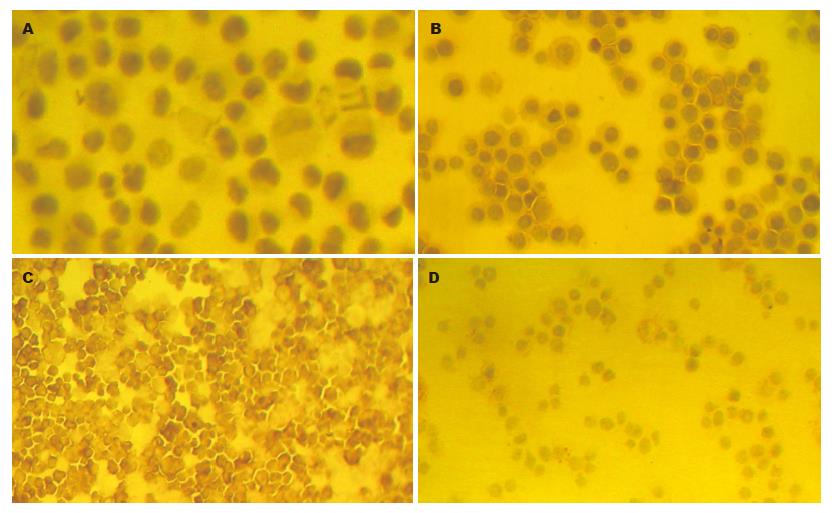
CEA的阳性表达主要定位于肿瘤细胞的细胞膜和细胞质, 呈棕黄色颗粒状. 免疫组化结果表明, LS174T和SW480细胞均为阳性染色其中以LS174T细胞染色最强; HCT-8仅有个别细胞弱染色, 而LOVO细胞则未见阳性染色(图1).
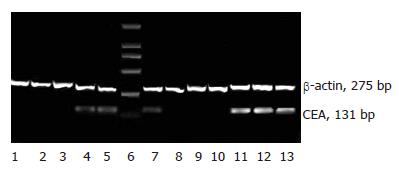
四株人结肠癌细胞中, LS174T和SW480细胞RT-PCR可以检测到CEA mRNA的表达且半定量分析表明两者之间的表达有显著性差异: (1.137±1.55 vs 0.399±0.135, P = 0.003); 而在LoVo和HCT-8细胞中则未能检测到相应表达(图2).
作为研究最为透彻的肿瘤相关抗原之一, CEA家族成员结构已逐渐为人们所知. 已有30多个相关基因/假基因被认为与CEA家族有关. 这些基因均定位于人染色体19q13.2[21]. 有研究者将这一大家族分为两类: 一类为CEA相关的细胞黏附分子(CEA-related cell adhesion molecules, CEACAM), 这些具有黏附因子作用的分子在肿瘤细胞的信号转导中发挥重要作用, 包括CEA(CEACAM5, CD66e)在内的CEA家族成员在肿瘤细胞膜表面的表达被认为具有利于肿瘤细胞播散的作用; 另一类为pregnancy-specific glycoproteins (PSG). 不同家族成员间由于具有部分相同的抗原决定簇常有交叉反应的发生[22].临床上CEA主要用于结直肠癌的诊断、判断肿瘤分期和病变程度、监测治疗和预报复发等[23-26]. 然而研究者们往往只单纯关注于CEA作为肿瘤相关抗原的身份而忽略了其本身所具有的生物学功能[27]. 血浆CEA水平的升高与肿瘤的分化程度、侵袭及转移密切相关, 有研究者认为, CEA在肿瘤的进展中扮演发挥着关键作用[28]. 因此, 肿瘤细胞株CEA蛋白的表达与否与其在体外、体内的生物学行为有直接的关系.
由于缺少高效、方便的方法原代培养肿瘤细胞, 已建系的细胞株仍然在现今的肿瘤研究中广受青睐. 已有多篇文献报道肿瘤细胞系存在一定缺陷如显著的遗传表型漂移的可能性; 因此, 早在1988年Trainer et al[29]就提出对于已建系的肿瘤细胞株周期性地对其生物学性状重新评估是极其必要的. 我们检测了四株肠癌细胞的CEA表达, 结果显示, 不论在蛋白质水平还是在mRNA水平, LS174T细胞均高表达CEA; 而在LoVo细胞中则完全检测不到CEA的表达, 这与文献中LoVo细胞高表达CEA 的报道完全相反[29-32]. SW480细胞的CEA表达情况既往有不同的报道: Dai et al和Liebig et al认为SW480细胞高表达CEA[33-34], 而另一研究组则有相反的结论[29], 这种相反的结论可能与不同实验室采用不同来源的细胞有关. 我们的结果表明, SW480细胞表达CEA但其表达丰度远低于LS174T细胞. HCT-8是文献报道不表达CEA的细胞株, 我们在细胞上清及mRNA水平均未检测到CEA的表达, 而在免疫组化中个别细胞有弱染色, 分析这是由于免疫组化实验中所使用的CEA抗体与NCA、BGP等CEA家族成员有交叉反应有关.
通过对四株肠癌细胞株的研究我们发现实际CEA表达情况与既往文献报道不尽相同. 由于CEA所具有的多种生物功能, 我们推测这种细胞株CEA表达特性的改变有可能影响其体外生物学行为从而导致实验结果的不确定性. 提示在当今广泛使用肿瘤细胞系为研究载体的同时, 更加不能忽视对选用的细胞系某些重要生物学功能重新加以确认以保证结果的准确性; 同时, 由于CEA家族拥有众多成员, 广义的CEA抗体常与多个成员间有交叉反应的发生, 在肿瘤研究中应加以注意选择相应的抗体.
目前, 已建系的肠癌细胞株已有近百种, 因在抗原表达、遗传特性及生物学行为等方面的不同而在不同的研究中被广泛使用. 然而这些细胞系在长期传代培养中由于多种因素可能导致细胞时常表现出遗传学的不稳定性从而可能影响实验结果.
由于CEA所具有的重要生物学功能以及其在肠癌中的应用价值, 我们推测, 目前被广泛采用的肠癌细胞系有可能部分细胞株的CEA表达水平与既往文献不尽相同; 这种CEA表达的改变有可能影响肿瘤细胞在体内/体外的生物学行为从而产生不确信的结果.
本文分析了四株人结肠腺癌细胞CEA表达情况并与既往文献报道进行比较, 发现其表达在部分细胞系发生变化.
本研究提示, 在当今广泛使用肿瘤细胞系为研究载体的同时, 更加不能忽视对选用的细胞系某些重要生物学功能重新加以确认以保证结果的准确性; 同时, 由于广义的CEA抗体常与多个成员间有交叉反应的发生, 在肿瘤研究中应加以注意选择相应的抗体.
本文研究四株人结肠癌细胞CEA水平的表达情况, 有一定的参考价值, 对于肿瘤研究细胞的选择以及评价有一定的指导意义. 论文撰写规范, 结果可信.
电编: 李琪 编辑:张焕兰
| 1. | Sarobe P, Huarte E, Lasarte JJ, Borras-Cuesta F. Carcinoembryonic antigen as a target to induce anti-tumor immune responses. Curr Cancer Drug Targets. 2004;4:443-454. [PubMed] [DOI] |
| 2. | Aquino A, Formica V, Prete SP, Correale PP, Massara MC, Turriziani M, De Vecchis L, Bonmassar E. Drug-induced increase of carcinoembryonic antigen expression in cancer cells. Pharmacol Res. 2004;49:383-396. [PubMed] [DOI] |
| 4. | Goldstein MJ, Mitchell EP. Carcinoembryonic antigen in the staging and follow-up of patients with colorectal cancer. Cancer Invest. 2005;23:338-351. [PubMed] [DOI] |
| 7. | Naghibalhossaini F, Pakdel A, Ghaderi AA, Saberi Firoozi M. Effective production of carcinoembryonic antigen by conversion of the membrane-bound into a recombinant secretory protein by site-specific mutagenesis. Pathol Oncol Res. 2005;11:211-217. [PubMed] [DOI] |
| 8. | Michaeli D. Vaccines and monoclonal antibodies. Semin Oncol. 2005;32:S82-S86. [PubMed] [DOI] |
| 9. | Sorbye H, Dahl O. Transient CEA increase at start of oxaliplatin combination therapy for metastatic colorectal cancer. Acta Oncol. 2004;43:495-498. [PubMed] [DOI] |
| 10. | Chen CC, Yang SH, Lin JK, Lin TC, Chen WS, Jiang JK, Wang HS, Chang SC. Is it reasonable to add preoperative serum level of CEA and CA19-9 to staging for colorectal cancer? J Surg Res. 2005;124:169-174. [PubMed] [DOI] |
| 11. | Goldenberg DM, Sharkey RM, Paganelli G, Barbet J, Chatal JF. Antibody pretargeting advances cancer radioimmunodetection and radioimmunotherapy. J Clin Oncol. 2006;24:823-834. [PubMed] [DOI] |
| 12. | Zbar AP. The immunology of colorectal cancer. Surg Oncol. 2004;13:45-53. [PubMed] [DOI] |
| 13. | Hammarstrom S. The carcinoembryonic antigen (CEA) family: structures, suggested functions and expression in normal and malignant tissues. Semin Cancer Biol. 1999;9:67-81. [PubMed] [DOI] |
| 14. | Screaton RA, Penn LZ, Stanners CP. Carcinoembryonic antigen, a human tumor marker, cooperates with Myc and Bcl-2 in cellular transformation. J Cell Biol. 1997;137:939-952. [PubMed] [DOI] |
| 15. | Screaton RA, DeMarte L, Draber P, Stanners CP. The specificity for the differentiation blocking activity of carcinoembryonic antigen resides in its glycophosphatidyl-inositol anchor. J Cell Biol. 2000;150:613-626. [PubMed] [DOI] |
| 16. | Taheri M, Saragovi U, Fuks A, Makkerh J, Mort J, Stanners CP. Self recognition in the Ig superfamily. Identification of precise subdomains in carcinoembryonic antigen required for intercellular adhesion. J Biol Chem. 2000;275:26935-26943. [PubMed] |
| 17. | Ordonez C, Screaton RA, Ilantzis C, Stanners CP. Human carcinoembryonic antigen functions as a general inhibitor of anoikis. Cancer Res. 2000;60:3419-3424. [PubMed] |
| 18. | Guo J, Xiao B, Zhang X, Jin Z, Chen J, Qin L, Mao X, Shen G, Chen H, Liu Z. Combined use of positive and negative immunomagnetic isolation followed by real-time RT-PCR for detection of the circulating tumor cells in patients with colorectal cancers. J Mol Med. 2004;82:768-774. [PubMed] [DOI] |
| 19. | Park S, Lee B, Kim I, Choi I, Hong K, Ryu Y, Rhim J, Shin J, Park SC, Chung H. Immunobead RT-PCR versus regular RT-PCR amplification of CEA mRNA in peripheral blood. J Cancer Res Clin Oncol. 2001;127:489-494. [PubMed] [DOI] |
| 20. | Ohtsukasa S, Okabe S, Yamashita H, Iwai T, Sugihara K. Increased expression of CEA and MHC class I in colorectal cancer cell lines exposed to chemotherapy drugs. J Cancer Res Clin Oncol. 2003;129:719-726. [PubMed] [DOI] |
| 21. | Olsen A, Teglund S, Nelson D, Gordon L, Copeland A, Georgescu A, Carrano A, Hammarstrom S. Gene organization of the pregnancy-specific glycoprotein region on human chromosome 19: assembly and analysis of a 700-kb cosmid contig spanning the region. Genomics. 1994;23:659-668. [PubMed] [DOI] |
| 22. | Hance KW, Zeytin HE, Greiner JW. Mouse models expressing human carcinoembryonic antigen (CEA) as a transgene: evaluation of CEA-based cancer vaccines. Mutat Res. 2005;576:132-154. [PubMed] [DOI] |
| 23. | Schiemann U, Gunther S, Gross M, Henke G, Muller-Koch Y, Konig A, Muders M, Folwaczny C, Mussack T, Holinski-Feder E. Preoperative serum levels of the carcinoembryonic antigen in hereditary non-polyposis colorectal cancer compared to levels in sporadic colorectal cancer. Cancer Detect Prev. 2005;29:356-360. [PubMed] [DOI] |
| 24. | Carpelan-Holmstrom M, Louhimo J, Stenman UH, Alfthan H, Jarvinen H, Haglund C. CEA, CA 242, CA 19-9, CA 72-4 and hCGbeta in the diagnosis of recurrent colorectal cancer. Tumour Biol. 2004;25:228-234. [PubMed] [DOI] |
| 25. | Ishida H, Miwa H, Tatsuta M, Masutani S, Imamura H, Shimizu J, Ezumi K, Kato H, Kawasaki T, Furukawa H. Ki-67 and CEA expression as prognostic markers in Dukes' C colorectal cancer. Cancer Lett. 2004;207:109-115. [PubMed] [DOI] |
| 26. | Wu WX, Sun YM, Hua YB, Shen LZ. Laparoscopic versus conventional open resection of rectal carcinoma: A clinical comparative study. World J Gastroenterol. 2004;10:1167-1170. [PubMed] |
| 27. | Berinstein NL. Carcinoembryonic antigen as a target for therapeutic anticancer vaccines: a review. J Clin Oncol. 2002;20:2197-2207. [PubMed] [DOI] |
| 28. | Ilantzis C, DeMarte L, Screaton RA, Stanners CP. Deregulated expression of the human tumor marker CEA and CEA family member CEACAM6 disrupts tissue architecture and blocks colonocyte differentiation. Neoplasia. 2002;4:151-163. [PubMed] [DOI] |
| 29. | Trainer DL, Kline T, McCabe FL, Faucette LF, Feild J, Chaikin M, Anzano M, Rieman D, Hoffstein S, Li DJ. Biological characterization and oncogene expression in human colorectal carcinoma cell lines. Int J Cancer. 1988;41:287-296. [PubMed] [DOI] |
| 30. | Zhang M, Li S, Nyati MK, DeRemer S, Parsels J, Rehemtulla A, Ensminger WD, Lawrence TS. Regional delivery and selective expression of a high-activity yeast cytosine deaminase in an intrahepatic colon cancer model. Cancer Res. 2003;63:658-663. [PubMed] |
| 31. | Graham-Cole CL, Thomas HD, Taylor GA, Newell DR, Melton RG, Hesp R, Boddy AV. An evaluation of thymidine phosphorylase as a means of preventing thymidine rescue from the thymidylate synthase inhibitor raltitrexed. Cancer Chemother Pharmacol. 2006;. [PubMed] [DOI] |
| 32. | Li Y, Chen Y, Dilley J, Arroyo T, Ko D, Working P, Yu DC. Carcinoembryonic antigen-producing cell-specific oncolytic adenovirus, OV798, for colorectal cancer therapy. Mol Cancer Ther. 2003;2:1003-1009. [PubMed] |
| 33. | Dai S, Wan T, Wang B, Zhou X, Xiu F, Chen T, Wu Y, Cao X. More efficient induction of HLA-A*0201-restricted and carcinoembryonic antigen (CEA)-specific CTL response by immunization with exosomes prepared from heat-stressed CEA-positive tumor cells. Clin Cancer Res. 2005;11:7554-7563. [PubMed] [DOI] |
| 34. | Liebig B, Brabletz T, Staege MS, Wulfanger J, Riemann D, Burdach S, Ballhausen WG. Forced expression of deltaN-TCF-1B in colon cancer derived cell lines is accompanied by the induction of CEACAM5/6 and mesothelin. Cancer Lett. 2005;223:159-167. [PubMed] [DOI] |