修回日期: 2006-08-12
接受日期: 2006-08-22
在线出版日期: 2006-10-28
目的: 观察选择性COX-2抑制剂NS-398对结肠癌细胞系SW480中PPARs信号转导通路的影响, 以期初步阐明选择性COX-2抑制剂抗结直肠癌非COX-2依赖性途径的作用机制.
方法: 应用RT-PCR检测结肠癌细胞系SW480中COX-2 mRNA表达水平, 用选择性COX-2抑制剂NS-398处理结肠癌细胞系SW480, Western blot检测PPARs信号转导通路成员表达, 四甲基偶氮唑盐(MTT)法检测细胞增殖状态, 流式细胞技术检测细胞周期与凋亡情况.
结果: 结肠癌细胞系SW480中未检测到COX-2 mRNA表达, NS-398(75 mmol/L)作用于SW480细胞72 h后, G1期细胞比率由31.2%上升至40.6%, S期细胞比率由52.8%下降至41.2%, 细胞增殖受抑制. PPARa, PPARd, PPARg, cyclin D1与Bcl-xl表达水平随NS-398作用时间延长而下降.
结论: 选择性COX-2抑制剂NS-398可能通过非COX-2依赖途径影响结肠癌细胞的增殖.
引文著录: 余力伟, 马向涛. COX-2抑制剂NS398调控PPARs信号转导通路抑制结肠癌细胞增殖的分子机制. 世界华人消化杂志 2006; 14(30): 2928-2932
Revised: August 12, 2006
Accepted: August 22, 2006
Published online: October 28, 2006
AIM: To investigate the role of selective cyclooxygenase-2 (COX-2) inhibitor NS398 on the proliferation and apoptosis of colorectal cancer cells, and reveal the COX-2-independent mechanism.
METHODS: Reverse transcription-polymerase chain reaction (RT-PCR) was performed on human colon cancer cell line SW480 to examine COX-2 mRNA expression. Then, NS-398 (a selective COX-2 inhibitor) was added into culture media, and MTT assay was used to examine the proliferation of the cells; Western blot analysis was performed to detect the expression of peroxisome proliferators-activated receptor (PPAR); Flow cytometry was applied to analyze the cell cycle and apoptosis.
RESULTS: The expression of COX-2 mRNA was not detected in colon cancer SW480 cells. NS-398 inhibited the cell proliferation and induced apoptosis in colon cancer cell lines. Seventy-two hours after the treatment of NS398 (75 mmol/L), the proliferative level of SW480 cells was decreased; the rate of the cells at G1 stage was increased from 31.2% to 40.6%, while the rate of those at S stage was decreased from 52.8% to 41.2%. The expression of PPARa, PPARd, PPARg, cyclin D1 and Bcl-xl were decreased along with the prolonging of NS398 treated time.
CONCLUSION: The selective COX-2 inhibitor NS-398 can inhibit the proliferation while induce the apoptosis of colon cancer cell lines through COX-2-independent pathway.
- Citation: Yu LW, Ma XT. Molecular mechanism of cyclooxygenase-2 inhibitor in regulating proliferation of colon cancer cells through modulating PPAR signal transduction pathway. Shijie Huaren Xiaohua Zazhi 2006; 14(30): 2928-2932
- URL: https://www.wjgnet.com/1009-3079/full/v14/i30/2928.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i30.2928
研究表明, 环氧合酶-2(cyclooxygenase-2, COX-2)在结直肠癌中呈过表达, 而非甾体抗炎药(nonsteroidal anti-inflammatory drugs, NSAIDs)可以抑制COX-2表达, 阻断结直肠肿瘤细胞增殖, 但是NSAIDs拮抗肿瘤的作用机制并不只局限于COX-2, 研究显示, NSAIDs参与调控某些细胞内信号转导通路, 其机制尚不清楚[1-4]. 本研究观察选择性COX-2抑制剂NS-398对COX-2低表达结肠癌细胞增殖与凋亡的影响, 以期初步阐明选择性COX-2抑制剂抗结直肠癌非COX-2依赖性途径的作用机制.
结肠癌细胞系SW480与HT29由北京大学人民医院外科肿瘤研究室保存. RPMI 1640培养基、胰蛋白酶(美国GIBCOL/BRL公司)、胎牛血清(美国HyClone公司)、四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)、NS-398(美国Sigma公司). 兔抗人PPARa, PPARd, cyclin D1, Bcl-xl多克隆抗体(美国Santa Cruz公司), 逆转录聚合酶链式反应(RT-PCR)试剂盒(美国Promega公司).
结肠癌细胞系SW480与HT29在含有100 mL/L胎牛血清(美国HyClone公司)的RPMI 1640培养基(美国GIBCO/BRL公司)中传代培养.
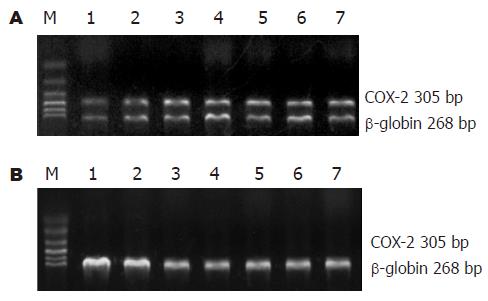
(1)b-微球蛋白引物序列: 上游引物(GH20)5'GAA GAG CCA AGG ACA GGT AC 3'; 下游引物(PCO4)5'CAA CTT CAT CCA CGT TCA CC 3'; PCR产物长度268 bp; (2)COX-2引物序列: 上游引物5'TTC AAA TGA GAT TGT GGG AAA ATT GCT 3'; 下游引物5' AGA TCA TCT CTG CCT GAG TAT CTT 3'; PCR产物长度305 bp; (3)RT-PCR: 应用TRIzol试剂盒(美国GIBCOL/BRL公司), 按说明书提取细胞株SW480、HT29(作为阳性对照)总RNA. 各取5 mg RNA加随机引物Oligo(Dt)12-18及逆转录酶合成cDNA链, 取2 mL cDNA作为模板, 总体积为25 mL的反应体系中包括MgCl2 1.5 mmol/L, 拓扑异构酶2.5 U, COX-2与b-微球蛋白引物终浓度为0.5 mmol/L, 94 ℃变性35 s, 55 ℃退火35 s, 72 ℃延伸30 s, 共40个循环. PCR反应产物经15 g/L琼脂糖凝胶电泳进行鉴定.
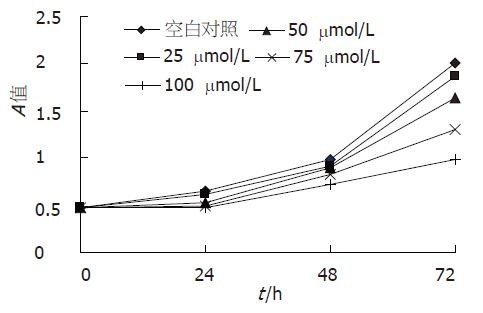
取第3-6代生长状态良好的对数生长期细胞, 常规消化、分离、收集细胞、细胞计数及测定细胞活力, 活细胞率达95%, 按每孔3.2×105个细胞接种于96孔板中, 贴壁后, 无血清培养细胞16-24 h, 使细胞同步化. 实验分两组进行, 即空白对照组与COX-2抑制剂组. 每个研究点设置3组平行对照, 重复3次实验取平均值. 空白对照组加无血清培养基; COX-2抑制剂组加无血清培养基及NS-398; 加入NS-398至浓度达到0, 12.5, 25, 50, 75, 100, 125 mmol/L, 第0, 24 h, 48 h, 72 h分别加入四甲基偶氮唑盐5 mg/mL(美国Sigma公司), 继续培养4 h, 每孔加入DMSO 200 mL, 酶标仪测定540 nm的光密度值A, 绘制生长曲线.
SW480细胞在RPMI1640培养基中培养至80%融合后加入无血清培养基继续培养16-24 h, 使细胞同步化; COX-2抑制剂组培养基中加入NS-398处理细胞; 在不同时间点(0, 24 h, 48 h, 72 h)消化细胞, 0.5 mL PBS重悬细胞, 70%(体积分数)冰乙醇固定细胞过夜, 加入RNAase A至终浓度50 mg/L, 37 ℃恒温水浴1 h, 加入碘化丙啶至终浓度50 mg/L, 4 ℃避光染色1 h, 上流式细胞仪FACScan(美国Becton-Dickinson公司)检测, 资料用Cell Quest细胞周期分析软件处理.
(1)细胞总蛋白提取: 细胞于裂解缓冲液中裂解, 离心30 min后收集上清液得到细胞总蛋白; (2)胞质蛋白提取: 收集细胞悬液, 离心2 min后用胞质缓冲液重悬裂解产物, 收集上清液得到胞质蛋白; (3)细胞核蛋白提取: 收集细胞悬液, 用低渗缓冲液于冰上裂解细胞10 min, 离心后取上清为核提取物; (4)蛋白浓度测定方法(Bradford法): 以牛血清蛋白(BSA)作为标准品, 根据蛋白定量试剂盒(美国Bio-Rad公司)说明绘制蛋白定量标准曲线, 于分光光度计595nm下测吸光度, 计算提取液蛋白浓度.
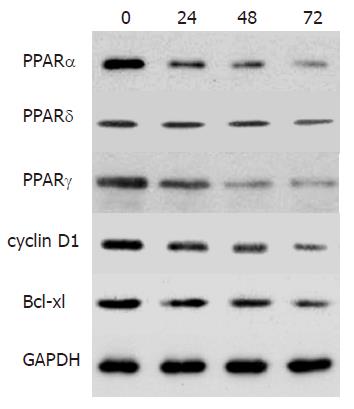
在进行Western blot之前将蛋白提取物与2×十二烷基磺酸钠(SDS)上样缓冲液按1:1混合后100 ℃水浴下加热5 min. 取蛋白样品50 mg, 75-100 g/L聚丙烯酰胺凝胶电泳分离后电转移到PVDF膜上. 转膜后用TBST 缓冲液(10 mmol/L Tris·HCl, pH 7.5, 150 mmol/L 氯化钠, 0.5% Tween-20)与50 mL/L牛血清白蛋白封闭30 min. 封闭后, 分别加入一抗(PPARa, PPARd, PPARg, Bcl-xl, cyclin D1), 工作浓度1:1000, GAPDH 作为内参照, 于4 ℃条件下孵育过夜, 与辣根过氧化物酶结合的二抗孵育30 min, 工作浓度1:1000. 用ECL(英国Amersham公司)化学发光试剂盒检测杂交信号. 用PhosphoImager图像分析仪(美国Molecular Dynamics公司)测定条带的光密度(A值), 以A值代表蛋白的相对表达量.
统计学处理 应用SPSS 12.0统计学软件, 采用独立样本t检验, P<0.05时为有统计学差异.
结肠癌细胞中COX-2 mRNA表达见图1. NS-398可以抑制SW480细胞增殖: 不同浓度NS-398加入培养基后的第0, 24 h, 48 h, 72 h, 用MTT法测定细胞增殖, 与相应空白对照组相比加入COX-2抑制剂NS-398后, SW480细胞增殖水平下降(图2). NS-398对SW480细胞周期的影响: NS-398(75 mmol/L)作用于SW480细胞72 h后, G1期细胞比率由31.2%上升至40.6%, S期细胞比率由52.8%下降至41.2%, 细胞增殖受抑制. NS-398处理组与空白组相比差异有显著性(t = 2.847, P<0.01). NS-398抑制SW480细胞PPAR通路成员表达: PPAR通路成员表达水平随NS-398作用时间延长表达下降(0、24、48、72 h)(图3).
结直肠癌是消化道常见恶性肿瘤之一, 在欧美国家有较高的发病率. 近20年来, 我国结直肠癌发病率也迅速上升. 研究发现, COX-2作为体内前列腺素生物合成的限速酶, 不仅在炎症中起重要作用, 而且参与结直肠癌发生、 发展过程[5-7]. 尽管在结直肠癌发生的分子生物学机制方面已取得了许多进展, 已经发现某些信号转导通路与结直肠癌恶性潜能密切相关, 但是其详细作用机制还有待深入[8-12].
过氧化物酶体增殖因子激活受体(peroxisome proliferators-activated receptor, PPAR)在脂肪代谢、细胞分化与细胞周期调控中起重要作用[13-15]. PPARs属于类固醇核激素受体超家族, 存在3种亚型: PPARa, PPARd(也称PPARb)和PPARg. 他们由不同的基因编码, 分别由441-479个氨基酸残基组成[16-18].
PPARs是过氧化物酶体增殖物(peroxisome proliferator, PP)的激活受体. 研究表明, PP是一类致癌物, 可以诱导增殖凋亡基因c-myc, c-fos, c-jun, Egr-1的表达, 从而在调控细胞周期中起关键作用[19-22]. PPARs在肿瘤细胞系及组织中高表达有利于PP类物质发挥其致癌作用. 研究报道PPARd信号转导通路在结直肠癌发生、发展过程起重要作用, 其详细调控机制尚不清楚[23-25].
NSAIDs作为环氧合酶(COX)抑制剂, 具有解热、镇痛及抗炎作用. 研究显示, NSAIDs可以抑制结肠癌细胞生长并促进其凋亡, 但是其作用机制不能完全用COX-2活性受抑制解释[26-28].
本研究结果显示, SW480细胞不表达COX-2 mRNA, 提示SW480中无COX-2基因的转录. 进一步研究发现, PPARd信号转导通路成员表达水平随NS-398作用时间延长而下降, NS-398可以使SW480细胞G0/G1期比率增高, 降低S、G2/M期比率, 其可能机制为NS-398阻断PPARd通路后, 抑制肿瘤细胞进入DNA合成期从而影响SW480结肠癌细胞增殖并诱导凋亡[29-31].
本研究表明, NS-398存在COX-2非依赖性途径, 而其作用机制可能与肿瘤细胞内多种信号转导通路密切相关, PPAR通路可能是结直肠癌的重要靶点[32-34]. 深入研究选择性COX-2抑制剂对于细胞内信号转导通路的作用可能对于治疗结肠癌提供理论基础[35-36].
非甾体抗炎药(NSAIDs)可以抑制COX-2表达, 阻断结直肠肿瘤细胞增殖, 但是NSAIDs拮抗肿瘤的作用机制并不只局限于COX-2. 选择性COX-2抑制剂抗结直肠癌非COX-2依赖性途径的作用机制是近期研究的重点.
本文研究的PPAR通路在结直肠癌发生中的作用机制是目前研究发展的趋势.
本文为研究COX-2抑制剂抗结直肠癌非COX-2依赖性途径提供了新的研究靶点, 进一步可通过阻断PPAR通路了解肿瘤细胞转移相关特征的改变.
本文内容较新, 对于结直肠癌发生机制从PPAR信号转导通路角度进行了探讨, 为进一步研究提供了理论与实验基础.
电编: 李琪 编辑:张焕兰
| 1. | Grosch S, Maier TJ, Schiffmann S, Geisslinger G. Cyclooxygenase-2 (COX-2)-independent anticarcinogenic effects of selective COX-2 inhibitors. J Natl Cancer Inst. 2006;98:736-747. [PubMed] [DOI] |
| 2. | Huls G, Koornstra JJ, Kleibeuker JH. Non-steroidal anti-inflammatory drugs and molecular carcinogenesis of colorectal carcinomas. Lancet. 2003;362:230-232. [PubMed] [DOI] |
| 3. | Sinicrope FA. Targeting cyclooxygenase-2 for prevention and therapy of colorectal cancer. Mol Carcinog. 2006;45:447-454. [PubMed] [DOI] |
| 4. | Asano TK, McLeod RS. Nonsteroidal anti-inflammatory drugs and aspirin for the prevention of colorectal adenomas and cancer: a systematic review. Dis Colon Rectum. 2004;47:665-673. [PubMed] [DOI] |
| 5. | Konturek PC, Kania J, Burnat G, Hahn EG, Konturek SJ. Prostaglandins as mediators of COX-2 derived carcinogenesis in gastrointestinal tract. J Physiol Pharmacol. 2005;56 Suppl 5:57-73. [PubMed] |
| 6. | Chell S, Patsos HA, Qualtrough D, H-Zadeh AM, Hicks DJ, Kaidi A, Witherden IR, Williams AC, Paraskeva C. Prospects in NSAID-derived chemoprevention of colorectal cancer. Biochem Soc Trans. 2005;33:667-671. [PubMed] [DOI] |
| 7. | Fujimura T, Ohta T, Oyama K, Miyashita T, Miwa K. Role of cyclooxygenase-2 in the carcinogenesis of gastrointestinal tract cancers: a review and report of personal experience. World J Gastroenterol. 2006;12:1336-1345. [PubMed] [DOI] |
| 9. | Cohen SJ, Cohen RB, Meropol NJ. Targeting signal transduction pathways in colorectal cancer-more than skin deep. J Clin Oncol. 2005;23:5374-5385. [PubMed] [DOI] |
| 10. | Fang JY, Richardson BC. The MAPK signalling pathways and colorectal cancer. Lancet Oncol. 2005;6:322-327. [PubMed] [DOI] |
| 12. | 马 向涛, 余 力伟, 张 在兴, 王 杉, 杜 如昱, 崔 志荣. 趋化因子受体CXCR4/CXCL12信号转导通路在结直肠癌肝转移中的作用. 世界华人消化杂志. 2006;14:1566-1570. [DOI] |
| 13. | Desvergne B, Michalik L, Wahli W. Transcriptional regulation of metabolism. Physiol Rev. 2006;86:465-514. [PubMed] [DOI] |
| 14. | Theocharis S, Margeli A, Vielh P, Kouraklis G. Peroxisome proliferator-activated receptor-gamma ligands as cell-cycle modulators. Cancer Treat Rev. 2004;30:545-554. [PubMed] [DOI] |
| 15. | Nehlin JO, Mogensen JP, Petterson I, Jeppesen L, Fleckner J, Wulff EM, Sauerberg P. Selective PPAR agonists for the treatment of type 2 diabetes. Ann N Y Acad Sci. 2006;1067:448-453. [PubMed] [DOI] |
| 16. | Kostadinova R, Wahli W, Michalik L. PPARs in diseases: control mechanisms of inflammation. Curr Med Chem. 2005;12:2995-3009. [PubMed] [DOI] |
| 17. | 马 向涛, 余 力伟, 王 杉, 张 辉, 杜 如昱, 崔 志荣. Stat3与过氧化物酶体增殖因子激活受体δ信号转导通路间交互作用对结肠癌细胞增殖的调控影响. 中华实验外科杂志. 2005;22:1493-1495. |
| 18. | Berger J, Moller DE. The mechanisms of action of PPARs. Annu Rev Med. 2002;53:409-435. [PubMed] [DOI] |
| 19. | Zandbergen F, Mandard S, Escher P, Tan NS, Patsouris D, Jatkoe T, Rojas-Caro S, Madore S, Wahli W, Tafuri S. The G0/G1 switch gene 2 is a novel PPAR target gene. Biochem J. 2005;392:313-324. [PubMed] [DOI] |
| 20. | Fu M, Wang C, Rao M, Wu X, Bouras T, Zhang X, Li Z, Jiao X, Yang J, Li A. Cyclin D1 represses p300 transactivation through a cyclin-dependent kinase-independent mechanism. J Biol Chem. 2005;280:29728-29742. [PubMed] [DOI] |
| 21. | James SY, Lin F, Kolluri SK, Dawson MI, Zhang XK. Regulation of retinoic acid receptor beta expression by peroxisome proliferator-activated receptor gamma ligands in cancer cells. Cancer Res. 2003;63:3531-3538. [PubMed] |
| 22. | Jia Y, Qi C, Kashireddi P, Surapureddi S, Zhu YJ, Rao MS, Le Roith D, Chambon P, Gonzalez FJ, Reddy JK. Transcription coactivator PBP, the peroxisome proliferator-activated receptor (PPAR)-binding protein, is required for PPARalpha-regulated gene expression in liver. J Biol Chem. 2004;279:24427-24434. [PubMed] [DOI] |
| 23. | Koh WP, Yuan JM, Van Den Berg D, Ingles SA, Yu MC. Peroxisome proliferator-activated receptor (PPAR) gamma gene polymorphisms and colorectal cancer risk among Chinese in Singapore. Carcinogenesis. 2006;27:1797-1802. [PubMed] [DOI] |
| 24. | Grau R, Punzon C, Fresno M, Iniguez MA. Peroxisome-proliferator-activated receptor alpha agonists inhibit cyclo-oxygenase 2 and vascular endothelial growth factor transcriptional activation in human colorectal carcinoma cells via inhibition of activator protein-1. Biochem J. 2006;395:81-88. [PubMed] [DOI] |
| 25. | Yang L, Zhou ZG, Luo HZ, Zhou B, Xia QJ, Tian C. Quantitative analysis of PPARdelta mRNA by real-time RT-PCR in 86 rectal cancer tissues. Eur J Surg Oncol. 2006;32:181-185. [PubMed] [DOI] |
| 26. | Church RD, Fleshman JW, McLeod HL. Cyclo-oxygenase 2 inhibition in colorectal cancer therapy. Br J Surg. 2003;90:1055-1067. [PubMed] [DOI] |
| 27. | Pai R, Nakamura T, Moon WS, Tarnawski AS. Prostaglandins promote colon cancer cell invasion; signaling by cross-talk between two distinct growth factor receptors. FASEB J. 2003;17:1640-1647. [PubMed] [DOI] |
| 28. | Lou J, Fatima N, Xiao Z, Stauffer S, Smythers G, Greenwald P, Ali IU. Proteomic profiling identifies cyclooxygenase-2-independent global proteomic changes by celecoxib in colorectal cancer cells. Cancer Epidemiol Biomarkers Prev. 2006;15:1598-1606. [PubMed] [DOI] |
| 29. | 马 向涛, 余 力伟, 王 杉, 张 辉, 杜 如昱, 崔 志荣. COX-2抑制剂调控Stat5信号转导通路抑制结肠癌细胞增殖的分子机制. 中华医学杂志. 2005;85:2566-2569. |
| 30. | Kim SJ, Seo JH, Lee YJ, Yoon JH, Choi CW, Kim BS, Shin SW, Kim YH, Kim JS. Autocrine vascular endothelial growth factor/vascular endothelial growth factor receptor-2 growth pathway represents a cyclooxygenase-2-independent target for the cyclooxygenase-2 inhibitor NS-398 in colon cancer cells. Oncology. 2005;68:204-211. [PubMed] [DOI] |
| 31. | Ulrich S, Loitsch SM, Rau O, von Knethen A, Brune B, Schubert-Zsilavecz M, Stein JM. Peroxisome proliferator-activated receptor gamma as a molecular target of resveratrol-induced modulation of polyamine metabolism. Cancer Res. 2006;66:7348-7354. [PubMed] [DOI] |
| 32. | Linsalata M, Giannini R, Notarnicola M, Cavallini A. Peroxisome proliferator-activated receptor gamma and spermidine/spermine N1-acetyltransferase gene expressions are significantly correlated in human colorectal cancer. BMC Cancer. 2006;6:191. [PubMed] [DOI] |
| 33. | Kim E, Chen F, Wang CC, Harrison LE. CDK5 is a novel regulatory protein in PPARgamma ligand-induced antiproliferation. Int J Oncol. 2006;28:191-194. [PubMed] |
| 34. | Siezen CL, Tijhuis MJ, Kram NR, van Soest EM, de Jong DJ, Fodde R, van Kranen HJ, Kampman E. Protective effect of nonsteroidal anti-inflammatory drugs on colorectal adenomas is modified by a polymorphism in peroxisome proliferator-activated receptor delta. Pharmacogenet Genomics. 2006;16:43-50. [PubMed] [DOI] |
| 35. | Marin HE, Peraza MA, Billin AN, Willson TM, Ward JM, Kennett MJ, Gonzalez FJ, Peters JM. Ligand activation of peroxisome proliferator-activated receptor beta inhibits colon carcinogenesis. Cancer Res. 2006;66:4394-4401. [PubMed] [DOI] |
| 36. | Knutsen HK, Olstorn HB, Paulsen JE, Husoy T, Goverud IL, Loberg EM, Kristiansen K, Alexander J. Increased levels of PPARbeta/delta and cyclin D1 in flat dysplastic ACF and adenomas in Apc(Min/+) mice. Anticancer Res. 2005;25:3781-3789. [PubMed] |