修回日期: 2006-09-20
接受日期: 2006-10-12
在线出版日期: 2006-10-28
目的: 研究Egr-1基因的表达在放射诱导的细胞凋亡中的作用.
方法: 选择肝癌细胞系HepG2, SMMC-7721和正常肝细胞系HL-7702培养; 培养细胞接受4Gy X射线照射; 收获受照前和受照后1, 2, 4, 6, 12和24 h的细胞, 采用荧光定量PCR(FQ-PCR)检测0, 1, 2和4 h Egr-1基因的表达, 采用流式细胞术(FCM)检测0, 6, 12和24 h细胞周期和细胞凋亡.
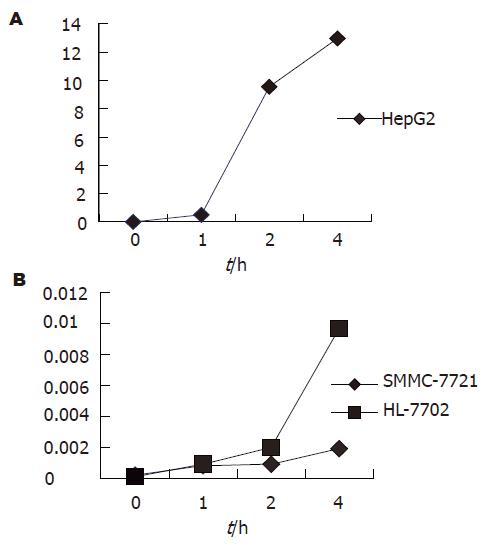
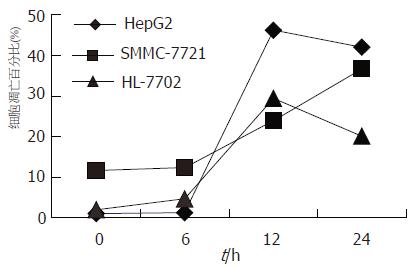
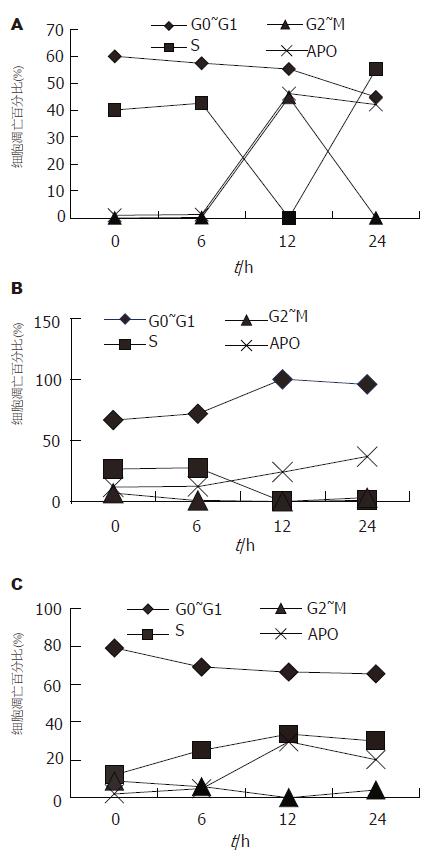
结果: 随HepG2, SMMC-7721和HL-7702在4Gy X射线照射后1 h即诱导了Egr-1基因表达增高, 4 h均未达峰值, 分别为ΔEgrHepG2(12.9629±1.0649)、ΔEgr7702 (0.0096±0.0008)和ΔEgr7721(0.0017±0.0003), HepG2显著高于HL-7702和SMMC-7721(P<0.01). 照射后6 h射线诱导的3株细胞凋亡均不明显, 但在12 h均诱导了明显的细胞凋亡, 而且HepG2(41.16%)和HL-7702(27.45%)已达峰值; SMMC-7721诱导的细胞凋亡水平较低, 24 h仅为24.94%, 且未达峰值. 在射线诱导的细胞周期变化中, HepG2和SMMC-7721 S期的变化与细胞凋亡变化在6-12 h走势相反.
结论: 在HepG2, SMMC-7721和HL-7702细胞中, 射线通过诱导Egr-1基因表达而诱导了细胞周期和细胞凋亡的变化; 射线诱导的Egr-1基因表达水平可能与射线诱导的细胞凋亡成正相关; S期肿瘤细胞可能易发生射线诱导的细胞凋亡.
引文著录: 董广璐, 邢丽娜, 刘晓滨, 刘伟, 金茜, 张淑云. Egr-1基因表达及其在射线诱导的肝癌细胞凋亡中的作用. 世界华人消化杂志 2006; 14(30): 2923-2927
Revised: September 20, 2006
Accepted: October 12, 2006
Published online: October 28, 2006
AIM: To study the relationship between radiation-induced apoptosis and the expression of early growth response-1 (Egr-1) gene in liver cancer cell lines.
METHODS: The cultured cells (HepG2, SMMC-7721 and HL-7702) were irradiated at 4Gy X-radiation. The expression of Egr-1 gene was detected by fluorescent quantitative-polymerase chain reaction (FQ-PCR) before and 1, 2, 4, 6, 12, 24 h after irradiation. Cell cycle and apoptosis were detected by flow cytometry (FCM).
RESULTS: The expression of Egr-1 was increased from 1 to 4 h after irradiation in the three kinds of cell lines HepG2, SMMC-7721 and HL-7702, and the highest expression was in HepG2 cells (DEgrHepG2 = 12.9629 ± 1.0649), which was significantly higher than that in SMMC-7721 or HL-7702 cells (DEgr7721 = 0.0017 ± 0.0003, DEgr7702 = 0.0096 ± 0.0008, P < 0.01). Radiation-induced apoptosis was not significant 6 h after irradiation in all the three cell lines, but it reached the peak value at 12 in HepG2 (41.16%) and HL-7702 cells (27.45%). Radiation-induced apoptosis was still relatively low in SMMC-7721 cells at 24 h (24.94%). Radiation-induced changes of S phase and apoptosis was opposite in the tendency from 6 to 12 h in HepG2 and SMMC-7721 cells.
CONCLUSION: X-radiation may induce cell-cycle changes and cell apoptosis by up-regulation of Egr-1 gene expression, and radiation-induced apoptosis may be associated positively with Egr-1 expression level. HepG2 and SMMC-7721 cells of S phase might be susceptible to apoptosis after irradiation.
- Citation: Dong GL, Xing LN, Liu XB, Liu W, Jin Q, Zhang SY. Early growth response-1 gene expression and its role in radiation-induced apoptosis of liver cancer cell lines. Shijie Huaren Xiaohua Zazhi 2006; 14(30): 2923-2927
- URL: https://www.wjgnet.com/1009-3079/full/v14/i30/2923.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i30.2923
早期生长反应因子1(early growth response-1, Egr-1)基因启动子区含有6个高度保守的CC(A+T)6GG模体(motif), 可感受电离辐射产生的氧自由基的刺激而诱导基因表达[1-4]. 在Egr-1基因表达产物(EGR-1)的羧基端有1个含3个锌指结构的区域, 可与DNA同意序列5'-GCG(T/G)GGGCG-3'或5'-TCC(T/A)CCTCCTCC-3'结合. 已在许多基因的启动子区域发现该类DNA序列, 如转录因子、生长因子、受体、细胞周期调控子和促凋亡等基因[5-6]. 所以, 由射线诱导的Egr-1基因表达, 可能是射线诱导的细胞周期阻滞和(或)细胞凋亡的关键因素. 为此, 我们对肝癌细胞系HepG2, SMMC-7721和正常肝细胞系HL-7702射线诱导的Egr-1基因表达水平, 以及射线诱导的细胞周期和细胞凋亡的变化进行了检测.
肝癌细胞系HepG2, SMMC-7721和正常肝细胞系HL-7702均购于中国医学科学院肿瘤研究所; 流式细胞术(FCM)检测所用试剂为Becton Dickinson公司的试剂盒(CycleTESTTM PLUSDNA Reagent Kit); 由上海生物工程有限公司合成; SYBR GreenⅠ和荧光定量PCR(FQ-PCR)反应试剂(RealMasterMix)由Tiangen Biotech(Beijing)公司提供; 其他试剂均购于Promega公司. 直线加速器为XHA600C(山东新华医疗器械厂); 流式细胞仪为Becton Dickinson FACsort(美国BD公司). FQ-PCR仪为LightCycler(美国Roche公司). 普通PCR仪Bioer XP Cycler(中国博日公司).
HepG2, SMMC-7721和HL-7702用含100 mL/L小牛血清的DMEM培养, 5×105个/孔接种6孔板, 培养48 h. 用4Gy X线照射(剂量率: 250 cGy/min). 继续培养受照细胞. 按试剂盒要求收获照射前和照射后1, 2, 4 h的细胞用于基因表达水平检测. 采用荧光染料(SYBR GreenⅠ)标记的荧光定量PCR(FQ-PCR)技术. 引物设计参照文献[6-7], β-actin: 上游引物5'-CCCAGCACAATGAAGATCAAGATCAT-3', 下游引物5'-ATCTGCTGGAAGGTGGACAGCGA-3'; Egr-1: 上游引物5'-AAAGTTTGCCAGGAGCGATG-3', 下游引物5'-CAGGGGATGGGTATGAGGTG -3'. FQ-PCR反应体系20 μL, 含2.5xRealMasterMix 8 μL, 20xSYBR GreenⅠ 1 μL, 上下游引物各1 μL, cDNA 2 μL(50-100 ng总RNA逆转录产物). 反应条件: 94 ℃预变性5 min; 94 ℃变性30 s, 58 ℃退火40 s和72 ℃延伸20 s, 40个循环, 于每个循环延伸结束后, 以SINGLE方式检测F1通道的荧光强度. 按试剂盒要求将β-actin和Egr-1的普通PCR产物纯化, 连接到pEM-T载体上, 构建标准质粒pEM-actin和pEM-Egr. 常规提取标准质粒, 建立荧光定量标准曲线. 按试剂盒要求收获照射前和照射后6, 12和24 h的细胞, 并用流式细胞术进行细胞周期和细胞凋亡检测.
统计学处理 数据处理采用SPSS 10.0软件系统, 照射前后和细胞系之间基因表达和细胞凋亡变化的比较采用t检验, P<0.05有统计学意义.
3株细胞均在射线照射后1 h诱导了Egr-1基因表达水平的增高, HepG2照射后2 h明显增高, HL-7702则在照射后4 h明显增高, 而SMMC-7721的Egr-1基因表达水平始终较低. 在照射后4 h射线诱导的Egr-1基因表达分别为: ΔEgrHepG2, 12.9629±1.0649; ΔEgr7702, 0.0096±0.0008和ΔEgr7721, 0.0017±0.0003, HepG2显著高于HL-7702和SMMC-7721(P<0.01, 图1).
3株细胞在射线照射后6 h均未诱导明显的细胞凋亡, 而在照射后12 h均诱导了明显的细胞凋亡,且HepG2和HL-7702细胞凋亡达高峰, 而SMMC-7721细胞凋亡比率继续增高. 在照射后12 h诱导的细胞凋亡率分别为: ΔapoHepG2, 45.16%; Δapo7702, 27.45%和Δapo7721, 12.25%. SMMC-7721在照射后24 h诱导的细胞凋亡达24.94%, 仍未达到HL-7702诱导的细胞凋亡水平(图2).
HepG2, SMMC-7721和HL-7702在照射前后不同时间点呈现了不同的变化模式. 在G0-G1期, SMMC-7721与其他两株细胞呈现不同的走势, 前者在照射后12 h内随时间延长该期的百分比呈增高走势, 而后者则相反呈降低走势, 但变化均不明显. 在S期, 3株细胞呈现不同的走势, HL-7702在观察时间内其百分比略呈增高走势; HepG2在6-12 h则呈明显降低走势, 而随后在12-24 h又呈增高走势; SMMC-7721在6-12 h与HepG2相似也呈明显降低走势, 但在随后的12-24 h则没有明显变化. 在G2-M期, 在照射前和照射后6 h内3株细胞均为极低比例, 此后, SMMC-7721和HL-7702呈相同走势, 且保持较低水平,而HepG2则完全与其S期走势相反(图3).
HepG2和SMMC-7721在照射后6-12 h射线诱导的细胞凋亡和S期成相反走势, 射线诱导的细胞凋亡可能发生在S期. 而正常细胞株未有相同趋势(图3).
放射治疗产生DNA损伤, 诱导细胞周期阻滞[8-11]和细胞凋亡[12-15], 并有许多基因参与[16-17]. 如近年来, 采用微阵列技术已检测了射线诱导的基因表达谱, 如低剂量照射(2cGy)可诱导细胞信号传导和DNA损伤反应等基因谱的表达; 大剂量(4-6Gy)则诱导细胞增殖、细胞修复和细胞凋亡等基因谱的表达, 其中包括Egr-1基因[18-19]. 已有研究表明Egr-1基因可介导组织细胞凋亡[20-22]. 又因Egr-1基因启动子区含有6个高度保守的CC(A+T)6GG模体(motif), 可感受电离辐射产生的氧自由基, 而在其表达产物的羧基端有1个含3个锌指结构的区域, 可与DNA同意序列5'-GCG(T/G)GGGCG-3'或5'-TCC(T/A)CCTCCTCC-3'结合, 诱导下游基因的表达, 如TGF-β1, PTEN, p53, p73和TNF-α, 他们都是诱导细胞周期阻滞和细胞凋亡的效应基因. 所以Egr-1基因在射线诱导的细胞周期阻滞和细胞凋亡中可能起关键作用[23-27]. 我们研究的HepG2, SMMC-7721和HL-7702 3株细胞在4Gy射线照射后均诱导了Egr-1基因表达水平的增高、细胞凋亡的增加和细胞周期的变化.
在照射前, 3株细胞Egr-1基因表达水平均较低, 与文献报道较一致[28]. 在4Gy照射后2 h和4 h, HepG2和HL-7702均诱导了较高水平的基因表达, 在12 h诱导了最大程度的细胞凋亡. 而SMMC-7721在4 Gy照射后2 h和4 h, 诱导的基因表达水平相对较低, 在12 h不仅诱导的细胞凋亡比例相对较低, 而且未达到峰值. 这些结果提示同种组织不同细胞株射线诱导的Egr-1基因表达水平可能不同; 射线诱导的Egr-1基因表达水平可能与射线诱导的细胞凋亡成正相关. 另外, 在照射前后细胞周期与细胞凋亡变化的比较中, 我们发现, 在4Gy照射后6-24 h, HepG2 S期细胞比例变化与细胞凋亡比例变化成相反走势, 提示HepG2 S期细胞可能易发生细胞凋亡. SMMC-7721 S期细胞比例变化与细胞凋亡比例变化也成相反走势, 可能与HepG2有类似的结果. 而HL-7702则未发现细胞周期与细胞凋亡之间有相关的变化.
我们的研究结果表明, 在HepG2, SMMC-7721和HL-7702 3株细胞中, 射线通过诱导Egr-1基因表达而诱导了细胞周期和细胞凋亡的变化; 射线诱导的Egr-1基因表达水平可能与射线诱导的细胞凋亡成正相关. 在不同细胞株射线通过Egr-1基因诱导细胞凋亡的确切分子机制有待进一步明确.
目前的研究表明, 射线照射与某些起转录因子作用的早期基因激活有关, 如jun, fos和Egr-1等. Egr-1是早期生长反应因子基因(Egr)家族成员之一, 该家族包括Egr-1, Egr-2, Egr-3, Egr-4, Egr-α和Wilms肿瘤抑制因子1基因 (WT1). Egr-1基因启动子区含有6个高度保守的CC(A+T)6GG模体(motif), 可感受电离辐射产生的氧自由基, 而在其表达产物的羧基端有1个含3个锌指结构的区域, 可与DNA序列5'-GCG(T/G)GGGCG-3' 或5'-TCC(T/A)CCTCCTCC-3'结合, 诱导下游基因的表达, 如TGF-β1, PTEN, p53, p73和TNF-α, 他们都是诱导细胞周期阻滞和细胞凋亡的效应基因. 所以Egr-1基因在射线诱导的细胞周期阻滞和细胞凋亡中可能起关键作用.
Egr-1基因在放射生物学反应中的作用及其启动子序列在放射诱导的基因治疗中的应用是目前关注的热点.
用荧光定量PCR法研究射线诱导的Egr-1基因表达的变化, 同时用流式细胞术研究射线诱导的细胞周期和细胞凋亡的变化, 为放射生物学机制研究提供了实验依据.
研究题目新颖, 具有很好的应用前景, 文章条理清晰, 用词准确. 研究方案设计合理, 研究结果科学可信, 对于肝癌的放射治疗有很好的指导作用.
本文内容较新, 对于结直肠癌发生机制从PPAR信号转导通路角度进行了探讨, 为进一步研究提供了理论与实验基础.
电编: 李琪 编辑:王晓瑜
| 1. | Suggs SV, Katzowitz JL, Tsai-Morris C, Sukhatme VP. cDNA sequence of the human cellular early growth response gene Egr-1. Nucleic Acids Res. 1990;18:4283. [PubMed] [DOI] |
| 2. | Meyer RG, Kupper JH, Kandolf R, Rodemann HP. Early growth response-1 gene (Egr-1) promoter induction by ionizing radiation in U87 malignant glioma cells in vitro. Eur J Biochem. 2002;269:337-346. [PubMed] [DOI] |
| 3. | Datta R, Taneja N, Sukhatme VP, Qureshi SA, Weichselbaum R, Kufe DW. Reactive oxygen intermediates target CC(A/T)6GG sequences to mediate activation of the early growth response 1 transcription factor gene by ionizing radiation. Proc Natl Acad Sci USA. 1993;90:2419-2422. [PubMed] [DOI] |
| 4. | 魏 道严, 戴 冰冰, 陈 诗书. 放射诱导调控腺病毒介导gfp报告基因在肿瘤细胞内的表达. 生物化学与生物物理学报. 2001;33:123-127. |
| 5. | Krones-Herzig A, Mittal S, Yule K, Liang H, English C, Urcis R, Soni T, Adamson ED, Mercola D. Early growth response 1 acts as a tumor suppressor in vivo and in vitro via regulation of p53. Cancer Res. 2005;65:5133-5143. [PubMed] [DOI] |
| 6. | Shozu M, Murakami K, Segawa T, Kasai T, Ishikawa H, Shinohara K, Okada M, Inoue M. Decreased expression of early growth response-1 and its role in uterine leiomyoma growth. Cancer Res. 2004;64:4677-4684. [PubMed] [DOI] |
| 7. | Ogawa H, Tamaki H, Ikegame K, Soma T, Kawakami M, Tsuboi A, Kim EH, Hosen N, Murakami M, Fujioka T. The usefulness of monitoring WT1 gene transcripts for the prediction and management of relapse following allogeneic stem cell transplantation in acute type leukemia. Blood. 2003;101:1698-1704. [PubMed] [DOI] |
| 8. | Pawlik TM, Keyomarsi K. Role of cell cycle in mediating sensitivity to radiotherapy. Int J Radiat Oncol Biol Phys. 2004;59:928-942. [PubMed] [DOI] |
| 9. | Nome RV, Bratland A, Harman G, Fodstad O, Andersson Y, Ree AH. Cell cycle checkpoint signaling involved in histone deacetylase inhibition and radiation-induced cell death. Mol Cancer Ther. 2005;4:1231-1238. [PubMed] [DOI] |
| 10. | Lee YJ, Soh JW, Dean NM, Cho CK, Kim TH, Lee SJ, Lee YS. Protein kinase Cdelta overexpression enhances radiation sensitivity via extracellular regulated protein kinase 1/2 activation, abolishing the radiation-induced G(2)-M arrest. Cell Growth Differ. 2002;13:237-246. [PubMed] |
| 11. | Fabbro M, Savage K, Hobson K, Deans AJ, Powell SN, McArthur GA, Khanna KK. BRCA1-BARD1 complexes are required for p53Ser-15 phosphorylation and a G1/S arrest following ionizing radiation-induced DNA damage. J Biol Chem. 2004;279:31251-31258. [PubMed] [DOI] |
| 12. | Ross GM. Induction of cell death by radiotherapy. Endocr Relat Cancer. 1999;6:41-44. [PubMed] [DOI] |
| 13. | Blakely EA. Radiation-induced changes in a cell's program for life. Acta Oncol. 1998;37:127-128. [PubMed] [DOI] |
| 14. | Nakajima T. Signaling cascades in radiation-induced apoptosis: Roles of protein kinase C in the apoptosis regulation. Med Sci Monit. 2006;12:RA220-224. [PubMed] |
| 15. | Liu ZZ, Huang WY, Li XS, Lin JS, Cai XK, Lian KH, Zhou HJ. Prediction value of radiosensitivity of hepatocarcinoma cells for apoptosis and micronucleus assay. World J Gastroenterol. 2005;11:7036-7039. [PubMed] [DOI] |
| 16. | Shinomiya N. New concepts in radiation-induced apoptosis: 'premitotic apoptosis' and 'postmitotic apoptosis'. J Cell Mol Med. 2001;5:240-253. [PubMed] [DOI] |
| 18. | Ding LH, Shingyoji M, Chen F, Hwang JJ, Burma S, Lee C, Cheng JF, Chen DJ. Gene expression profiles of normal human fibroblasts after exposure to ionizing radiation: a comparative study of low and high doses. Radiat Res. 2005;164:17-26. [PubMed] [DOI] |
| 19. | Otomo T, Hishii M, Arai H, Sato K, Sasai K. Microarray analysis of temporal gene responses to ionizing radiation in two glioblastoma cell lines: up-regulation of DNA repair genes. J Radiat Res (Tokyo). 2004;45:53-60. [PubMed] [DOI] |
| 20. | Lee CG, Cho SJ, Kang MJ, Chapoval SP, Lee PJ, Noble PW, Yehualaeshet T, Lu B, Flavell RA, Milbrandt J. Early growth response gene 1-mediated apoptosis is essential for transforming growth factor beta1-induced pulmonary fibrosis. J Exp Med. 2004;200:377-389. [PubMed] [DOI] |
| 21. | Pignatelli M, Luna-Medina R, Perez-Rendon A, Santos A, Perez-Castillo A. The transcription factor early growth response factor-1 (EGR-1) promotes apoptosis of neuroblastoma cells. Biochem J. 2003;373:739-746. [PubMed] [DOI] |
| 22. | Wu MY, Liang YR, Wu XY, Zhuang CX. Relationship between Egr-1 gene expression and apoptosis in esophageal carcinoma and precancerous lesions. World J Gastroenterol. 2002;8:971-975. [PubMed] [DOI] |
| 23. | Ahmed MM. Regulation of radiation-induced apoptosis by early growth response-1 gene in solid tumors. Curr Cancer Drug Targets. 2004;4:43-52. [PubMed] [DOI] |
| 24. | Huang X, Halicka HD, Traganos F, Tanaka T, Kurose A, Darzynkiewicz Z. Cytometric assessment of DNA damage in relation to cell cycle phase and apoptosis. Cell Prolif. 2005;38:223-243. [PubMed] [DOI] |
| 25. | Darzynkiewicz Z, Huang X, Okafuji M. Detection of DNA strand breaks by flow and laser scanning cytometry in studies of apoptosis and cell proliferation (DNA replication). Methods Mol Biol. 2006;314:81-93. [PubMed] [DOI] |
| 26. | Essmann F, Engels IH, Totzke G, Schulze-Osthoff K, Janicke RU. Apoptosis resistance of MCF-7 breast carcinoma cells to ionizing radiation is independent of p53 and cell cycle control but caused by the lack of caspase-3 and a caffeine-inhibitable event. Cancer Res. 2004;64:7065-7072. [PubMed] [DOI] |
| 27. | Raffoul JJ, Wang Y, Kucuk O, Forman JD, Sarkar FH, Hillman GG. Genistein inhibits radiation-induced activation of NF-kappaB in prostate cancer cells promoting apoptosis and G2/M cell cycle arrest. BMC Cancer. 2006;6:107. [PubMed] [DOI] |
| 28. | Hao MW, Liang YR, Liu YF, Liu L, Wu MY, Yang HX. Transcription factor EGR-1 inhibits growth of hepatocellular carcinoma and esophageal carcinoma cell lines. World J Gastroenterol. 2002;8:203-207. [PubMed] |