修回日期: 2006-08-31
接受日期: 2006-09-16
在线出版日期: 2006-10-28
目的: 观察肝细胞癌变过程中胰岛素样生长因子Ⅱ(IGF-Ⅱ)的动态改变及与病理学特征的关系.
方法: 以2-乙酰氨基芴(2-FAA)喂饲♂SD鼠诱发肝细胞发生癌变, 以病理学方法(HE染色)和酶联免疫吸附法(ELISA), 分别观察肝细胞形态学、肝及血IGF-Ⅱ的动态变化. 以免疫组织化学法分析肝组织IGF-Ⅱ表达与胞内定位.
结果: 组织学证实SD鼠在喂饲2-FAA后, 在肝细胞出现颗粒样变性、不典型增生到HCC的形成过程中IGF-Ⅱ呈梯度表达, 表现为癌组明显高于对照组和变性组(癌组 vs 变性组, χ2 = 9.55, P<0.01; 癌组 vs 正常组, χ2 = 14.00, P<0.01), 大鼠肝癌中IGF-Ⅱ在肝细胞内呈阳性表达; 肝组织和外周血中IGF-Ⅱ呈显著正相关(r = 0.97, P<0.01).
结论: IGF-Ⅱ参与肝细胞的癌变过程, 在癌变早期表达增加有助于肝癌早期诊断及预后判断.
引文著录: 邱历伟, 姚登福, 宗蕾, 吴玮, 吴信华. 肝细胞癌变过程中胰岛素样生长因子Ⅱ的动态表达与改变特征. 世界华人消化杂志 2006; 14(30): 2918-2922
Revised: August 31, 2006
Accepted: September 16, 2006
Published online: October 28, 2006
AIM: To investigate the dynamic expression and alteration of insulin-like growth factor-Ⅱ(IGF-Ⅱ) during in the pathogenesis and development of hepatocellular carcinoma.
METHODS: Hepatoma models were induced with 2-fluorenylacetamide (2-FAA) in male Sprague-Dawley (SD) rats. The morphological changes of rat livers were observed by HE staining. The dynamic changes of IGF-Ⅱ in rat livers and sera were quantitatively analyzed by enzyme linked immunosorbent assay (ELISA). Simultaneously, the expression and cellular distribution of IGF-Ⅱ were detected by immunohistochemistry.
RESULTS: Histological examination confirmed that the expression of IGF-Ⅱwas increased in gradient after granule-like degeneration, atypical hyperplasia and carcinoma appeared in hepatocytes, and it was significantly higher in carcinoma group than that in degeneration and control group (carcinoma vs degeneration, χ2 = 9.55, P < 0.01; carcinoma vs control, χ2 = 14.00, P < 0.01). IGF-Ⅱwas positively expressed inside the liver cancer cells, and there was positive correlation between tissue and serum IGF-Ⅱ expression (r = 0.97, P < 0.01).
CONCLUSION: IGF-Ⅱ is involved in the carcinogenesis of hepatocellular carcinoma, and its expression is up-regulated at the early stage of carcinoma, which can help to achieve early diagnosis and prognosis judgment.
- Citation: Qiu LW, Yao DF, Zong L, Wu W, Wu XH. Dynamic expression and alteration characteristic of insulin-like growth factor-Ⅱ in the carcinogenesis of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(30): 2918-2922
- URL: https://www.wjgnet.com/1009-3079/full/v14/i30/2918.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i30.2918
肝癌(HCC)是由病毒、化学致癌物等多病因作用[1-3], 因癌基因或癌相关基因激活、抗癌基因失活或胚胎期某些酶基因重新复活等诸多因素引起肝细胞生长失控而致癌变, 经启动、促进、演变多阶段的发病过程, 其中基因的调控和表达、多种生长因子的活性等均与肝癌的发生、发展密切相关[4-6]. 胰岛素样生长因子(Insulin-like growth factor, IGF)-Ⅱ是与胰岛素同源的多肽, 并具有胰岛素样活性, 引起不同类型细胞的有丝分裂[7]. 本文以免疫组织化学法分析了诱癌过程中IGF-Ⅱ在大鼠肝脏的胞内定位及表达, 并以酶联免疫吸附法测定了大鼠肝脏诱癌过程中IGF-Ⅱ水平在肝脏和血清中的变化趋势, 探讨了IGF-Ⅱ在肝癌发生、发展过程中的作用机制及其作为肝癌早期诊断标志物的可能性.
♂Sprague-Dawley(SD)大鼠48只, 4-6 wk龄, 体质量120-160 g, 由南通大学实验动物中心提供, 清洁级. 分笼喂养于8个等大的笼中, 普通大鼠颗粒饲料由南通大学实验动物中心提供. 随机分为6只/笼, 随机挑选1个笼子的大鼠作为正常对照组, 其余为实验组(其中1组为备用组). 对照鼠给予一般颗粒饲料, 其余实验鼠以0.5 g/L的2-乙酰氨基芴(2-Fluorenylacetamide, 2-FAA, Sigma)颗粒饲料作恒环境饲养. 实验期间剔除死亡鼠, 以备用鼠补足. 每2 wk取1只正常鼠及1组实验鼠, 以乙醚轻度麻醉. 从心尖取血5 mL分离血清, 置-20 ℃冰箱保存; 肝组织洗去血迹, 部分用40 g/L中性甲醛液固定作病理学检查(HE染色)和免疫组织化学染色, 其余组织置-80 ℃保存(Sanyo超低温冰箱).
1.2.1 大鼠肝组织的HE染色观察: 肝组织经40 g/L中性甲醛液固定, 脱水、透明、石蜡包埋后, 经切片(厚度4 μm)、展片、贴片、烤片后制成空白片. 经脱蜡、水化, 苏木素染色, 分化、反蓝, 伊红浸染, 脱水、透明、封片后制成苏木素-伊红(HE)染色切片. OLYMPUS BX 50光学显微镜(日本OLYMPUS公司)下观察.
1.2.2 免疫组织化学染色(链霉亲和素-生物素法, S-P法): 新鲜鼠肝组织经取材、固定、浸蜡, 作成厚度4 mm的组织切片; 常规脱蜡、水化; 双氧水阻断内源性过氧化物酶; 高压加热法修复抗原; 正常动物血清封闭非特异性结合; 滴加IGF-Ⅱ抗体, 4 ℃过夜, 磷酸盐缓冲液(PBS)漂洗; 滴加生物素标记的第二抗体, 室温孵育10 min, PBS漂洗; 滴加链霉素抗生物素蛋白-过氧化酶, 室温孵育10 min, PBS冲洗; 滴加新鲜配制的四盐酸二氨基联苯胺(DAB)溶液, 室温显色, 蒸馏水洗涤; 苏木素复染. 无水乙醇脱水透明、封片. OLYMPUS BX 50光学显微镜观察、摄像. 以0.01 mol/L PBS液(pH7.5)分别替代一抗、二抗和SP试剂作阴性对照, 已知表达IGF-Ⅱ的乳腺癌组织作阳性对照. 组织中显示棕黄色颗粒为IGF-Ⅱ表达阳性. 肝组织中IGF-Ⅱ表达强度: +, 阳性细胞数为10%-25%; ++, 阳性细胞数为26%-50%; +++, 阳性细胞数为>50%.
1.2.3 鼠肝细胞质蛋白浓度测定: 取肝组织60 mg左右, 剪碎. 按20:1混合适当量的细胞质蛋白抽提试剂(碧云天)A和B, 加入PMSF至终浓度为1 mmol/L配制成组织匀浆液. 取匀浆液200 mL与组织混合, 充分匀浆. 冰浴15 min, 4 ℃ 15 000 g离心5 min. 分离上清至一预冷的塑料管中, 为部分质蛋白. 每20 mL沉淀加入添加了PMSF的试剂A 200 mL. 高速剧烈振摇5 s, 使沉淀完全悬浮分散开. 冰浴15 min. 加试剂B 10 mL. 高速剧烈振摇5 s, 冰浴1 min. 高速剧烈振摇5 s, 4 ℃12 000-16 000 g离心5 min. 立即吸取上清至上述塑料管中, 即为抽提得到的质蛋白. 肝细胞质蛋白浓度以BCA法测定, 按50:1混合BCA试剂A、B配制适量BCA工作液. 蛋白标准品稀释10倍. 稀释后的标准品按0, 1, 2, 4, 8, 12, 16, 20 mL加至标准品孔中, 加水补足到20 mL. 加适当体积样品至样品孔中, 加水稀释到20 mL. 各孔加入BCA工作液200 mL, 37 ℃放置30 min. 测定A578. 根据标准曲线计算出蛋白浓度.
1.2.4 大鼠IGF-Ⅱ测定: 大鼠IGF-Ⅱ以大鼠IGF-ⅡELISA Kit/96T(ADL公司)分析. 浓缩洗涤液稀释50倍. 辣根过氧化物酶(HRP)稀释60倍. 标本稀释50000倍. 加入标准品100 mL、已稀释标本100 mL于相应反应板孔中. 轻轻混匀30 s, 25 ℃温育20 min. 反复洗板3次. 加生物素化的抗大鼠IGF-Ⅱ100 mL. 轻轻混匀30 s, 25 ℃温育20 min. 反复洗板3次. 加100 mL×HRP. 轻轻混匀30 s, 25 ℃温育10 min. 反复洗板3次. 每孔加入100 mL TMB显色液, 轻轻混匀10 s, 25 ℃温育20 min. 每孔加入终止液100 mL. 轻轻混匀30 s; 测定A450. 根据标准曲线计算其浓度.
统计学处理 所有数据以均数±标准差表示, 多个样本均数间的比较先进行方差齐性检验, 再进行方差分析, 两样本均数的比较采用t检验, 样本率之间的比较采用Fisher确切概率法; 相关性用直线相关分析. 以P<0.05表示差异有显著性.
在2-FAA的诱癌过程中, 大鼠肝细胞在形态学上发生了明显变化, 诱癌不同时期大鼠肝脏病理学变化的实际发生情况见表1. 在鼠肝细胞癌变阶段, 经组织学检查发现: 在诱癌早期, 肝细胞胞质出现颗粒样变性, 偶见大的异型胞核(肝细胞变性组); 中期阶段肝板细胞层次增多, 局灶细胞层次超过3层, 细胞核染色质增粗, 核质比例增大(癌前病变组); 在诱癌的后期, 可见肝组织结构消失, 肝细胞排列成巢状、粗条索状, 细胞核中等大, 核染色质增粗, 核质比例增大, 均为高分化HCC(肝细胞癌变组).
| 分组 | n | 肝组织病理组织学形态变化 | |||
| 正常 | 变性 | 癌前 | 癌变 | ||
| 对照组 | 6 | 6 | 0 | 0 | 0 |
| 实验组第2周 | 6 | 0 | 6 | 0 | 0 |
| 第4周 | 6 | 0 | 6 | 0 | 0 |
| 第6周 | 6 | 0 | 5 | 1 | 0 |
| 第8周 | 6 | 0 | 3 | 2 | 1 |
| 第10周 | 6 | 0 | 2 | 1 | 3 |
| 第12周 | 6 | 0 | 0 | 2 | 4 |
| 总计 | 42 | 6 | 22 | 6 | 8 |
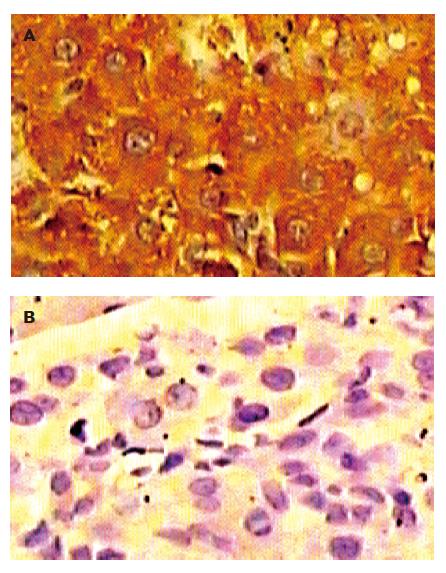
IGF-Ⅱ表达阳性物质呈棕黄色颗粒, 主要定位于胞质, 少数细胞出现胞核着色, 胞膜未见着色(图1). 随着大鼠肝组织癌变的发生, IGF-Ⅱ阳性率逐渐增高, 正常鼠无阳性表达, 变性组阳性率仅为36.36%, 癌前组与癌变组明显上升, 阳性率已达100%, 差别均有显著性意义(P<0.01). 而且IGF-Ⅱ表达强度呈增强趋势, 在变性鼠阳性中多呈"+"表达水平, 癌前鼠已有3例达"++"或"+++"水平, 而癌变组的8例中有5例为"+++"水平(表2).
在大鼠肝细胞诱癌过程中, 肝细胞质IGF-Ⅱ的表达水平随肝组织学形态的改变呈增高趋势, 表现为癌变组>癌前病变组>肝细胞变性组>正常对照组, 其变化趋势有显著性意义(F = 13.2, P<0.01). 肝细胞质中IGF-Ⅱ平均浓度在癌前病变组明显高于正常组(t = 12.46, P<0.01)及变性组(t = 3.50, P<0.01); 癌变组明显高于正常组(t =16.39, P<0.01)、变性组(t = 6.79, P<0.01)和癌前病变组(t = 2.42, P<0.05). 肝脏IGF-Ⅱ释放入血后, 引起血清中IGF-Ⅱ增加. 血IGF-Ⅱ浓度, 正常肝对照组>肝细胞变性组>癌前病变组>肝细胞癌变组, 呈明显梯度升高, 差别有显著性意义(F= 48.1, P<0.01), 其中癌前病变组显著高于正常组(t =16.18, P<0.01)及变性组(t = 7.40, P<0.01); 癌变组显著高于正常组(t = 9.03, P<0.01)、变性组(t = 6.75, P<0.01)及癌前病变组(t = 4.30, P<0.01). 血清与肝细胞质中IGF-Ⅱ浓度的变化呈显著正相关(r = 0.97, t = 5.97, P<0.01)(表3).
| 分组 | n | 血IGF-II (mean±SD, ng/L) | t | P | 肝IGF-II (mean±SD, μg/g蛋白) | t | P |
| 正常组 | 6 | 86.4±14.7 | 9.03 | <0.01 | 21.7±4.5 | 16.39 | <0.01 |
| 变性组 | 22 | 174.2±43.4 | 6.75 | <0.01 | 54.9±12.8 | 6.79 | <0.01 |
| 癌前组 | 6 | 274.1±24.1 | 4.30 | <0.01 | 70.3±8.4 | 2.42 | <0.05 |
| 癌变组 | 8 | 450.3±112.6 | 80.7±7.4 |
IGF-Ⅱ为小分子肽, 由67个氨基酸残基组成(MW 7.5 kDa), 分子中含有3个链内二硫键, 其分子结构与胰岛素前体具有较高同源性, 他对体内多种组织中的代谢、细胞生长和分化具有调节作用. 成人肝脏是IGF主要的生物合成及内分泌场所, 但在人体, 除肝外的大部分组织也具有外分泌或旁分泌产生IGF的能力, IGF-Ⅱ型受体则可能参与IGF-Ⅱ的降解[8]. 以蛋白质复合形式存在的IGF易于与其受体结合以调节其活性, 体内的生长激素参与调控IGF的表达[9]. 血清中IGFs与特异结合蛋白具有高度亲和力, 现已鉴定出的结合蛋白(BP)有6种,分别命名为IGFBP1-6. 外周血中IGFs是由IGF、IGFBP和对酸敏感的亚单位组成, 大约为150 kd的高分子复合物, 结合形式的IGFs可延长其半寿期, 防止如低血糖血症的急性胰岛素样作用出现. 此外血中也存在31-40 kd二聚体IGFs形式, 他易于通过毛细血管壁到达靶组织而发挥生物学效应[8,10].
体内IGF-Ⅱ是肝细胞癌变过程中发挥重要作用的生长因子, 他通过IGF-Ⅰ受体上的酪氨酸激酶途径合成与活化[11-13]. IGF-Ⅱ的活化与表达过程, 已在化学诱癌鼠、转基因鼠和肝炎病毒慢性感染的实验动物及肝组织中得到证实[14-15]. 转基因鼠中若持续表达IGF-Ⅱ, 则肝细胞癌和淋巴瘤的发病频率增加. 在肝细胞癌变过程中, 胚胎型IGF-Ⅱ基因活化, 使IGF-Ⅱ呈高水平状态[16]. 肝细胞癌变过程中IGF-Ⅱ呈高度表达的机制尚不十分清楚, 可能与IGF-Ⅱ通过自分泌或旁分泌作用促进细胞转化有关. 本研究以免疫组织化学法分析了大鼠诱癌过程中IGF-Ⅱ的表达与变化, 并以酶联免疫吸附法对大鼠肝组织和血清中IGF-Ⅱ水平在诱癌过程中的变化趋势和相互关系进行了分析. 研究发现大鼠肝脏IGF-Ⅱ表达阳性率在癌前病变组及癌变组均明显高于正常组和变性组, 且其表达水平也呈升高趋势. 大鼠肝脏和血清中IGF-Ⅱ浓度的变化趋势也显示, 诱癌过程中癌前病变鼠肝组织及血清IGF-Ⅱ水平均明显高于正常组及变性组, 而癌变鼠肝组织及血清IGF-Ⅱ水平又显著高于正常组、变性组及癌前病变组, 且肝组织和血清中IGF-Ⅱ的变化趋势有明显的相关性. 证实IGF-Ⅱ在肝细胞癌变的发生、发展过程中均具有重要作用. 其主要机制可能为诱癌因素导致IGF-Ⅱ基因的异常激活和过量表达, 促使具有高增殖活性状态的癌前肝细胞转化, 最终导致肝癌发生, 同时IGF-Ⅱ的表达水平亦同步反映肝脏病变的程度[17-18].
肝癌细胞置于缺氧状态中培养6 h, 发现IGF-Ⅱ mRNA增加,提示缺氧可能是肝细胞癌变过程中诱导IGF-Ⅱ表达的重要因素[19-20]. 肝癌为典型的血管丰富的肿瘤, IGF-Ⅱ在肝癌的新血管形成过程中起重要作用. 在肝癌细胞培养的一定时间内, IGF-Ⅱ增加同时引起血管内皮生长因子(VEGF)-mRNA和蛋白质浓度的增加. 他们均为缺氧引起的表达, 可以认为IGF-Ⅱ为肝癌的一种缺氧诱导血管生成因子[21]. 由于肝硬变再生结节和肝癌细胞的快速分裂可导致肝脏供血不足, 造成局部缺氧状态, 促使IGF-Ⅱ合成增加,并作为血管活性因子间接促进血管内皮生长因子的合成, 刺激HCC新生血管的形成[22]. 此外, 在HCV感染的慢性肝病发展过程中, IGF-Ⅱ的启动子P1、P3和P4水平呈进行性增加, 其中胚胎型P3呈显著表达, 提示在癌前期肝细胞分化中IGF-Ⅱ呈过度表达, 并参与肝细胞的癌变过程[23].
我国为肝癌高发区, 对肝癌的早期诊断是治疗的重点和难点. 近年来, 通过监测癌基因或癌相关基因以提高肝癌早期诊断率的研究成为国际上的热点. IGF-II作为胰岛素样生长因子类癌基因家族成员之一, 其在肝癌发生、发展过程中的作用机制及通过监测IGF-II以诊断肝癌的方法学探索也日益受到关注.
目前, 通过监测肝癌患者血清中IGF-Ⅱ水平以阐明其在肝癌发生、发展过程中的意义及其作为早期诊断肝癌标志物的可行性的研究较为深入, 但通过动物实验直接观察大鼠肝脏诱癌过程中IGF-Ⅱ表达与改变的研究尚较少见.
关于IGF-Ⅱ水平与肝癌关系的研究目前大都集中在临床血清学检测方面. 本文则在大鼠肝脏诱癌的动物实验中, 以病理学方法(HE染色)和酶联免疫吸附法(ELISA), 分别观察肝细胞形态学、肝及血IGF-Ⅱ的动态变化. 以免疫组织化学法分析肝组织IGF-Ⅱ的表达、胞内定位及变化规律.
本文为进一步探讨IGF-Ⅱ在肝癌发生、发展过程中的作用机制及其表达规律提供了新的研究思路和方法, 今后可从基因水平对IGF-Ⅱ的表达做进一步的研究.
作者通过制作化学性致肝癌模型,监测癌变过程中IGF-Ⅱ及肝细胞病理变化对于进一步揭示肝细胞恶变机制有一定意义, 同时为临床上应用IGF-Ⅱ检测来早期诊断肝癌提供一定理论依据. 选题先进, 实验设计合理可靠.
电编: 李琪 编辑:张焕兰
| 1. | Peto J. Cancer epidemiology in the last century and the next decade. Nature. 2001;411:390-395. [PubMed] [DOI] |
| 2. | Lee YI, Lee S, Das GC, Park US, Park SM, Lee YI. Activation of the insulin-like growth factor II transcription by aflatoxin B1 induced p53 mutant 249 is caused by activation of transcription complexes; implications for a gain-of-function during the formation of hepatocellular carcinoma. Oncogene. 2000;19:3717-3726. [PubMed] [DOI] |
| 3. | Ji GZ, Wang XH, Miao L, Liu Z, Zhang P, Zhang FM, Yang JB. Role of transforming growth factor-beta1-smad signal transduction pathway in patients with hepatocellular carcinoma. World J Gastroenterol. 2006;12:644-648. [PubMed] [DOI] |
| 4. | Yao D, Jiang D, Huang Z, Lu J, Tao Q, Yu Z, Meng X. Abnormal expression of hepatoma specific gamma-glutamyl transferase and alteration of gamma-glutamyl transferase gene methylation status in patients with hepatocellular carcinoma. Cancer. 2000;88:761-769. [PubMed] [DOI] |
| 5. | Thorgeirsson SS, Grisham JW. Molecular pathogenesis of human hepatocellular carcinoma. Nat Genet. 2002;31:339-346. [PubMed] [DOI] |
| 6. | Yao DF, Wu XH, Zhu Y, Shi GS, Dong ZZ, Yao DB, Wu W, Qiu LW, Meng XY. Quantitative analysis of vascular endothelial growth factor, microvascular density and their clinicopathologic features in human hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2005;4:220-226. [PubMed] |
| 7. | Scharf JG, Dombrowski F, Ramadori G. The IGF axis and hepatocarcinogenesis. Mol Pathol. 2001;54:138-144. [PubMed] [DOI] |
| 8. | 邱 历伟, 姚 登福, 吴 信华, 吴 玮, 苏 小琴, 邹 黎. 肝癌组织IGF-Ⅱ表达与HBV-DNA复制及病理学特征的研究. 世界华人消化杂志. 2006;14:1267-1271. [DOI] |
| 9. | Dong ZZ, Yao DF, Yao DB, Wu XH, Wu W, Qiu LW, Jiang DR, Zhu JH, Meng XY. Expression and alteration of insulin-like growth factor II-messenger RNA in hepatoma tissues and peripheral blood of patients with hepatocellular carcinoma. World J Gastroenterol. 2005;11:4655-4660. [PubMed] [DOI] |
| 10. | Yao DF, Dong ZZ, Liu YH, Zhao L, Huang JF, Meng XY. Amplification of peripheral blood insulin-like growth factor II-mRNA and its clinical significance in the diagnosis of hepatocellular carcinoma. Zhonghua Gan Zang Bing Za Zhi. 2003;11:695-696. [PubMed] |
| 11. | Aihara T, Noguchi S, Miyoshi Y, Nakano H, Sasaki Y, Nakamura Y, Monden M, Imaoka S. Allelic imbalance of insulin-like growth factor II gene expression in cancerous and precancerous lesions of the liver. Hepatology. 1998;28:86-89. [PubMed] [DOI] |
| 12. | Huynh H, Chow PK, Ooi LL, Soo KC. A possible role for insulin-like growth factor-binding protein-3 autocrine/paracrine loops in controlling hepatocellular carcinoma cell proliferation. Cell Growth Differ. 2002;13:115-122. [PubMed] |
| 13. | Kang-Park S, Lee JH, Shin JH, Lee YI. Activation of the IGF-II gene by HBV-X protein requires PKC and p44/p42 map kinase signalings. Biochem Biophys Res Commun. 2001;283:303-307. [PubMed] [DOI] |
| 14. | Zhang N, Siegel K, Odenthal M, Becker R, Oesch F, Dienes HP, Schirmacher P, Steinberg P. The role of insulin-like growth factor II in the malignant transformation of rat liver oval cells. Hepatology. 1997;25:900-905. [PubMed] [DOI] |
| 15. | Lee S, Park U, Lee YI. Hepatitis C virus core protein transactivates insulin-like growth factor II gene transcription through acting concurrently on Egr1 and Sp1 sites. Virology. 2001;283:167-177. [PubMed] [DOI] |
| 16. | Fiorentino M, Grigioni WF, Baccarini P, D'Errico A, De Mitri MS, Pisi E, Mancini AM. Different in situ expression of insulin-like growth factor type II in hepatocellular carcinoma. An in situ hybridization and immunohistochemical study. Diagn Mol Pathol. 1994;3:59-65. [PubMed] [DOI] |
| 17. | Zhang J, Chan EK. Autoantibodies to IGF-II mRNA binding protein p62 and overexpression of p62 in human hepatocellular carcinoma. Autoimmun Rev. 2002;1:146-153. [PubMed] [DOI] |
| 18. | Seo JH, Kim KW, Murakami S, Park BC. Lack of colocalization of HBxAg and insulin like growth factor II in the livers of patients with chronic hepatitis B, cirrhosis and hepatocellular carcinoma. J Korean Med Sci. 1997;12:523-531. [PubMed] [DOI] |
| 19. | Sedlaczek N, Hasilik A, Neuhaus P, Schuppan D, Herbst H. Focal overexpression of insulin-like growth factor 2 by hepatocytes and cholangiocytes in viral liver cirrhosis. Br J Cancer. 2003;88:733-739. [PubMed] [DOI] |
| 20. | Kang-Park S, Lee YI, Lee YI. PTEN modulates insulin-like growth factor II (IGF-II)-mediated signaling; the protein phosphatase activity of PTEN downregulates IGF-II expression in hepatoma cells. FEBS Lett. 2003;545:203-208. [PubMed] [DOI] |
| 21. | Lee YM, Bae MH, Lee OH, Moon EJ, Moon CK, Kim WH, Kim KW. Synergistic induction of in vivo angiogenesis by the combination of insulin-like growth factor-II and epidermal growth factor. Oncol Rep. 2004;12:843-848. [PubMed] [DOI] |
| 22. | He Z, Opland DM, Way KJ, Ueki K, Bodyak N, Kang PM, Izumo S, Kulkarni RN, Wang B, Liao R. Regulation of vascular endothelial growth factor expression and vascularization in the myocardium by insulin receptor and PI3K/Akt pathways in insulin resistance and ischemia. Arterioscler Thromb Vasc Biol. 2006;26:787-793. [PubMed] [DOI] |
| 23. | Elsammak MY, Amin GM, Khalil GM, Ragab WS, Abaza MM. Possible contribution of serum activin A and IGF-1 in the development of hepatocellular carcinoma in Egyptian patients suffering from combined hepatitis C virus infection and hepatic schistosomiasis. Clin Biochem. 2006;39:623-629. [PubMed] [DOI] |