修回日期: 2005-12-01
接受日期: 2005-12-08
在线出版日期: 2006-01-28
目的: 探讨肿瘤坏死因子相关凋亡诱导配体受体DR4在大肠癌组织中的表达情况及其与临床病理的关系.
方法: 采用免疫组化SP法和流式细胞分析方法对41例大肠癌组织和9例正常组织DR4的表达情况进行检测并比较.
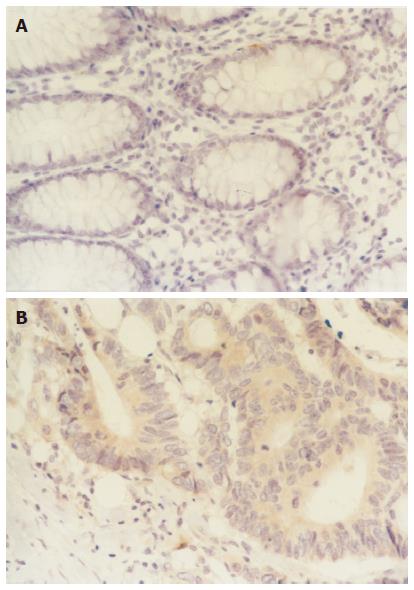
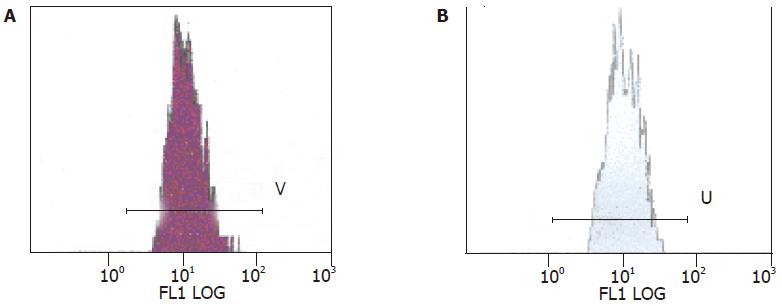
结果: DR4蛋白免疫组化染色定位于细胞膜和细胞浆, 癌组织中阳性表达率为65.85%, 明显高于正常组织的22.20%(P<0.05). 流式细胞分析该蛋白表达量, 癌组织平均荧光指数为1.17±0.13, 亦明显高于正常组织的1.00±0.13(P<0.05). 不同分化程度的癌组织中DR4蛋白表达无统计学差异, 临床有淋巴结转移的癌组织与无淋巴结转移的癌组织DR4表达无统计学差异.
结论: 大肠癌组织中DR4表达上调, 与组织分化程度无关.
引文著录: 闫庆辉, 张国建, 任鹏涛, 赵晶, 王凤安. 肿瘤坏死因子相关凋亡诱导配体受体DR4在大肠癌的表达及意义. 世界华人消化杂志 2006; 14(3): 332-335
Revised: December 1, 2005
Accepted: December 8, 2005
Published online: January 28, 2006
AIM: To explore the expression of TNF-related apoptosis-inducing ligand (TRAIL) receptor DR4 in large intestinal carcinoma and its correlation with clinical pathological characteristics.
METHODS: SP immunohistochemical technique and flow cytometry were used to detect the expression of DR4 in 41 cases of large intestinal carcinoma and 9 cases of normal tissues.
RESULTS: The positive cell membrane and cytoplasmic expression were observed in large intestinal carcinoma and normal large intestine mucosal tissues. Of large intestinal carcinoma, DR4 was positively expressed in 65.85%. However, the positive rate of DR4 in the normal tissues was 22.20%, which was significant lower than that in the cancer tissues (P <0.05). The fluorescence index (FI) of DR4 protein in the normal mucosal tissues was 1.00±0.13, while that in the cancer tissues was 1.17±0.13. There was significant difference between them (P <0.05). DR4 expression in the cancer tissues was not correlated with the degree of differentiation and lymph node metastasis.
CONCLUSION: The expression of DR4 increases in large intestinal cancer tissue, but it is not correlated with differentiation.
- Citation: Yan QH, Zhang GJ, Ren PT, Zhao J, Wang FA. Expression and significance of TNF-related apoptosis-inducing ligand receptor DR4 in large intestine carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(3): 332-335
- URL: https://www.wjgnet.com/1009-3079/full/v14/i3/332.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i3.332
肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand, TRAIL)是肿瘤坏死因子(tumor necrosis factor, TNF)超家族成员之一, 它通过与死亡受体4(death receptor 4, DR4)结合, 诱导肿瘤细胞发生凋亡而对正常细胞却无杀伤作用, 这一特点使TRAIL及其死亡受体DR4在肿瘤治疗中的作用备受关注[1-3]. 国内外学者用细胞培养和免疫组化方法研究发现, 结肠癌中DR4表达明显高于结肠腺瘤和正常结肠黏膜[4-7], 并且随着DR4表达的上调, 细胞的凋亡增加. 但不同分化程度的大肠腺癌中DR4表达有无不同以及其与临床病理有无关系尚未见报道. 我们期望通过对这些进行研究以更好的了解大肠癌的生物学特点, 从而推动大肠癌的治疗.
41例大肠癌患者, 均经病理诊断确诊. 其中男24例, 女17例; 年龄40-68岁, 平均51.25±0.13岁. 取其大肠癌组织标本, 同时取9例距癌5-10 cm组织, 经病理证实为正常组织的标本作为对照. 按照2000年WHO新的大肠肿瘤组织学分级标准分类[8], 高分化腺癌(I级)10例, 中分化腺癌(II级)15例, 低分化腺癌(III级)16例.
1.2.1 免疫组化染色: DR4单克隆抗体购自美国Santa Cruz公司, 免疫组化试剂盒购自北京中杉金桥生物技术有限公司, 操作步骤严格按照说明书进行. 用磷酸盐缓冲液(PBS)代替一抗做阴性对照. 以胞质和胞膜呈棕黄色或黄色为阳性表达. 染色结果判定标准: 光镜下观察按着色范围并结合着色强度进行分级. 着色范围以阳性细胞百分率判定: 未着色为0分; 着色25%以下为1分; 着色25%-50%为2分; 着色50%以上为3分. 着色强度判定: 无着色为0分; 浅着色为1分; 棕色为2分; 深棕色为3分. 上述两项相加为分级标准. 阴性(-): <3分; 阳性(+): ≥3分.
1.2.2 流式细胞分析: 采用美国Beckman Coulter公司生产的Epics-XLII型流式细胞仪, 激发光源为150 mW氩离子激光器, 激发波长为488 nm, 应用Expo32ADC进行免疫荧光数据分析. 检测前以flow-checkTMFluorpheres(10 mm)荧光微球(REF6605359.Beckman Coulter, Inc.Fullerton, CA92835)作为标准样品调整仪器CV值在2%以内. 参照仪器使用说明, 以荧光指数(FI)表示蛋白表达的相对含量.
统计学处理 实验数据采用χ2检验及t检验进行处理.
DR4蛋白定位表达于上皮细胞胞质和胞膜, 正常大肠黏膜组织中阳性表达2例, 阳性表达率为22.2%; 癌组织阳性表达27例, 阳性表达率65.85%; 两组比较有显著性差异(χ2 = 5.59, P<0.05)(图1). 流式细胞分析(FCM)该蛋白表达量, 正常大肠黏膜平均荧光指数为1.00±0.13, 癌组织平均荧光指数为1.17±0.13. 两组比较有显著性差异(t = 3.13, P = 0.007)(图2).
DR4蛋白在高分化腺癌组织中阳性表达率70.0%(7/10); 在中分化腺癌组织中阳性表达率73.3%(11/15); 在低分化腺癌组织中阳性表达率56.3%(9/16). 在腺癌组织中, DR4蛋白的表达与腺癌的组织学分化程度没有统计学差异(χ2 = 1.08). 临床有淋巴结转移的患者阳性表达率63.64%(14/22); 无淋巴结转移的患者阳性表达率68.42%(13/19), 两者之间没有统计学差异(χ2 = 0.11). DR4蛋白表达与年龄、性别之间, 均未发现有显著相关性.
TRAIL与DR4蛋白表达量进行直线相关分析, r = 0.33, P>0.05, 二者无直线相关关系.
TRAIL诱导细胞凋亡机制目前认为是其与死亡受体DR4、DR5结合, 诱导细胞凋亡. DR4又称TRAIL受体1(TRAIL-R1)[1,2]; 是有468个氨基酸的Ⅰ型膜蛋白. 在细胞外区域, 它有两个富含半胱氨酸的假重复序列(pseudorepeats), 胞质内区域的死亡区(death domain)与TNF-R1, DR3和Fas等的死亡区呈高度同源性. DR4与TRAIL特异结合后形成"受体三聚化", 通过死亡结构域激发和传导凋亡信号, 激活caspase蛋白酶级联反应, 导致细胞死亡, 故又称为死亡受体.
研究发现DR4通过多种信号传导途径诱导细胞凋亡[9-14], 但无论凋亡信号在细胞内如何传递, TRAIL要发挥诱导细胞凋亡的作用必须首先与其受体结合. 因此, 细胞表面TRAIL受体表达水平及功能对TRAIL介导的细胞凋亡至关重要. 然而并不是所有的人结肠癌细胞株都对TRAIL敏感, 无功能DR4的表达可能是细胞对TRAIL介导凋亡耐受的原因之一, 通过使DR4表达上调或功能增加可增加其对TRAIL的敏感性[10,15,16]. 但也有学者[3,5,7,15]研究发现, 与正常大肠黏膜相比, TRAIL表达下调, DR4表达上调, 因此作者认为TRAIL诱导的细胞凋亡和DR4的表达并无直接关系. 我们以往的研究证明大肠癌组织中TRAIL的表达明显低于正常大肠黏膜, 并且随着组织分化程度的下降呈逐步下降趋势[15]. 我们通过免疫组化和流式细胞分析两种方法从定位和定量两方面证明了DR4在癌组织中的表达明显高于正常黏膜, 这些结果和国外研究结果是一致的. 我们结果还发现不同分化程度的大肠癌组织的DR4的表达无统计学差异, 淋巴结转移与否的癌组织DR4的表达也无统计学差异, 因此DR4 不能作为影响大肠癌预后因素的指标.
对大肠癌中TRAIL和DR4蛋白的表达情况做直线相关分析, 结果表明二者无直线相关关系. 因此决定TRAIL和DR4抗体对大肠癌组织敏感性的因素是复杂的. 有研究认为决定TRAIL治疗的敏感性与死亡受体的表达水平并不一致, 甚至有些细胞对DR4会产生耐受[16,17], DR4过度表达可不依赖配体, 并直接诱导细胞的凋亡. 本实验得出结果: 癌组织TRAIL表达下调, 而死亡受体DR4表达上调, 二者的表达并无直接关系, 二者表达的差异机制有待进一步探讨.
总之, 这些结果说明TRAIL受体DR4分布的差异以及该受体在大肠癌肿瘤细胞凋亡过程中的可能作用, 同时说明除受体调控模式外, 还可能有其他的细胞内和/或细胞外因素参与. 这些为我们进一步探讨大肠癌的分子生物学异常提供了依据.
肿瘤坏死因子相关凋亡诱导配体(TRAIL)是肿瘤坏死因子(TNF)超家族成员之一, 它通过与死亡受体4(DR4)结合, 诱导肿瘤细胞发生凋亡而对正常细胞却无杀伤作用, 这一特点使TRAIL及其死亡受体DR4在肿瘤治疗中的作用备受关注.
DR4受体与癌组织的组织学分级和淋巴结转移与否均没有统计学差异, 因此DR4不能作为影响大肠癌预后判断的指标.
本文结果表明TRAIL受体DR4在不同大肠组织中表达是不同的, TRAIL和DR4诱导大肠癌细胞凋亡的机制是复杂的, 这些为我们进一步探讨大肠癌的分子生物学异常提供了依据.
死亡受体4(DR4): DR4与TRAIL特异结合后形成"受体三聚化", 通过死亡结构域激发和传导凋亡信号, 激活caspase蛋白酶级联反应, 导致细胞死亡, 故又称为死亡受体.
编辑: 菅鑫妍 审读: 张海宁 电编: 张勇
| 1. | Sheikh MS, Huang Y. Death receptors as targets of cancer therapeutics. Curr Cancer Drug Targets. 2004;4:97-104. [PubMed] |
| 2. | Yagita H, Takeda K, Hayakawa Y, Smyth MJ, Okumura K. TRAIL and its receptors as targets for cancer therapy. Cancer Sci. 2004;95:777-783. [PubMed] |
| 3. | Hague A, Hicks DJ, Hasan F, Smartt H, Cohen GM, Paraskeva C, MacFarlane M. Increased sensitivity to TRAIL-induced apoptosis occurs during the adenoma to carcinoma transition of colorectal carcinogenesis. Br J Cancer. 2005;92:736-742. [PubMed] |
| 4. | Jin Z, McDonald ER 3rd, Dicker DT, El-Deiry WS. Deficient tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) death receptor transport to the cell surface in human colon cancer cells selected for resistance to TRAIL-induced apoptosis. J Biol Chem. 2004;279:35829-35839. [PubMed] |
| 5. | Koornstra JJ, Jalving M, Rijcken FE, Westra J, Zwart N, Hollema H, de Vries EG, Hofstra RW, Plukker JT, de Jong S. Expression of tumour necrosis factor-related apoptosis-inducing ligand death receptors in sporadic and hereditary colorectal tumours: potential targets for apoptosis induction. Eur J Cancer. 2005;41:1195-1202. [PubMed] |
| 6. | Strater J, Hinz U, Walczak H, Mechtersheimer G, Koretz K, Herfarth C, Moller P, Lehnert T. Expression of TRAIL and TRAIL receptors in colon carcinoma: TRAIL-R1 is an independent prognostic parameter. Clin Cancer Res. 2002;8:3734-3740. [PubMed] |
| 7. | Koornstra JJ, Kleibeuker JH, van Geelen CM, Rijcken FE, Hollema H, de Vries EG, de Jong S. Expression of TRAIL (TNF-related apoptosis-inducing ligand) and its receptors in normal colonic mucosa, adenomas, and carcinomas. J Pathol. 2003;200:327-35. [PubMed] |
| 9. | Delmas D, Rebe C, Micheau O, Athias A, Gambert P, Grazide S, Laurent G, Latruffe N, Solary E. Redistribution of CD95, DR4 and DR5 in rafts accounts for the synergistic toxicity of resveratrol and death receptor ligands in colon carcinoma cells. Oncogene. 2004;23:8979-8986. [PubMed] |
| 10. | Drosopoulos KG, Roberts ML, Cermak L, Sasazuki T, Shirasawa S, Andera L, Pintzas A. Transformation by oncogenic RAS sensitizes human colon cells to TRAIL-induced apoptosis by up-regulating death receptor 4 and death receptor 5 through a MEK-dependent pathway. J Biol Chem. 2005;280:22856-22867. [PubMed] |
| 11. | Ren YG, Wagner KW, Knee DA, Aza-Blanc P, Nasoff M, Deveraux QL. Differential regulation of the TRAIL death receptors DR4 and DR5 by the signal recognition particle. Mol Biol Cell. 2004;15:5064-5074. [PubMed] |
| 12. | Koornstra JJ, RijckenFE , Oldenhuis CN, Zwart N, van der Sluis T, Hollema H, deVries EG, Keller JJ, Offerhaus JA, Giardiello FM. Sulindac inhibits beta-catenin expression in normal-appearing colon of hereditary nonpolyposis colorectal cancer and familial adenomatous polyposis patients. Cancer Epidemiol Biomarkers Prev. 2005;14:1608-1612. [PubMed] |
| 13. | Bremer E, Samplonius DF, van Genne L, Dijkstra MH, Kroesen BJ, de Leij LF, Helfrich W. Simultaneous inhibition of epidermal growth factor receptor (EGFR) signaling and enhanced activation of tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) receptor-mediated apoptosis induction by an scFv: sTRAIL fusion protein with specificity for human EGFR. J Biol Chem. 2005;280:10025-10033. [PubMed] |
| 16. | Van Geelen CM, de Vries EG, de Jong S. Lessons from TRAIL-resistance mechanisms in colorectal cancer cells: paving the road to patient-tailored therapy. Drug Resist Updat. 2004;7:345-358. [PubMed] |
| 17. | Zhang L, Fang B. Mechanisms of resistance to TRAIL-induced apoptosis in cancer. Cancer Gene Ther. 2005;12:228-237. [PubMed] |