修回日期: 2005-11-21
接受日期: 2005-11-24
在线出版日期: 2006-01-28
目的: 探求大肠癌患者早期诊断的外周血分子标记物, 为大肠癌临床筛查提供早期、可靠、简便易行的有效方法.
方法: 采用RT-PCR检测28例大肠癌、8例腺瘤中重度不典型增生、18例腺瘤轻度不典型增生、11例炎性息肉患者和10例正常对照者的外周血中CK-20, GST-π, hTERT, survivin及skp2的mRNA表达情况.
结果: 大肠癌、腺瘤中重度不典型增生、腺瘤轻度不典型增生、炎性息肉组和正常对照组hTERT mRNA表达的阳性率分别为82.1%(23/28)、87.5%(7/8)、27.8%(5/11)、9.1%(1/11)、10%(1/10), 大肠癌组及腺瘤中重度不典型增生组与其他各组之间差别显著(P<0.05); survivin mRNA在大肠癌、腺瘤中重度不典型增生组、腺瘤轻度不典型增生组的阳性率分别是64.2%(18/28)、50%(4/8)、11.1%(2/18), 炎性息肉组及正常组未见表达, 大肠癌组与腺瘤中重度不典型增生组无差别, 与腺瘤轻度不典型增生组、炎性息肉及正常组之间差别显著(P<0.05); 而CK-20, GST-π, skp2 mRNA在各组之间表达无统计学意义(均P>0.05).
结论: RT-PCR检测大肠癌患者外周血hTERT, survivin mRNA的表达对大肠癌的早期诊断有意义, 可望成为早期诊断的分子标记物.
引文著录: 杜雅菊, 刘晓珺, 金英敏, 曲波, 李宝杰. RT-PCR 寻找大肠癌患者外周血早期分子标记物的研究. 世界华人消化杂志 2006; 14(3): 280-286
Revised: November 21, 2005
Accepted: November 24, 2005
Published online: January 28, 2006
AIM: To search for molecular tumor markers in the peripheral blood from patient with early stage of large intestinal carcinoma, and to offer early, reliable and simple methods for the early diagnosis of large intestinal carcinoma.
METHODS: The expression of CK-20, GST-π, hTERT, survivin and skp2 mRNA were detected by reverse transcription polymerase chain reaction (RT-PCR) in the peripheral blood from patients with large intestinal carcinoma (n = 28), adenoma accompanied by moderate and severe atypical hyperplasia (n = 8), adenoma accompanied by light atypical hyperplasia (n = 18), and inflammatory polypus (n = 11) as well as normal controls (n = 10).
RESULTS: The positive rate of hTERT mRNA expression was 82.1%(23/28), 87.5%(7/8), 27.8%(5/11), 9.1%(1/11), and 10%(1/10) in large intestinal carcinoma, adenoma accompanied by moderate and severe atypical hyperplasia, adenoma accompanied by light atypical hyperplasia, inflammatory polypus and normal controls, respectively, and there existed significant differences between the former two and the latter three (P < 0.05). The positive rate of survivin mRNA expression was 64.2%(18/28), 50%(4/8), and 11.1%(2/18) in large intestinal carcinoma, adenoma accompanied by moderate and severe atypical hyperplasia, and adenoma accompanied by light atypical hyperplasia, respectively, and there was no significant difference between the former two, while there existed marked differences between and former two and the latter (P < 0.05). The expression of survivin mRNA was not found in inflammatory polypus and normal controls. There were no significant differences between all the groups in the expression of CK-20, GST-π, and skp2 mRNA (all P > 0.05).
CONCLUSION: It is meaningful to detect the expression of hTERT and survivin mRNA in peripheral blood using RT-PCR technique for early diagnosis of large intestinal carcinoma, and hTERT and survivin may be the molecular tumor markers for early diagnosis.
- Citation: Du YJ, Liu XJ, Jin YM, Qu B, Li BJ. Investigation of molecular tumor markers in peripheral blood for early diagnosis of large intestinal carcinoma patients using RT-PCR technique. Shijie Huaren Xiaohua Zazhi 2006; 14(3): 280-286
- URL: https://www.wjgnet.com/1009-3079/full/v14/i3/280.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i3.280
大肠癌是人类最为主要的恶性肿瘤之一, 其发病率呈逐年上升趋势. 早期大肠癌预后较好, 然而早期大肠癌往往无症状或症状不明显, 易被忽视. 因此, 在无症状人群中筛检大肠癌, 达到早发现、早诊断、早治疗, 是大肠癌重要防治策略之一. 有学者[1]提出, 在患者外周血中寻找分子标记物可能成为易被接受的大肠癌早期检测手段. 我们应用RT-PCR的方法, 检测大肠癌患者外周血中CK-20, GST-π, hTERT, survivin及skp2的mRNA表达, 以探求大肠癌患者外周血的早期分子标记物.
收集2004/2005哈尔滨医科大学附属二院腔镜中心大肠黏膜活检诊断为: 大肠癌28例(男20例, 女8例, 平均年龄58.6岁)、腺瘤中重度不典型增生8例(男5例, 女3例, 平均年龄59岁, 重度不典型增生3例)、腺瘤轻度不典型增生18例(男13例, 女5例, 平均年龄56.7岁)、炎性息肉11例(平均年龄39.7岁)、正常黏膜10例(平均年龄32岁, 4例健康志愿者, 6例为肠易激综合征患者), 患者的血样5 mL, 抗凝, 用淋巴细胞分离液分离单核细胞, 提取总RNA, -70℃保存. 淋巴细胞分离液为天津市川页生化制品有限公司产品; TRIZOL®Reagent购于Gibco BRL公司; 三氯甲烷、异丙醇分别由北京化工厂和天津市¿通化学试剂公司提供; dNTP, DNA Marker购自宝生物工程有限公司; M-MLV Reverse Transcriptase, Tag DNA聚合酶为Pramega产品; 引物由上海生工合成. 仪器包括冰冻高速离心机, PTC-100热循环仪, GE-100电泳仪, 全自动凝胶成像系统, 紫外分光光度计等.
1.2.1 病理分型: 腺瘤分级采用Morson提出的3级分类法即凡腺瘤均有不典型增生, 在此基础上再分为轻、中、重3级. 轻度不典型增生(Ⅰ级)以细胞学的异型性为主, 腺管内杯状细胞减少, 核呈笔杆状, 紧挤, 复层排列, 但高度不超过细胞的1/2, 腺管稍延长; 中度不典型增生(Ⅱ级)表现为细胞异型加重并出现组织学异型性, 胞核复层, 占据上皮细胞的2/3, 细胞顶端仍存在, 腺管延长并扭曲, 大小不一, 部分可见共壁及背靠背现象; 重度不典型增生(Ⅲ级)表现为两种异型均较显著, 胞核复层, 占据整个上皮细胞的胞质, 杯状细胞罕见或消失, 上皮细胞极性紊乱, 腺管延长、扭曲、大小不一, 腺管共壁及背靠背多见, 有的并出现筛状结构. 炎性息肉病理特点为肉芽组织形成或有炎性细胞浸润, 表面是正常上皮或再生上皮, 细胞分化良好, 无不典型增生.
1.2.2 总RNA提取: 在经淋巴细胞分离液分离所得的单核细胞中, 加入1 mL TRIZOL试剂, 按说明书提取总RNA. 10 g/L琼脂糖凝胶电泳显示28 s和18 s亚基; 紫外分光光度计测定总RNA含量及纯度, A260/A280比值为1.8-2.0, 说明提取RNA质量较好.
1.2.3 cDNA合成: 反应体系: 5×Buffer 5 mL, dNTP(2.5 mmol/L) 5 mL, OligodT(10 pmol/L) 1 mL, M-MLV 1 mL, 总RNA 2 mg, DEPC水补足总体系25 mL; 反应参数: 42℃ 1 h, 70℃ 15 min.
1.2.4 PCR扩增: 参照文献[2-6]设计引物, 并在GenBank上进行核对, 设置β-actin为阳性参照, 同时设H2O为阴性对照(表1). CK20第1轮PCR、GST-p、survivin反应体系: 10×Buffer 2.5 mL, dNTP(2.5 mmol/L)2 mL, MgCl2(25 mmol/L) 2 mL, 上、下游引物(10 pmol/L)各1 mL, Tag DNA聚合酶0.5 mL, cDNA 2 mL, 水补足体系至25 mL; 反应条件: 95℃预变性5 min, 94℃ 45 s, 58℃ 45 s, 72℃ 60 s, 32个循环, 72℃ 7 min. 取CK20第1轮PCR产物2 mL进行第2轮反应, 体系及条件同上. hTERT反应体系: 10×Buffer 2.5 mL, dNTP(2.5 mmol/L)2 mL, MgCl2(25 mmol/L)1.8 mL, 上、下游引物(10 pmol/L)各0.75 mL, Tag DNA聚合酶0.4 mL, cDNA 2 mL, 水补足体系至25 mL; 反应条件: 95℃预变性5 min, 94℃ 45 s, 60℃ 45 s, 72℃ 60 s, 32个循环, 72℃ 7 min. skp2、β-actin反应体系: 10×Buffer 2.5 mL, dNTP(2.5 mmol/L) 2 mL, MgCl2(25 mmol/L)2 mL, 上、下游引物(10 pmol/L)各1 mL, Tag DNA聚合酶0.5 mL, cDNA 2 mL, 水补足体系至25 mL; 反应条件: 95℃预变性5 min, 94℃ 1 min, 55℃ 1 min, 72℃ 2 min, 35个循环, 72℃ 10 min. 产物于20 g/L琼脂糖凝胶电泳, 溴化乙锭染色(10 mg/L)后, 通过凝胶成像系统对目的电泳条带进行分析.
| 基因 | 引物序列 | 扩增片断长度(bp) |
| CK20 | A:5'-CAGACACACGGTGAACTATGG-3' | 370 |
| B:5'-GATCAGCTTCCACTGTTAGACG-3' | ||
| C:5'-CTGTTTGTTGGCAATGAGAAAATGG-3' | 303 | |
| D:5'-GTATTCCTCTCTCAGTCTCATACT-3' | ||
| GST-π | F:5'-CAGGAGGGCTCACTCAAAG-3' | 354 |
| R:5'-CAGGTTGTAGTCAGCGAAG-3' | ||
| hTERT | F:5'-TTCCTGCACTGGCTGATGAGTGT-3' | 329 |
| R:5'-CGCTCGGCCCTCTTTTCTCTG-3' | ||
| survivin | F:5'-GGACCACCGCATCTCTACAT-3' | 350 |
| R:5'-GCACTTTCTTCGCAGTTTCC-3' | ||
| skp2 | F:5'-AGTCTCTATGGCAGACCTTAGACC-3' | 500 |
| R:5'-TTTCTGGAGATTCTTTCTGTAGCC-3' | ||
| β-actin | F:5'-CGAGAAGATGACCCAGATCA-3' | 240 |
| R:5'-AGGGGCCGGACTCGTCATAC-3' |
统计学处理 所有数据采用SPSS 10.0软件处理, 采用χ2检验.
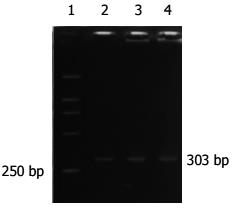
大肠癌组阳性率为89.3%(25/28), 腺瘤中重度不典型增生组阳性率75%(6/8), 腺瘤轻度不典型增生组阳性率为61.1%(11/18), 炎性息肉阳性率为63.6%(7/11), 正常组2例表达(P>0.05)(表2, 图1, 2).
| 分组 | n | CK20 | GST-π | hTERT | survivin | skp2 | |||||
| 阳性数 | 阳性率(%) | 阳性数 | 阳性率(%) | 阳性数 | 阳性率(%) | 阳性数 | 阳性率(%) | 阳性数 | 阳性率(%) | ||
| 大肠癌 | 28 | 25 | 89.3 | 21 | 75 | 23 | 82.1 | 18 | 64.2 | 15 | 53.6 |
| 腺瘤中重度不典型增生 | 8 | 6 | 75 | 5 | 62.5 | 7 | 87.5 | 4 | 50 | 3 | 37.5 |
| 腺瘤轻度不典型增生 | 18 | 11 | 61.1 | 12 | 66.7 | 5 | 27.8 | 2 | 11.1 | 6 | 33.3 |
| 炎性息肉 | 11 | 7 | 63.6 | 6 | 54.5 | 1 | 9.1 | 0 | 0 | 3 | 27.3 |
| 正常 | 10 | 2 | 20 | 4 | 40 | 1 | 10 | 0 | 0 | 3 | 30 |
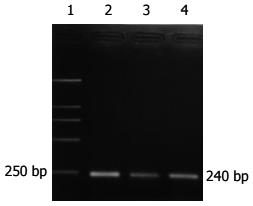
大肠癌组阳性率为75%(21/28), 腺瘤中重度不典型增生组阳性率是62.5%(5/8), 腺瘤轻度不典型增生组阳性率66.7%(12/18), 炎性息肉组54.5%阳性, 正常组40%表达(P>0.05)(表2, 图3).
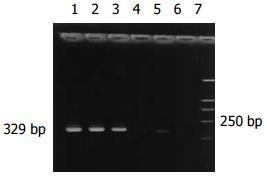
28例大肠癌患者有23例外周血hTERT mRNA表达, 阳性率为82.1%; 腺瘤中重度不典型增生组阳性率为87.5%(7/8); 腺瘤轻度不典型增生组和炎性息肉组阳性表达率分别是27.8%、9.1%; 正常组有1例表达. 大肠癌组及腺瘤中重度不典型增生组与其他各组之间差别显著(P<0.005)(表2, 图4).
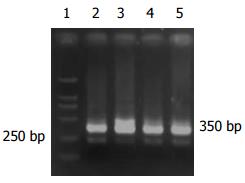
大肠癌组阳性率是64.2%(18/28); 腺瘤中重度不典型增生组有4例表达survivin mRNA, 阳性率50%; 腺瘤轻度不典型增生组阳性表达率为11.1%, 炎性息肉组及正常组未见表达, 经统计学分析大肠癌组与腺瘤中重度不典型增生组无差别, 与腺瘤轻度不典型增生、炎性息肉及正常组之间有差别(表2, 图5).
大肠癌的发生、发展是一个多步骤、多阶段演进的复杂过程. 国内外学者[1,7,8]证实在这个过程中伴随着外周血的某些基因表达的变化, 并认为在大肠癌形成过程中这可能是一个早期事件, 对大肠癌的早期诊断有重要意义. 应用RT-PCR可扩增出肿瘤细胞"标志性"靶RNA. 因此, 选择适当的靶RNA是决定检测结果是否准确可靠的重要因素. 作为肿瘤细胞"标志"的靶RNA应具有肿瘤特异性或组织特异性.
细胞角蛋白(cytokeratins, CKs)是分布于上皮细胞的中间纤维, 包含多个成员, CK20 mRNA作为一种组织特异性基因, 首先被Soeth et al[9]用于检测大肠癌患者骨髓的癌细胞, 且证明具有高度特异性. Funaki et al[10]以CK20 mRNA为靶基因检测外周血中的大肠癌细胞, 认为有较高的灵敏度. Zhang et al[11,12]通过RT-PCR测定了58例大肠癌和47例胃癌患者外周血, 结果单次实验CK20 mRNA阳性率分别为44.8%(26/58)和42.6%(20/47), 重复实验阳性率提高到69.0%和74.5%, 而6例正常人外周血未见表达, 认为用RT-PCR检测外周血胃肠道肿瘤细胞CK20 mRNA表达是敏感的、特异的、方便和可靠的, 具有重要的临床意义. 然而, 我们的实验结果是大肠癌患者外周血CK20 mRNA阳性率为89.3%(25/28), 腺瘤中重度不典型增生阳性率75%(6/8), 腺瘤轻度不典型增生组和炎性息肉组阳性率为61.1%和63.6%, 正常组有2例表达, 并且排除了实验本身问题的干扰. 大肠癌组CK20 mRNA表达与腺瘤中重度不典型增生、腺瘤轻度不典型增生及炎性息肉组之间没有明显差别, 与正常组间有差别. 我们认为CK20作为大肠癌分子标记物的证据不够充分, 但对大肠癌及增生性疾病的监测尚有一定意义. Bustin et al[13]检出健康志愿者, 肠道良性疾病患者和大肠癌患者术前及术后外周血CK20 mRNA全部阳性表达, 因此, 得出CK20作为大肠癌患者监测的分子标记是无意义的, 也不足以成为肠组织特异性指标物的结论. Schuster et al[14]也提出还不能满意区分CK20 mRNA标记信号是来自于肿瘤细胞还是发自血液系统那些非正常转录的造血细胞, 那些被分析的循环肿瘤细胞标记物的单一拷贝数是不足以检测到的, 或更大可能末梢血是不适合检测结肠癌肿瘤细胞的.
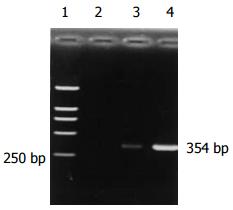
谷胱甘肽-S-转移酶(glutathione-S-transferase, GST)是机体中催化谷胱甘肽(glutathione, GSH)与亲电子物质结合的一类酶系, GST-π被认为与肿瘤关系最密切. 研究显示[15]伴有不典型增生的大肠腺瘤及大肠癌组织中GST-π表达明显高于腺瘤和息肉组, 说明随着肠腺上皮细胞的增生和异型性的明显, 组织内GST-π也逐渐升高, 认为GST-是一种较好的肠癌及癌前病变标志物. 有学者[16]发现GST-π蛋白表达在大肠正常黏膜、移行黏膜(transitional mucosa, TM)、癌组织有递增趋势, 可见GST-π对大肠癌早期诊断的意义. 一般认为GST-含量增高与转录水平mRNA表达增高有关, GST-受基因控制, 当致癌物作用于机体细胞引起细胞变异时, 同时诱导GST-π基因表达, 表明GST-π的表达在转录发生起始阶段就已决定, 故可作为早期癌变的标志酶[17]. 龙延滨 et al[18]用比色法对结肠癌患者外周血淋巴细胞内GST活性进行测定, 结果表明结肠癌患者外周血淋巴细胞内及癌组织内GST活性不仅较正常组织明显升高, 而且淋巴细胞内与癌组织内GST活性变化呈正相关. 我们用RT-PCR检测大肠癌患者外周血GST-π mRNA表达, 阳性率较其他各组高, 但没有明显差别. 可是, 我们发现正常组4例阳性表达的PCR产物条带强度较弱, 设想应用定量PCR是否有意义将有待进一步研究. 由于GST-π在体内广泛存在, 缺乏器官组织特异性, 也使在大肠癌诊断中的应用受到限制.
端粒酶(telomerase)是一种核糖核蛋白复合体, 由RNA单链和结合的蛋白成分共同构成, 能以其自身RNA为模板合成端粒的DNA重复序列, 本质属逆转录酶. 人端粒酶至少由3个亚单位组成, 即端粒酶RNA(hTR)、端粒酶相关蛋白(telomerase associated protein 1, TP1)和端粒酶催化活性亚单位(human telomerase reverse transcriptase, hTERT). 细胞永生化是肿瘤发生的基础, 引起肿瘤无限增殖的关键是端粒酶的上调和再表达, 而hTERT被认为是端粒酶活性的限制性因素[19-21]. 国内外研究表明, 端粒酶活力的出现与hTERT的表达有一个近乎平行的关系[22-25]. 近年实验显示, hTERT与消化道肿瘤关系密切, 并且在癌前病变、癌组织中的表达呈递增趋势, 因此, 推断hTERT的表达是消化道黏膜癌变过程中的早期事件[26-29]. Lledo et al[30]应用qRT-PCR(real-time quantitative RT-PCR)对50例大肠癌患者和50例健康志愿者外周血血浆hTERT基因表达进行定量分析, 结果差异显著. 此方法用于结直肠癌患者检测的敏感性和特异性分别是98%和64%. 这为结直肠癌的非侵入性诊断提供了新方法. Shin et al[31]用RT-PCR在胃癌患者外周血中检测hTERT mRNA表达, 同样认为外周血hTERT mRNA可以作为胃癌诊断的分子标记物. 本组研究显示, 大肠癌及腺瘤中重度不典型增生患者外周血hTERT mRNA的表达明显高于腺瘤轻度不典型增生、炎性息肉和正常组, 而两者之间没有差别. hTERT mRNA在腺瘤轻度不典型增生组中已有增高, 在腺瘤中重度不典型增生中明显高表达, 进一步证实这是大肠癌发生过程中的一个极早事件. 我们的结论是RT-PCR检测外周血hTERT mRNA表达对大肠癌早期诊断有意义. 我们知道, 在正常人造血细胞及淋巴细胞有一定量的hTERT mRNA表达, 因此, 作为大肠癌细胞分子标记物的证据还不够充分.
生存素(survivin)是新近发现的一种细胞凋亡抑制因子, 主要分布于胚胎及分化未成熟的组织中, 在成人体内除胸腺、生殖腺中有微量表达外, 所有分化成熟的组织, 包括外周血白细胞、淋巴结均无表达. 学者应用免疫组化和PCR检测常见肿瘤的survivin表达, 发现基本存在肿瘤特异性表达的特点, 在恶性肿瘤组织中survivin表达的阳性率为34%-100%不等[32,33]. survivin的表达在大肠癌的发生中有一定作用, 同时, 也与Ⅰ-Ⅲ期大肠癌患者的生存状态显著相关[34]. 我们观察了28例大肠癌患者, 有18例外周血表达survivin mRNA , 阳性率为64.2%; 腺瘤中重度不典型增生组有50%阳性; 腺瘤轻度不典型增生组阳性率是11.1%; 而炎性息肉组及正常组无survivin mRNA表达, 经统计学分析大肠癌组与腺瘤中重度不典型增生组无差别, 与腺瘤轻度不典型增生组、炎性息肉及正常组之间差别显著. Kawasaki et al[35]对直肠组织从增生到癌变不同时期标本的survivin表达情况进行研究, 结果发现增生息肉、低度增生不良性腺瘤、高度增生不良性腺瘤、腺癌的survivin表达阳性率分别为0, 2.3%, 52.4%, 63.3%. 可见, survivin在癌组织中的表达是一个渐进的过程, 随着肿瘤细胞恶性程度的增加, 其表达也逐渐升高, 说明survivin具有对肿瘤进行早期诊断的潜在价值. 董燕 et al[36]发现在人外周血活化淋巴细胞有survivin基因的转录激活. 那么, 本组实验大肠癌患者外周血高表达的survivin mRNA是来自于循环肿瘤细胞, 还是来自于肿瘤患者免疫机制启动后被活化的淋巴细胞, 需要进一步验证.
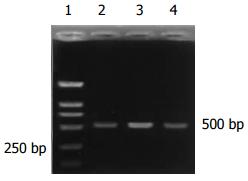
细胞S期激酶相关蛋白2(S-phase kinase associated protein 2, skp2)作为人类F-box蛋白家族的一员, 在许多细胞周期调控因子的泛素依赖蛋白水解途径中起到特异性识别底物的作用, 从而参与细胞周期的调控. 目前国内外许多研究都发现恶性肿瘤组织中skp2的表达呈不同程度增高, 且与肿瘤的发生、发展及预后密切相关[37,38], 有癌基因的潜能. 我们在前期工作中发现, 大肠癌组织中skp2蛋白及mRNA表达增高. 此次实验, 在大肠癌患者外周血中skp2 mRNA的表达增高不明显, 正常人外周血中亦有表达, 可能是维持正常细胞生物学功能所需.
在大肠癌患者外周血中寻找分子生物学标记物是一项困难而有实际意义的工作. 我们通过实验初步认为, 利用RT-PCR检测外周血hTERT和survivin mRNA的表达对大肠癌的早期诊断有意义. 但hTERT和survivin能否成为大肠癌早期诊断的分子生物学标记物将有待进一步研究.
早期大肠癌预后较好, 因此, 在无症状人群中筛检大肠癌患者, 是大肠癌重要防治策略之一. 有学者提出, 在患者外周血中寻找分子标记物可能成为易被接受的大肠癌早期检测手段. 本文应用RT-PCR的方法, 检测大肠癌患者外周血中CK-20, GST-π, hTERT, Survivin及Skp2的mRNA表达, 以探求大肠癌患者外周血的早期分子标记物.
本文应用RT-PCR的方法, 检测大肠癌患者外周血中CK-20, GST-π, hTERT, Survivin及Skp2的mRNA表达, 以探求大肠癌患者外周血的早期分子标记物.
编辑: 菅鑫妍 审读: 张海宁 电编: 张敏
| 1. | Solmi R, De Sanctis P, Zucchini C, Ugolini G, Rosati G, Del Governatore M, Coppola D, Yeatman TJ, Lenzi L, Caira A. Search for epithelial-specific mRNAs in peripheral blood of patients with colon cancer by RT-PCR. Int J Oncol. 2004;25:1049-1056. [PubMed] |
| 2. | Wyld DK, Selby P, Perren TJ, Jonas SK, Allen-Mersh TG, Wheeldon J, Burchill SA. Detection of colorectal cancer cells in peripheral blood by reverse-transcriptase polymerase chain reaction for cytokeratin 20. Int J Cancer. 1998;79:288-293. [PubMed] |
| 4. | Yan P, Saraga EP, Bouzourene H, Bosman FT, Benhattar J. Expression of telomerase genes correla-tes with telomerase activity in human colorectal carcinogenesis. J Pathol. 2001;193:21-26. [PubMed] |
| 5. | Sarela AI, Macadam RC, Farmery SM, Markham AF, Guillou PJ. Expression of the antiapoptosis gene, survivin, predicts death from recurrent color-ectal carcinoma. Gut. 2000;46:645-650. [PubMed] |
| 7. | Ahmed FE, Vos P. Molecular markers for human colon cancer in stool and blood identified by RT-PCR. Anticancer Res. 2004;24:4127-4134. [PubMed] |
| 8. | 卿 笃桔, 李 汉贤. 大肠癌患者外周血淋巴细胞P16和cyclin D1表达的临床意义. 南华大学学报·医学版. 2005;33:9-12. |
| 9. | Soeth E, Roder C, Juhl H, Kruger U, Kremer B, Kalthoff H. The detection of disseminated tumor cells in bone marrow from colorectal-cancer patients by a cytokeratin-20-specific nested reverse-transcriptase-polymerase-chain reaction is related to the stage of disease. Int J Cancer. 1996;69:278-282. [PubMed] |
| 10. | Funaki NO, Tanaka J, Itami A, Kasamatsu T, Ohshio G, Onodera H, Monden K, Okino T, Imamura M. Detection of colorectal carcinoma cells in circulating peripheral blood by reverse transcription-poly-merase chain reaction targeting cytokeratin-20 mRNA. Life Sci. 1997;60:643-652. [PubMed] |
| 11. | Zhang XW, Fan P, Yang HY, Yang L, Chen GY. Significance of detecting disseminated tumor cells in peripheral blood of gastric and colorectal cancer patients. Zhonghua Zhongliu Zazhi. 2003;25:66-69. [PubMed] |
| 12. | Zhang XW, Yang HY, Fan P, Yang L, Chen GY. Detection of micrometastasis in peripheral blood by multi-sampling in patients with colorectal cancer. World J Gastroenterol. 2005;11:436-438. [PubMed] |
| 13. | Bustin SA, Gyselman VG, Siddiqi S, Dorudi S. Cytokeratin 20 is not a tissue-specific marker for the detection of malignant epithelial cells in the blood of colorectal cancer patients. Int J Surg Investig. 2000;2:49-57. [PubMed] |
| 14. | Schuster R, Max N, Mann B, Heufelder K, Thilo F, Grone J, Rokos F, Buhr HJ, Thiel E, Keilholz U. Quantitative real-time RT-PCR for detection of disseminated tumor cells in peripheral blood of patients with colorectal cancer using different mRNA markers. Int J Cancer. 2004;108:219-227. [PubMed] |
| 15. | 张 海燕, 方 军, 高 宝辉, 谢 小志, 谢 丽微. 肠道肿瘤和增生性病变中GST-与p53蛋白表达的关系. 临床与实验病理学杂志. 2002;18:517-518. |
| 17. | Morrow CS, Goldsmith ME, Cowan KH. Regulation of human glutathione S-transferase pi gene transcription: influence of 5'-flanking sequences and trans-activating factors which recognize AP-1-binding sites. Gene. 1990;88:215-225. [PubMed] |
| 19. | Nakamura TM, Morin GB, Chapman KB, Weinrich SL, Andrews WH, Lingner J, Harley CB, Cech TR. Telomerase catalytic subunit homologs from fission yeast and human. Science. 1997;277:955-959. [PubMed] |
| 20. | Horikawa I, Barrett JC. Transcriptional regulation of the telomerase hTERT gene as a target for cellular and viral oncogenic mechanisms. Carcinogenesis. 2003;24:1167-1176. [PubMed] |
| 21. | Hahn WC, Meyerson M. Telomerase activation, cellular immortalization and cancer. Ann Med. 2001;33:123-129. [PubMed] |
| 22. | Colgin LM, Reddel RR. Telomere maintenance mechanisms and cellular immortalization. Curr Opin Genet Dev. 1999;9:97-103. [PubMed] |
| 24. | Niiyama H, Mizumoto K, Sato N, Nagai E, Mibu R, Fukui T, Kinoshita M, Tanaka M. Quantitative analysis of hTERT mRNA expression in colorectal cancer. Am J Gastroenterol. 2001;96:1895-1900. [PubMed] |
| 25. | Nowak J, Januszkiewicz D, Lewandowski K, Nowicka-Kujawska K, Pernak M, Rembowska J, Nowak T, Wysocki J. Activity and expression of human telomerase in normal and malignant cells in gastric and colon cancer patients. Eur J Gastroenterol Hepatol. 2003;15:75-80. [PubMed] |
| 26. | Suzuki K, Kashimura H, Ohkawa J, Itabashi M, Watanabe T, Sawahata T, Nakahara A, Muto H, Tanaka N. Expression of human telomerase catalytic subunit gene in cancerous and precancerous gastric conditions. J Gastroenterol Hepatol. 2000;15:744-751. [PubMed] |
| 28. | Yao XX, Yin L, Sun ZC. The expression of hTERT mRNA and cellular immunity in gastric cancer and precancerosis. World J Gastroenterol. 2002;8:586-590. [PubMed] |
| 30. | Lledo SM, Garcia-Granero E, Dasi F, Ripoli R, Garcia SA, Cervantes A, Alino SF. Real time quantification in plasma of human telomerase reverse transcriptase (hTERT) mRNA in patients with colorectal cancer. Colorectal Dis. 2004;6:236-242. [PubMed] |
| 31. | Shin JH, Chung J, Kim HO, Kim YH, Hur YM, Rhim JH, Chung HK, Park SC, Park JG, Yang HK. Detection of cancer cells in peripheral blood of stomach cancer patients using RT-PCR amplification of tumour-specific mRNAs. Aliment Pharmacol Ther. 2002;16:137-144. [PubMed] |
| 32. | Ito T, Shiraki K, Sugimoto K, Yamanaka T, Fujikawa K, Ito M, Takase K, Moriyama M, Kawano H, Hayashida M. Survivin promotes cell proliferation in human hepatocellular carcinoma. Hepatology. 2000;31:1080-1085. [PubMed] |
| 33. | Kato J, Kuwabara Y, Mitani M, Shinoda N, Sato A, Toyama T, Mitsui A, Nishiwaki T, Moriyama S, Kudo J. Expression of survivin in esophageal cancer: correlation with the prognosis and res-ponse to chemotherapy. Int J Cancer. 2001;95:92-95. [PubMed] |
| 34. | Sarela AI, Macadam RC, Farmery SM, Markham AF, Guillou PJ. Expression of the antiapoptosis gene, survivin, predicts death from recurrent colorectal carcinoma. Gut. 2000;46:645-650. [PubMed] |
| 35. | Kawasaki H, Toyoda M, Shinohara H, Okuda J, Watanabe I, Yamamoto T, Tanaka K, Tenjo T, Tanigawa N. Expression of survivin correlates with apoptosis, proliferation, and angiogenesis during human colorectal tumorigenesis. Cancer. 2001;91:2026-2032. [PubMed] |
| 36. | 董 燕, 梅 柱中, 宋 宜, 孙 国敬, 钱 俊杰, 刘 斌, 刘 华, 孙 志贤. 人外周血活化淋巴细胞survivin基因的转录激活和表达相关的信号转导通路研究. 生物化学与生物物理进展. 2004;31:924-929. |
| 37. | Shapira M, Ben-Izhak O, Linn S, Futerman B, Minkov I, Hershko DD. The prognostic impact of the ubiquitin ligase subunits Skp2 and Cks1 in colorectal carcinoma. Cancer. 2005;103:1336-1346. [PubMed] |
| 38. | Li JQ, Wu F, Masaki T, Kubo A, Fujita J, Dixon DA, Beauchamp RD, Ishida T, Kuriyama S, Imaida K. Correlation of Skp2 with carcinogenesis, invasion, metastasis, and prognosis in colorectal tumors. Int J Oncol. 2004;25:87-95. [PubMed] |