修回日期: 2005-09-21
接受日期: 2005-09-30
在线出版日期: 2006-01-28
目的: 探讨一氧化氮(NO)在急性重症胰腺炎急性肺损伤大鼠发病中的作用及肺泡巨噬细胞核因子-κB(NF-κB)活化的关系.
方法: 健康雄性SD大鼠随机分为: 假手术组、模型组、硝普钠(SNP)组、左旋精氨酸组、氨基胍组, 每组6只. 经胰管逆行注入去氧胆酸钠复制大鼠急性重症胰腺炎急性肺损伤模型. 采用凝胶电泳迁移率方法检测肺泡巨噬细胞中NF-κB活性, RT-PCR分析iNOS mRNA的表达, 同时亦检测NO、TNF-α、iNOS的水平和肺组织病理学的改变.
结果: 模型组中NF-κB活性、iNOS mRNA表达及TNF-α、NO、iNOS的含量均显著高于假手术组(P = 0.02). 肺组织病理学显示严重损害. NO的供体硝普钠及iNOS选择性抑制剂氨基胍可降低NF-κB活性(213.47±12.34, 222.98±17.69 vs 327.13±13.46, P<0.05), 下调iNOS mRNA表达(SNP: 2.35±0.34 vs 3.1±0.38, P<0.05)以及TNF-α(0.38±0.034, 0.45±0.043 mg/L vs 0.76±0.045 mg/L)、NO(168.2±0.78, 146.4±0.59 mmol/L vs 229.3±0.98 mmol/L)的水平, 减轻肺组织病理学损伤. 而左旋精氨酸组则无明显调节作用. 离体实验结果与体内试验一致.
结论: 外源性NO可抑制NF-κB活化, 降低iNOS mRNA的表达, 进而减少NO、TNF-α的释放. 同样, 经iNOS选择性抑制剂抑制内源性NO的产生, 也可控制机体的过度炎症反应.
引文著录: 李海龙, 陈海龙, 张波, 贺雪梅, 徐宏, 范奇. 一氧化氮对急性肺损伤发病过程中核因子-κB活化的调节作用. 世界华人消化杂志 2006; 14(3): 273-279
Revised: September 21, 2005
Accepted: September 30, 2005
Published online: January 28, 2006
AIM: To further present the double-function of nitric oxide (NO) on acute lung injury (ALI) induced by severe acute pancreatitis (SAP) as well as its relation with the activation of nuclear factor kappa B (NF-κB).
METHODS: Sprague Dawley rats were averagely divided into five groups (6 for each): sham operation (control), model, sodium nitroprussi-de (SNP), L-Arg, and aminoguanidine (AG) treatment group. Sodium deoxycholate (15 g/L) was injected retrogradely into the common biliopancreatic duct of rats to establish the model of SAP. Meanwhile, in vitro stimulation experiment (using lipopolysaccharide, LPS) was also performed. The activity of NF-κB and the amount of inducible nitric oxide synthase (iNOS) mRNA in alveolar macrophages were determined by electrophoretic mobility shift assay and reverse transcription polymerase chain reaction (RT-PCR), then the levels of tumor necrosis factor a (TNF-α), NO and iNOS expression were also measured respectively.
RESULTS: The levels of NF-κB, iNOS mRNA, TNF-α, NO, iNOS in alveolar macrophages and serum of model group were significantly higher than those in control group (P = 0.02). Other indexes about ALI and pathological examination of lung tissue showed obvious pathogenic changes in model group. SNP and AG decreased the NF-κB activity (213.47 ± 12.34, 222.98 ± 17.69 vs 327.13 ± 13.46, P < 0.05), reduced iNOS mRNA expression (SNP: 2.35 ± 0.34 vs 3.1 ± 0.38, P < 0.05), TNF-α (0.38 ± 0.034, 0.45 ± 0.043 mg/L vs 0.76 ± 0.045 mg/L) and NO (168.2 ± 0.78, 146.4 ± 0.59 mmol/L vs 229.3 ± 0.98 mmol/L) level and alleviated the degree of lung injury, but no significant effect was shown in L-arg group. The results of LPS stimulation experiment were consistent with those in rat model experiment in vivo above.
CONCLUSION: Exogenous NO can suppress NF-κB activation, down-regulate iNOS mRNA expression, and alleviated the release of NO and TNF-α. Similarly, the selective inhibiting reagent of iNOS can also regulate the over-responses of inflammation through depressing endogenous nitric oxide.
- Citation: Li HL, Chen HL, Zhang B, He XM, Xu H, Fan Q. Regulatory effects of nitric oxide on nuclear factor-kappa B activation during acute lung injury. Shijie Huaren Xiaohua Zazhi 2006; 14(3): 273-279
- URL: https://www.wjgnet.com/1009-3079/full/v14/i3/273.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i3.273
NO是一种内皮衍生的血管舒张因子, 他参与细胞内信号传导, 具有舒张动脉、降低血小板黏滞性和抗炎作用, 但过量NO及其代谢产物则可致机体损伤[1-4]. 诱生性一氧化氮合酶(iNOS)属于NOS的一种, 只有在病理条件下才出现, 其产生的NO不但量大, 而且作用持久, 对机体有损害[5-8]. NF-κB是一种可以调控多种炎性因子基因表达的核因子, 他在急性胰腺炎急性肺损伤中的作用已经成为研究方面的热点[9-12]. 故我们分别从离体细胞和大鼠模型两方面, 观察外源性NO、NO的前体和iNOS选择性抑制剂对NF-κB活化和相关炎性因子释放的影响, 以进一步探讨NO调节作用的确切机制, 为临床治疗提供新的理论依据.
低温冷冻超速离心机, 日本; PCR仪, 美国; 凝胶扫描分析系统, 美国; 垂直电泳槽、电泳仪、凝胶干燥仪, 美国BIO-RAO; 电热真空干燥箱, 日本; 二氧化碳培养箱, 美国; 北京中山TNF-α放免检测试剂盒; 南京建成NO和NOS检测盒; 日本Takara公司总RNA提取及PCR扩增试剂盒, 所用PCR引物由Takara公司合成, iNOS引物: 5'-GTG TTC CAC CAG GAG ATG TTG-3'(上游), 5'-CTC CTG CCC ACT GAG TTC GTC-3'(下游), 扩增产物长576 bp; β-actin引物: 5'-GTT CGC CAT GGA TGA CGA TAT C-3'(上游), 5'-GCC AGA TCT TCT CCA TGT CGT C-3'(下游), 扩增产物长265 bp; 二硫苏糖醇(DTT), NP-40, 苯甲基磺酰氟(PMSF), Sigma公司; P50、P65多克隆抗体(Santa Cruz USA); [γ-32P]dATP(北京亚辉); 含通用κB序列的双链寡核苷酸探针: 5'-AGT TGA GGG GAC TTT CCC AGG C-3'(P1); 3'-TCA ACT CCC CTG AAA GGG TCC G-5'(P2). 核因子-κB活性检测试剂盒(Promega公司).
健康SD大鼠, 体质量180-220 g, ♂(由大连医科大学实验动物中心提供). 随机分为: 假手术组、模型组、硝普钠组、左旋精氨酸组、氨基胍组, 每组6只.
1.2.1 模型制备: 参照文献[13]方法进行. 术前动物禁食12 h, 自由饮水, 用40 g/L水合氯醛(7.5 mL/kg)腹腔注射麻醉. 无菌条件下, 腹壁正中切口入腹, 显露出十二指肠乳头开口, 在十二指肠乳头对侧肠壁插入1 mL小注射器针头经胆胰管十二指肠乳头开口入胆胰管, 同时在胆管出肝门处用小动脉夹夹闭, 逆行注入15 g/L去氧胆酸钠(1 mL/kg), 30 s注完, 对照组则开腹后·动胰腺数次, 关腹. 大鼠稍有活动即行治疗, 硝普钠组、左旋精氨酸组、氨基胍组治疗剂量均为0.5 mg/100 g. 各治疗组于造模后立即一次和造模后12 h 2次给药, 24 h后采取标本做病理检查和各项指标检测.
1.2.2 造模后大鼠支气管肺泡灌洗分离肺泡巨噬细胞: 参照文献[14]方法进行. 大鼠用40 g/L水合氯醛(7.5 mL/kg, ip)麻醉, 放血活杀, 将PBS(37℃)进行支气管肺泡灌洗共3次, 4 mL/次. 收集支气管肺泡灌洗液, 800 r/min离心, 4℃, 10 min. PBS洗涤细胞3次, 悬于DMEM(含100 mL/L小牛血清)中. 将细胞于24孔培养板, 培养37℃, 50 mL/L CO2, 1 h, PBS洗涤细胞, 去除未贴壁的非肺泡巨噬细胞, 换新的无血清RPMI 1640培养液(贴壁细胞瑞氏染色纯度90%, 台盼蓝计数活细胞率95%)调至细胞浓度1×109/L, 孵育箱中培养6 h, 检测上清夜中TNF-α和NO. 细胞用于检测iNOS、iNOS mRNA及NF-κB活性.
1.2.3 离体肺泡巨噬细胞的体外实验: 分离纯化的肺泡巨噬细胞以5×105的细胞浓度, 接种于24孔培养板. 加入脂多糖(LPS)和各种药物, 分为对照组、刺激组(LPS 10 mg/L)、硝普钠组(LPS+硝普钠, 2 mmol/L)、左旋精氨酸组(LPS+左旋精氨酸, 2 mmol/L)、氨基胍组(LPS+氨基胍, 2 mmol/L), 于作用后3, 5, 6和24 h分别检测NF-κB活性、iNOS mRNA含量、TNF-α浓度和NO含量.
1.2.4 RT-PCR: 分离后的肺泡巨噬细胞用日本Takara公司总RNA提取试剂盒提取细胞中的总RNA, 以紫外分光光度计测定A260:A280比值, 重复3次, 测得该比值稳定于1.8-2.0, 计算总RNA浓度. 取1 mg总RNA, 依次加入5×Buffer(250 mmol/L Tris-HCl, 250 mmol/L KCl, 20 mmol/L MgCl2, 50 mmol/L DTT), dNTPMixture, AMV, RNAse inhibitor, Random Primer, 以DEPC水补至总反应体积为20 mL, 逆转录的反应温度分别为30℃, 42℃和95℃, 反应时间分别为10, 30, 5 min, 循环一次, 结束反应. 取3 mL反转录产物, 分别加入dNTP, 20 pmol寡核苷酸引物, Taq DNA聚合酶, 10×缓冲液, 去离子水补至15 mL, PCR反应的变性、退火和延伸温度分别为: 94℃, 55℃和72℃, 反应时间分别为45, 55 s和1 min, 循环35次后, 72℃延伸10 min. 产物取10 mL, 8 g/L琼脂糖凝胶电泳. 经凝胶扫描分析系统行吸光度扫描, 计算iNOS基因表达量与β-actin表达量的比值.
1.2.5 肺泡巨噬细胞核蛋白的提取: 参照文献[15]方法进行. 倒去细胞培养液, 用PBS洗两次, 用刮板将细胞刮下, 收集于适当体积离心管, 4℃离心5 min, 使细胞沉淀, 弃上清, 加入200 mL冷缓冲液A(10 mmol/L HEPES-KOH pH 7.9, 1.5 mmol/L MgCl2, 10 mmol/L KCL, 0.5 mmol/L dithiothreitol, 0.2 mmol/L PMSF), 冰浴10 min, 振荡10 s, 混匀, 离心10 s, 上清即为胞质提取物, 分装后-70℃保存. 沉淀中加入20 mL冷缓冲液B(20 mmol/L HEPES-KOH pH 7.9, 250 mL/L glycerol, 420 mmol/L NaCl, 1.5 mmol/L MgCl2, 0.2 mmol/L EDTA, 0.5 mmol/L dithiothreitol, 0.2 mmol/L PMSF), 冰浴20 min. 4℃离心2 min, 弃沉淀. 上清即为核提取物, 分装后-80℃保存.
1.2.6 凝胶电泳迁移率实验: 参照文献[16]方法进行. 取2 mL含通用kB序列的双链寡核苷酸探针, 依次加入[γ-32P]dATP, T4 Polynucleotide kinase 10×Buffer, T4 Polynucleotide Kinase, Nuclease-Free Water, 总体积16 mL. 反应10 min后, 通过G-25 spin-column去除游离的32P. 取5 mg细胞抽提液, 依次加入电泳5×Buffer、Nuclease-Free Water、2 mL标记探针, 在结合缓冲液中充分结合后, 进行60 g/L非变性聚丙烯酰胺凝胶电泳, 电泳结束凝胶在干燥仪中烘干, -80℃放射自显影24 h. 经凝胶扫描分析系统行吸光度扫描, 计算核因子-κB的活性值.
1.2.7 TNF-α、NO和iNOS的检测方法: 测定采用放免法, 单位mg/L; NO和iNOS测定采用南京建成检测试剂盒, 单位mmol/L和mmol/g pro.
统计学处理 数据采用SPSS 10.0统计软件分析, 以均数±标准差(mean±SD)表示, 各组之间比较采用方差分析和q检验.
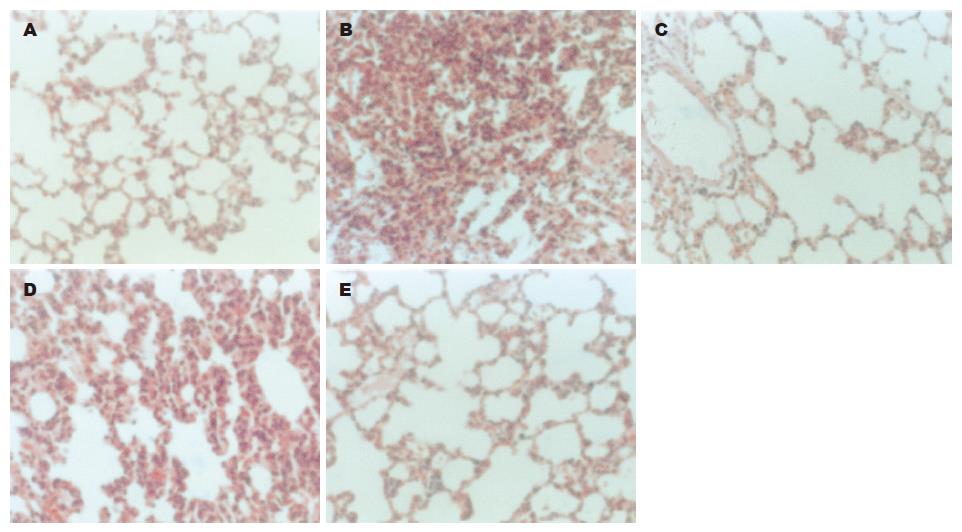
造模后24 h, 采取标本检测发现, 模型组血清和肺泡灌洗液中TNF-α、NO及肺泡巨噬细胞内iNOS蛋白水平显著高于假手术组(P<0.01); 除左旋精氨酸组外, 分别给予硝普钠和氨基胍治疗后, TNF-α(表1)、NO(表1)及iNOS蛋白(表3)的表达与模型组相比明显降低(P<0.05). 同时, 经分离纯化正常大鼠肺泡巨噬细胞, 并离体培养给予LPS刺激后, 检测培养上清中TNF-α(表2)、NO(表2)水平及细胞内iNOS蛋白发现都显著高于对照组(P<0.01); 除左旋精氨酸组外, 硝普钠和氨基胍处理组上述炎症介质的表达也都出现不同程度的减低. 炎症时, 由于诱生性一氧化氮合酶的活化导致了大量内源性NO的产生, 而后者对机体有明显的损害作用. 因此, 我们对iNOS mRNA表达的情况进行了检测. 实验中发现, 模型组和经体外LPS刺激的肺泡巨噬细胞中iNOS mRNA表达比对照组均显著升高(P<0.01); 给予硝普钠治疗后, 其表达情况受到明显抑制(P<0.05), 而左旋精氨酸组和氨基胍则没有显著的调节作用(表3).
众所周知, 炎症过程中iNOS的表达以及多种细胞因子的大量产生都是与NF-κB活化密切相关的. 随后, 应用凝胶电泳迁移率实验的方法我们检测了NF-κB的活化情况, 证实NF-κB的活性状态与TNF-α、NO及iNOS的表达呈现明显正相关. 当给予外源性NO或是iNOS选择性抑制剂氨基胍后, 上述炎症相关指标均出现不同程度的降低, 并且在大鼠模型和体外实验都得到了相同的结论(表4).
目前, 关于NO和NOS在ALI的发病过程中的作用尚存争议. 由于NO与损伤机制的多个环节有关, 因此其作用表现为"双刃剑"[1,2]. 一方面, NO具有调节血管张力、炎性细胞与内皮细胞间的相互作用, 减少血小板聚集, 抑制血小板、单核细胞、巨噬细胞、中性粒细胞与内皮细胞的黏附, 还抑制中性粒细胞在肺组织聚集, 维护肺血管内皮依赖性舒张功能[17-19], 能抑制中性粒迁移并在减轻急性肺损伤时起有益作用. 但是, 另有研究发现, 在脓毒血症并发急性肺损伤时, 许多类型的肺细胞iNOS表达, 产生大量的NO使肺损伤加重或在肺损伤的发病过程中起重要作用. 注入iNOS抑制剂可减轻由内毒素血症导致的肺损伤和微血管渗漏, 因而认为NO和iNOS是有害的[20-25]. 另据研究表明, 在缺乏iNOS基因的大鼠肺损伤较轻, 证明由iNOS表达产生大量的内源性NO是导致肺损伤的主要发病机制[26-29]. 近来研究揭示了三型NOS的基因定位, 并提出了由cNOS合成的NO在正常机体就存在, 主要起生理调节作用, 对机体有益; 而由炎性因子LPS活化巨噬细胞后产生的iNOS, 进而合成的大量NO则对机体有害, 可加重肺损伤[2]. NO是炎症反应中炎性介质瀑布连锁反应的最终共同介质之一, 也是导致感染性休克的关键介质. 国外研究表明, 核因子-κB(NF-κB)在急性肺损伤的发病过程中, 可以启动多种炎性因子、炎症介质的基因表达, 是全身炎症反应过度失控的关键环节[30-32].
基于以上关于NO作用的不同认识, 我们采用经胰管逆行注入去氧胆酸钠复制大鼠急性重症胰腺炎急性肺损伤大鼠模型和经LPS刺激肺泡巨噬细胞复制离体情况的途径, 并分别给予NO的供体硝普钠(SNP)、NO的前体左旋精氨酸(L-Arg)及iNOS选择性抑制剂氨基胍(AG)处理. 结果发现, 外源性NO可以明显抑制NF-κB活化、降低iNOS mRNA的表达、减少NO、TNF-α的释放, 减轻模型大鼠的肺组织的病理损害. 同时, 外源性NO还可以降低经LPS刺激活化离体培养肺泡巨噬细胞中的NF-κB活性, 减轻上述指标的水平. 这说明外源性NO对机体是有益的. 而且Raychaudhuri et al[33]的研究表明, NO可以通过多个环节产生影响作用. 本实验中, 给予iNOS选择性抑制剂氨基胍(AG)后, 可明显抑制内源性NO的释放, 降低由于内源性NO引发的NF-κB活化上调. 但氨基胍对iNOS mRNA的表达无影响, iNOS蛋白的生成也无变化. 说明氨基胍只能影响经iNOS催化生成的大量NO, 对iNOS的基因表达无作用, 但由于内源性NO显著下降, NF-κB的继续活化受到控制, 进而减轻了肺组织的进一步损伤. 而给予NO的前体左旋精氨酸后, 由于NF-κB活化导致iNOS mRNA高表达, 可经iNOS催化生成大量NO, 后者对机体可产生过氧化损伤等多种损害, 本实验的结果也恰恰证实了这一点.
我们认为, 目前关于NO的正反两方面的认识, 其原因是由于内源性与外源性NO作用的不同而引起的. 而内、外源性NO在机体内的信号识别系统和信号传导途径也各不相同, 就决定了二者功能上的差异. 那么如何能有效的抑制内源性NO产生的机体损害和合理的应用外源性NO对调节肺血管张力等的有益作用将会成为今后临床研究的重点和关键环节.
NO是一种内皮衍生的血管舒张因子, 他参与细胞内信号传导, 具有舒张动脉、降低血小板黏滞性和抗炎作用, 但过量NO及其代谢产物则可致机体损伤. 诱生性一氧化氮合酶(iNOS)属于NOS的一种, 只有在病理条件下才出现, 其产生的NO不但量大, 而且作用持久, 对机体有损害[5-8]. NF-kB是一种可以调控多种炎性因子基因表达的核因子, 他在急性胰腺炎急性肺损伤中的作用已经成为研究方面的热点.
目前, 关于NO和NOS在ALI的发病过程中的作用尚存争议. 由于NO与损伤机制的多个环节有关, 因此其作用表现为"双刃剑". 研究表明, 在缺乏iNOS基因的大鼠肺损伤较轻, 证明由iNOS表达产生大量的内源性NO是导致肺损伤的主要发病机制. 核因子-kB(NF-kB)在急性肺损伤的发病过程中, 可以启动多种炎性因子、炎症介质的基因表达, 是全身炎症反应过度失控的关键环节.
1 Abraham E. NF-kappaB activation. Crit Care Med 2000; 28: N100-N104
2 Marriott HM, Ali F, Read RC, Mitchell TJ, Whyte MK, Dockrell DH. Nitric oxide levels regulate macrophage commitment to apoptosis or necrosis during pneumococcal infection. FASEB J 2004; 18: 1126-1128
3 Mehta S. The effects of nitric oxide in acute lung injury. Vascul Pharmacol 2005; 43: 390-403
目前关于NO的正反两方面的认识, 其原因是由于内源性与外源性NO作用的不同而引起的. 而内、外源性NO在机体内的信号识别系统和信号传导途径也各不相同, 就决定了二者功能上的差异.
基于此方面的大量基础及临床研究, 深入细致地阐明抑制内源性NO产生的机体损害和合理的应用外源性NO对调节肺血管张力等的有益作用机制, 将会成为今后临床研究的重点和关键环节.
急性肺损伤: 是急性呼吸窘迫综合征的早期阶段, 其诊断标准为: 急性起病;氧合指数 ≤ 40 kPa (无论PaCO2是否正常或是否应用呼气末正压通气); 肺部X线片显示有双肺弥漫性浸润; PCWP ≤ 18 mmHg或无心源性肺水肿的临床证据;存在诱发ARDS的危险因素.
本文方法科学, 统计学合理, 结果可靠, 结论合理, 整篇文章有一定的独创性和新颖性, 可读性良好.
编辑: 菅鑫妍 审读: 张海宁 电编: 张敏
| 1. | Chen Y, Yang L, Lee TJ. Oroxylin A inhibition of lipopolysaccharide-induced iNOS and COX-2 gene expression via suppression of nuclear factor-kappaB activation. Biochem Pharmacol. 2000;59:1445-1457. [PubMed] |
| 2. | Harinantenaina L, Quang DN, Takeshi N, Has-himoto T, Kohchi C, Soma G, Asakawa Y. Bis (bibenzyls) from liverworts inhibit lipopolysacch-aride-induced inducible NOS in RAW 264.7 cells: a study of structure-activity relationships and molecu-lar mechanism. J Nat Prod. 2005;68:1779-1781. [PubMed] |
| 3. | Chen LW, Chang WJ, Wang JS, Hsu CM. Thermal injury-induced peroxynitrite production and pulm-onary inducible nitric oxide synthase expression de-pend on JNK/AP-1 signaling. Crit Care Med. 2006;34:142-150. [PubMed] |
| 4. | Kim SF, Huri DA, Snyder SH. Inducible nitric oxide synthase binds, S-nitrosylates, and activates cyclooxygenase-2. Science. 2005;310:1966-1970. [PubMed] |
| 5. | Wang CC, Huang YJ, Chen LG, Lee LT, Yang LL. Inducible nitric oxide synthase inhibitors of Chinese herbs III. Rheum palmatum. Planta Med. 2002;68:869-874. [PubMed] |
| 6. | Karuri AR, Huang Y, Bodreddigari S, Sutter CH, Roebuck BD, Kensler TW, Sutter TR. 31,2-Dithiole-3-thione targets nuclear factor {kappa}B to block expression of inducible nitric oxide synthase, pre-vents hypotension, and improves survival in endo-toxemic rats. J Pharmacol Exp Ther. 2005;. [PubMed] |
| 7. | Baumgarten G, Knuefermann P, Schuhmacher G, Vervolgyi V, von Rappard J, Dreiner U, Fink K, Djoufack C, Hoeft A, Grohe C. Toll-like receptor 4, nitric oxide, and myocardial depression in endotoxemia. Shock. 2006;25:43-49. [PubMed] |
| 8. | Schaue D, Jahns J, Hildebrandt G, Trott KR. Rad-iation treatment of acute inflammation in mice. Int J Radiat Biol. 2005;81:657-667. [PubMed] |
| 9. | Grigoryev DN, Finigan JH, Hassoun P, Garcia JG. Science review: searching for gene candidates in acute lung injury. Crit Care. 2004;8:440-447. [PubMed] |
| 10. | Abraham E. NF-kappaB activation. Crit Care Med. 2000;28:N100-N104. [PubMed] |
| 11. | Puneet P, Moochhala S, Bhatia M. Chemokines in acute respiratory distress syndrome. Am J Physiol Lung Cell Mol Physiol. 2005;288:L3-L15. [PubMed] |
| 12. | Schwartz MD, Moore EE, Moore FA, Shenkar R, Moine P, Haenel JB, Abraham E. Nuclear factor-kappa B is activated in alveolar macrophages from patients with acute respiratory distress syndrome. Crit Care Med. 1996;24:1285-1292. [PubMed] |
| 14. | Pheng LH, Francoeur C, Denis M. The involvement of nitric oxide in a mouse model of adult respiratory distress syndrome. Inflammation. 1995;19:599-610. [PubMed] |
| 15. | Schreiber E, Matthias P, Muller MM, Schaffner W. Rapid detection of octamer binding proteins with 'mini-extracts', prepared from a small number of cells. Nucleic Acids Res. 1989;17:6419. [PubMed] |
| 16. | Peng HB, Libby P, Liao JK. Induction and stabilization of I kappa B alpha by nitric oxide mediates inhibition of NF-kappa B. J Biol Chem. 1995;270:14214-14219. [PubMed] |
| 17. | Lundin S, Mang H, Smithies M, Stenqvist O, Frostell C. Inhalation of nitric oxide in acute lung injury: results of a European multicentre study. The European Study Group of Inhaled Nitric Oxide. Intensive Care Med. 1999;25:911-919. [PubMed] |
| 19. | Marx N, Sukhova G, Murphy C, Libby P, Plutzky J. Macrophages in human atheroma contain PPARgamma: differentiation-dependent peroxisomal proliferator-activated receptor gamma(PPARgamma) expression and reduction of MMP-9 activity through PPARgamma activation in mononuclear phagocytes in vitro. Am J Pathol. 1998;153:17-23. [PubMed] |
| 20. | Bloomfield GL, Holloway S, Ridings PC, Fisher BJ, Blocher CR, Sholley M, Bunch T, Sugerman HJ, Fowler AA. Pretreatment with inhaled nitric oxide inhibits neutrophil migration and oxidative activity resulting in attenuated sepsis-induced acute lung injury. Crit Care Med. 1997;25:584-593. [PubMed] |
| 21. | Chakraborty PD, Bhattacharyya D, Pal S, Ali N. In vitro induction of nitric oxide by mouse peritoneal macrophages treated with human placental extract. Int Immunopharmacol. 2006;6:100-107. [PubMed] |
| 22. | Mehta S. The effects of nitric oxide in acute lung injury. Vascul Pharmacol. 2005;43:390-403. [PubMed] |
| 23. | Banan A, Zhang LJ, Shaikh M, Fields JZ, Farhadi A, Keshavarzian A. Novel effect of NF-kappaB activation: carbonylation and nitration injury to cytoskeleton and disruption of monolayer barrier in intestinal epithelium. Am J Physiol Cell Physiol. 2004;287:C1139-C1151. [PubMed] |
| 24. | Marriott HM, Ali F, Read RC, Mitchell TJ, Whyte MK, Dockrell DH. Nitric oxide levels regulate macrophage commitment to apoptosis or necrosis during pneumococcal infection. FASEB J. 2004;18:1126-1128. [PubMed] |
| 25. | Lu MP, Du LZ, Gu WZ, Chen XX. Nitric oxide inhalation inhibits inducible nitric oxide synthase but not nitrotyrosine formation and cell apoptosis in rat lungs with meconium-induced injury. Acta Pharmacol Sin. 2005;26:1123-1129. [PubMed] |
| 26. | Iuvone T, D'Acquisto F, Carnuccio R, Di Rosa M. Nitric oxide inhibits LPS-induced tumor necrosis factor synthesis in vitro and in vivo. Life Sci. 1996;59:PL207-PL211. [PubMed] |
| 27. | Razavi HM, Wang le F, Weicker S, Rohan M, Law C, McCormack DG, Mehta S. Pulmonary neutrophil infiltration in murine sepsis: role of inducible nitric oxide synthase. Am J Respir Crit Care Med. 2004;170:227-233. [PubMed] |
| 28. | Kaur G, Hamid H, Ali A, Alam MS, Athar M. Antiinflammatory evaluation of alcoholic extract of galls of Quercus infectoria. J Ethnopharmacol. 2004;90:285-292. [PubMed] |
| 29. | Hashimoto N, Kawabe T, Imaizumi K, Hara T, Okamoto M, Kojima K, Shimokata K, Hasegawa Y. CD40 plays a crucial role in lipopolysaccharide-induced acute lung injury. Am J Respir Cell Mol Biol. 2004;30:808-815. [PubMed] |
| 30. | Mikawa K, Nishina K, Takao Y, Obara H. ONO-1714, a nitric oxide synthase inhibitor, attenuates endotoxin-induced acute lung injury in rabbits. Anesth Analg. 2003;97:1751-1755. [PubMed] |
| 31. | Takano H, Inoue K, Yanagisawa R, Sato M, Shimada A, Morita T, Sawada M, Nakamura K, Sanbongi C, Yoshikawa T. Protective role of metallothionein in acute lung injury induced by bacterial endotoxin. Thorax. 2004;59:1057-1062. [PubMed] |
| 32. | Jeyaseelan S, Chu HW, Young SK, Worthen GS. Transcriptional profiling of lipopolysaccharide-induced acute lung injury. Infect Immun. 2004;72:7247-7256. [PubMed] |
| 33. | Raychaudhuri B, Dweik R, Connors MJ, Buhrow L, Malur A, Drazba J, Arroliga AC, Erzurum SC, Kavuru MS, Thomassen MJ. Nitric oxide blocks nuclear factor-kappaB activation in alveolar macrophages. Am J Respir Cell Mol Biol. 1999;21:311-316. [PubMed] |