修回日期: 2005-11-21
接受日期: 2005-11-24
在线出版日期: 2006-01-28
目的: 探讨大肠癌maspin、p27、skp2的表达, 并探讨其与大肠癌发生、发展的关系.
方法: 应用免疫组化SP法检测30例结肠管状腺癌、20例结肠腺瘤、20例正常大肠黏膜组织中maspin、p27、skp2的表达情况.
结果: 30例管状腺癌中maspin、p27、skp2阳性表达率分别为83.3%(25/30)、50%(15/30)、36.7%(11/30); 20例结肠腺瘤中maspin、p27、skp2的阳性表达率分别为95%(19/20)、80%(16/20)、10%(2/20), 20例正常切缘中maspin、p27、skp2的表达率分别为95%(19/20)、90%(18/20)、5%(1/20). maspin表达与淋巴结转移(P = 0.04)和Duke's分期相关(P = 0.014); p27、skp2表达与分化程度相关(P = 0.014, P = 0.001), 而与淋巴结转移、Duke's分期、肿瘤浸润深度无关. maspin表达与p27表达正相关(r = 0.447, P<0.05), 与skp2表达无相关性; p27表达与skp2表达无相关性.
结论: maspin、p27在大肠癌中表达降低, skp2在大肠癌中过表达, 可作为反映大肠癌分化程度的指标之一. maspin可能在大肠癌的发生、发展(尤其是淋巴结转移)中起作用, 有望成为诊断大肠癌及其发生淋巴结转移的分子生物学标记物之一.
引文著录: 刘丹丹, 易永芬, 邓玮. maspin、p27、skp2在大肠肿瘤的表达及意义. 世界华人消化杂志 2006; 14(3): 267-272
Revised: November 21, 2005
Accepted: November 24, 2005
Published online: January 28, 2006
AIM: To explore the expression of maspin, p27, skp2 in colorectal adenocarcinoma as well as their roles in the tumorgenesis and progression of colorectal carcinoma.
METHODS: SP immunohistochemistry was used to detect the expression of maspin, p27 and skp2 in tissues of colorectal tubular adenocarcinoma (n = 30), colorectal polypous adenoma (n = 20) and normal controls (n = 20).
RESULTS: Of 30 cases of tubular adenocarcinoma, the positive rates of maspin, p27 and skp2 expression were 83.3%(25/30), 50%(15/30), and 36.7%(11/30), respectively; of 20 cases of polypous adenoma, the positive rates of maspin, p27 and skp2 were 95%(19/20), 80%(16/20), and 10%(2/20), respectively; of 20 cases of normal colorectal tissues, the corresponding positive rates were 95%(19/20), 90%(18/20), and 5%(1/20). The expression of maspin was significantly correlated with lymph node metastasis (P = 0.04) and Duke's staging (P = 0.014). The expression of p27 and skp2 showed a marked correlation with the differentiation of carcinoma (P = 0.014, P = 0.001), while no significant correlation with tumor infiltration depth, lymph node metastasis and Duke's staging. There was a positive correlation between maspin and p27 expression (r = 0.447, P <0.05), but there was no notable correlation between maspin and skp2 expression, as well as p27 and skp2 expression.
CONCLUSION: The expression of maspin and p27 are increased, while skp2 expression is decreased in colorectal adenocarcinoma. The aberrant expression of maspin, p27 and skp2 may be indicators for reflecting the differentiation of colorectal adenocarcinoma. Maspin plays an important role in tumorgenesis and progression, especially lymph node metastasis, of colorectal adenocarcinoma.
- Citation: Liu DD, Yi YF, Deng W. Expression and its significance of maspin, p27 and skp2 in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2006; 14(3): 267-272
- URL: https://www.wjgnet.com/1009-3079/full/v14/i3/267.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i3.267
maspin基因是常染色体基因, 位于18q21.3-q23, 编码的蛋白为一种丝氨酸蛋白酶抑制剂, 大量研究已证实, 该基因在正常组织中高表达[1], 在肿瘤组织中表达降低, 具有抑制肿瘤浸润、转移的作用[2-4]. p27kip1是一种细胞周期抑制剂, p27kip1因能阻止细胞通过R点而抑制其增殖, 成为一个重要的候选抑癌基因. p27kip1低表达被认为与肿瘤的预后不良及高度侵袭性密切相关[5-8]. 肿瘤细胞表面黏附能力的改变是肿瘤发生浸润、转移等恶性生物学行为的前提. maspin和p27均有影响细胞表面黏附能力的作用[9-12]. 而skp2是新发现的SCF(skp1-cullin-F-box蛋白)多功能E3酶复合体中的一种F-box蛋白, 通过泛素蛋白酶体途径降解p27kip1, 在大量实体肿瘤中呈高表达, 并与p27kip1呈负相关[13].大肠癌是消化系统常见的恶性肿瘤, 其血供丰富、生长迅速、浸润性强、且易发生转移, 大肠腺瘤是大肠癌的癌前病变. 有关maspin, skp2, p27在大肠癌中的表达及相关关系的研究, 国内外尚未见报道. 我们采用免疫组化SP法检测maspin, skp2, p27在大肠癌、大肠腺瘤及正常组织中的表达, 比较它们表达与临床病理特征的关系, 并探讨了大肠癌中maspin, skp2, p27表达的关系.
1987/2004重庆医科大学第一附属医院手术切除的大肠肿瘤石蜡包埋标本70例, 其中大肠管状腺癌30例, 大肠腺瘤20例(其中大肠息肉状腺瘤6例, 大肠绒毛状腺瘤14例), 20例正常大肠黏膜组织取自大肠管状腺癌手术切除标本的正常切缘, 切缘经组织学观察证实无癌组织浸润、无腺瘤样结构. 大肠癌的分化程度: 高分化管状腺癌5例、中分化管状腺癌20例, 低分化管状腺癌5例. 大肠癌的Duke' s分期: A期2例, B期22例, C期5例, D期1例. 30例大肠癌中有肝转移者1例, 有局部淋巴结转移者5例, 无淋巴结转移者25例. 按浸润深度: 未达浆膜层者6例, 侵及浆膜层者24例.
采用常规SP法. maspin即用型单克隆抗体(MS-1767-R7)购自美国Neomaker公司; p27、skp2即用型单克隆抗体, SP-9 000试剂盒购自北京中杉生物公司. 具体步骤按试剂说明书进行. 用PBS代替一抗作阴性对照. maspin染色结果判断标准: 根据文献采用半定量积分法, 即对每张切片的阳性细胞率及阳性细胞着色强度分别进行分级记分, 然后根据两项之和确定其阳性强度[14].maspin阳性表达产物定位于细胞质或细胞质、细胞核同时着色, p27阳性信号定位于细胞核. 染色强度阴性、中、强分别积分为0, 1, 2; 阳性细胞率0、<1%、<10%、<1/3、<2/3、>2/3分别积分为0, 1, 2, 3, 4, 5. 两项之和0-2分为阴性(-), 3-5分为阳性(+), 6-8分为强阳性(++). Skp2染色结果判断标准: 阳性细胞为棕黄色颗粒位于细胞核或细胞核伴细胞质内, 而只有细胞质内出现棕黄色为非特异性染色. 以每张切片阳性细胞数超过20%为阳性切片. p27染色结果判断标准: p27阳性反应产物主要位于细胞核或细胞核与细胞质同时出现, 阳性判断标准为该位置出现了明确的棕黄色颗粒, 400倍显微镜下每张切片计数5个视野, 每个视野100个肿瘤细胞, 取阳性细胞数百分比的平均值, 小于50%为阴性表达, 大于50%为阳性表达.
统计学处理 使用SPSS11.5统计软件进行统计分析.根据资料性质, 采用χ2检验及spearman等级相关分析. 检验水准为a= 0.05.
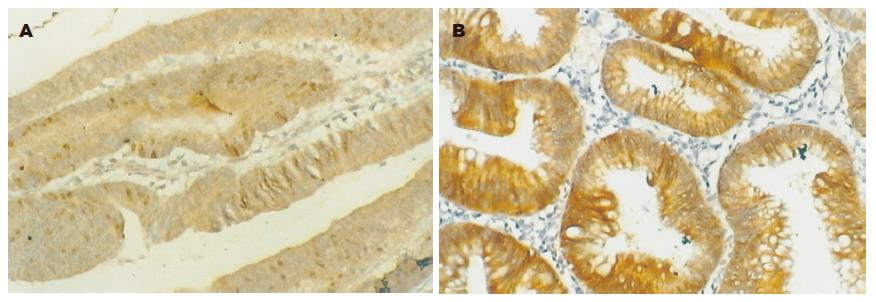
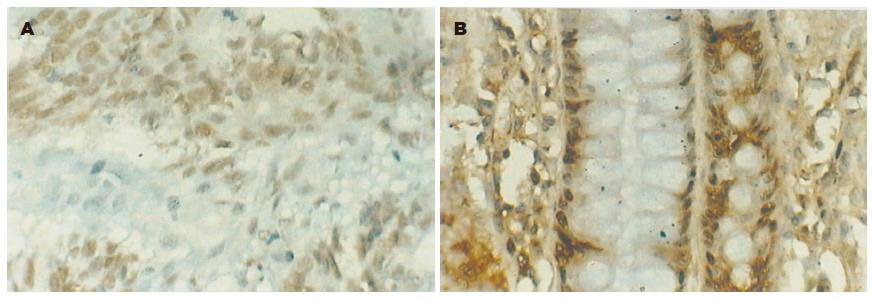
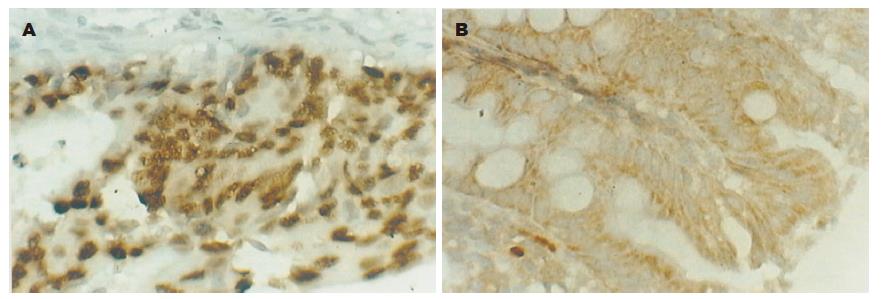
maspin阳性染色主要是细胞质或细胞质与细胞核同时着色, 呈棕黄色弥漫分布(图1A-B). maspin主要表达于大肠癌细胞、腺瘤和正常组织的腺上皮细胞. 正常大肠黏膜组织和大肠腺瘤maspin表达率和表达强度明显高于大肠癌组织(P<0.05). 大肠癌p27主要位于肿瘤细胞胞核; 大肠腺瘤组织和正常组织p27阳性反应产物主要位于黏膜腺细胞胞核, 呈明显棕色细颗粒状(图2A-B).正常大肠黏膜组织和大肠腺瘤p27表达率高于大肠癌组织(P<0.05). 正常大肠黏膜组织和大肠腺瘤skp2表达率明显高于大肠癌组织(P<0.05). skp2主要在结肠腺瘤的腺上皮细胞及结肠腺癌的肿瘤细胞胞核, 或细胞核与细胞质同时表达, 呈棕黄色颗粒状(表1, 图3A-B).
无淋巴结转移组的maspin阳性表达率高于有淋巴结转移组(P<0.05); Duke's分期A、B期maspin阳性表达率高于C、D期(P<0.05). 高、中分化的结肠癌组织p27高表达率高于低分化的结肠癌组织. 高、中分化的结肠癌组织skp2阳性表达率低于低分化的结肠癌组织(表2).
30例大肠管状腺癌组织中, maspin与p27表达呈正相关(P<0.05). 30例大肠管状腺癌组织中, maspin与skp2表达无相关性(P>0.05). 30例大肠管状腺癌组织中, skp2与p27表达无相关性(P>0.05)(表3).
| 项目 | maspin | r(spearman等级相关系数) | P 值 | skp2 | r(spearman等级相关系数) | P 值 | ||
| - | +~++ | - | + | |||||
| P27 | ||||||||
| 低表达 | 5 | 10 | 7 | 12 | ||||
| 高表达 | 0 | 15 | 0.447 | 0.013 | 18 | 3 | -0.346 | 0.061 |
| skp2 | ||||||||
| - | 2 | 17 | ||||||
| + | 3 | 5 | -0.217 | 0.250 | ||||
maspin(mammary-serpin)基因是1994年发现的一种新的丝氨酸蛋白酶抑制剂. maspin基因定位于染色体18q21.3, 全长2 584 bp[1]. 用质粒和反转录病毒转染乳腺癌TM40D细胞株使maspin表达上调时, 显示出maspin具有抑制肿瘤细胞生长和转移的作用[15]. 我们研究了maspin在大肠腺癌组织、大肠腺瘤、正常大肠黏膜组织中的表达情况. 我们发现, 83.3%的大肠腺癌组织maspin阳性表达, 其中强阳性率26.7%, 而大肠腺瘤阳性率及强阳性率分别为95%、75%, 正常组织强阳性率为85%. 这与Song et al[4]采用组织芯片技术检测到大肠腺瘤、大肠腺癌组织中maspin表达分别为91.7% 、75.5%的结果相近. 此结果提示maspin表达降低可能与结肠癌的发生有关. 我们进一步探讨了maspin表达与临床病理特征的关系, 发现maspin表达率高者淋巴结转移率低(P<0.05), 这与在鳞状上皮癌、乳腺癌、胃癌等中的发现一致[16-19], 由此表明maspin表达降低与结肠癌淋巴结转移有关, 肿瘤组织中maspin表达降低, 对其淋巴结转移有促进作用. C期结肠癌组织中maspin的阳性率高于A、B期, 提示结肠癌组织中maspin表达随结肠癌临床分期的进展而降低, 晚期结肠癌患者maspin表达较早期为低, 在乳腺癌、前列腺癌、胃癌中也有相似结论[20-24]. 以上结果均提示maspin表达降低可能是结肠癌具有高侵袭、转移能力的基础. maspin有望成为诊断大肠癌及其发生淋巴结转移的一项分子生物学指标.
p27基因是1994年发现并克隆的参与细胞周期调控的抑癌基因, 其表达产物KIP1是一种非特异性的、广谱的细胞周期素依赖性激酶抑制因子(CDKIs)[25]. p27参与细胞周期调控的关键是蛋白质表达水平, 而非基因突变. p27kip1表达下调或缺失, 细胞周期加速, 增殖活跃, 不仅在大肠癌早期形成中可能有一定作用, 而且还可能促进了大肠癌的发展[5,6]. 本实验中, 结肠腺瘤组织p27表达率为80%, 而结肠癌为50%, 两者的差异有显著性, 说明结肠癌存在明显的p27缺失或降低, 证实p27的水平下降与结肠癌的发生有关. 本实验中p27表达与结肠癌的浸润深度、Duke's分期、有无淋巴结转移无相关性, 提示p27蛋白水平降低可能发生于结肠癌发生的早期. 我们还发现, 高、中分化的结肠癌p27表达率高于低分化的结肠癌组织(P<0.05), p27蛋白的表达与肿瘤的恶性程度负相关.
在乳腺癌和前列腺癌组织中已证实, maspin具有能调节细胞凋亡、移动和血管生成等生物学功能[18]. 而CDKIs除能调节细胞周期外, 还能调节细胞的分化和移动等细胞活动. 在细胞周期动力学中, p27kip1参与N-钙黏素介导的细胞间的接触抑制[9], p27kip1还能影响微管对细胞外基质黏附的稳定性[11].目前认为, 调节p27kip1表达的信号可能通过改变细胞形状或改变细胞接受胞外信号的能力而达到调节细胞间黏附的作用, 例如BRAF-MEK-ERK信号通路[12]. 我们发现, 结肠癌中maspin与p27表达正相关, 提示它们可能是大肠癌肿瘤细胞表面黏附能力改变的分子基础, 在结肠癌的发生中maspin和p27共同发挥作用. 同时检测maspin、p27的表达可能对大肠癌有一定的诊断意义. 由于国内外尚无maspin与p27相关性的报道, 还需通过进一步的实验来证实及探讨二者的关系及机制.
skp2是1995年从大量的恶变细胞中发现的一种能与S期激酶cyclinA-CDK2相互作用的蛋白. 因其主要存在于恶变细胞的S期且与cyclinA-CDK2活性有关, 故命名为S期激酶相关蛋白2(skp2). skp2具有调控细胞周期、参与细胞DNA的合成、转录激活等作用[26]. 本研究结果显示, skp2在大肠癌组织中阳性表达率为36.7%(11/30), 而大肠腺瘤组织仅为10%(2/20), 二者差异有显著性(P<0.05), 这与Li et al[27]采用Western blot法检测出在大肠正常黏膜-大肠腺瘤-大肠癌的转变中, skp2表达显著增加的结果一致, 提示skp2与结肠癌的发生有关.我们还发现, skp2阳性表达率与结肠癌的浸润深度、Duke' s分期、有无淋巴结转移无关(P>0.05); skp2阳性表达率与结肠癌的分化程度有关(P<0.05), 尤其在低分化结肠癌组织中, 其阳性表达率达到100%. 该结果提示, 检测skp2蛋白表达对判断结肠癌的恶性程度有一定意义. skp2作为泛素蛋白酶体途径的底物识别序列, 能泛素化降解p27kip1. 大量研究表明, 在多种恶性肿瘤中, skp2常呈高表达, p27kip1则呈低表达, 且两者呈负相关[28-30]. Hershko et al[31]将人体大肠癌标本经过免疫印迹和免疫组化的方法测定skp2和p27kip1的表达, 发现在skp2表达增高的组织中p27kip1的表达水平降低, 在p27kip1表达增高的组织中skp2的表达水平降低. 二者具有明显的负相关性(r = -0.812; P<0.0001). 我们也得出了skp2在癌组织中高表达, p27在癌组织中表达降低的结果, 但两者的相关性无统计学意义(P>0.05).
maspin是一种新发现的丝氨酸蛋白酶抑制剂, 已在多种肿瘤中证实其具有抑制肿瘤侵袭、转移的作用. 但有关maspin在大肠癌中的研究, 国外报道较少, 国内尚无报道.
我们进行了mas-pin在大肠癌中表达的研究, 探讨了其表达与临床病理因素的关系, 首次分析了maspin与p27、skp2表达的相关性, 初步探讨了maspin可能的作用机制, 为以后更深入的研究打下基础.
编辑: 菅鑫妍 审读: 张海宁 电编: 李琪
| 1. | Cao D, Wilentz RE, Abbruzzese JL, Ho L, Maitra A. Aberrant expression of maspin in idiopathic inflammatory bowel disease is associated with disease activity and neoplastic transformation. Int J Gastrointest Cancer. 2005;36:39-46. [PubMed] |
| 2. | Xia W, Lau YK, Hu MC, Li L, Johnston DA, Sheng S, El-Naggar A, Hung MC. High tumoral maspin expression is associated with improved survival of patients with oral squamous cell carcinoma. Oncogene. 2000;19:2398-2403. [PubMed] |
| 3. | Yasumatsu R, Nakashima T, Hirakawa N, Kumamoto Y, Kuratomi Y, Tomita K, Komiyama S. Maspin expression in stage I and II oral tongue squamous cell carcinoma. Head Neck. 2001;23:962-966. [PubMed] |
| 4. | Song SY, Lee SK, Kim DH, Son HJ, Kim HJ, Lim YJ, Lee WY, Chun HK, Rhee JC. Expression of maspin in colon cancers: its relationship with p53 expression and microvessel density. Dig Dis Sci. 2002;47:1831-1835. [PubMed] |
| 5. | Li GQ, Zhang HF. Mad2 and p27 expression profiles in colorectal cancer and its clinical significance. World J Gastroenterol. 2004;10:3218-3220. [PubMed] |
| 6. | Fan JW, Fan PX, Wang Y, Zhang XQ. Relationship between expression of p27 and DNA ploidy in colorectal carcinoma. Ai Zheng. 2002;21:54-57. [PubMed] |
| 7. | Wu JT, Kakar S, Nelson RL, Mihalov ML, Hayward B, Gilbert PB, Ghosh L. Prognostic significance of DCC and p27Kip1 in colorectal cancer. Appl Immunohistochem Mol Morphol. 2005;13:45-54. [PubMed] |
| 8. | Lebe B, Sarioglu S, Sokmen S, Ellidokuz H, Fuzun M, Kupelioglu A. The clinical significance of p53, p21, and p27 expressions in rectal carcinoma. Appl Immunohistochem Mol Morphol. 2005;13:38-44. [PubMed] |
| 9. | Messina G, Blasi C, La Rocca SA, Pompili M, Calconi A, Grossi M. p27Kip1 acts downstream of N-cadherin-mediated cell adhesion to promote myogenesis beyond cell cycle regulation. Mol Biol Cell. 2005;16:1469-1480. [PubMed] |
| 10. | Massarelli E, Brown E, Tran NK, Liu DD, Izzo JG, Lee JJ, El-Naggar AK, Hong WK, Papadimitrakopoulou VA. Loss of E-cadherin and p27 expression is associated with head and neck squamous tumorigenesis. Cancer. 2005;103:952-959. [PubMed] |
| 11. | Baldassarre G, Belletti B, Nicoloso MS, Schiappacassi M, Vecchione A, Spessotto P, Morrione A, Canzonieri V, Colombatti A. p27(Kip1)-stathmin interaction influences sarcoma cell migration and invasion. Cancer Cell. 2005;7:51-63. [PubMed] |
| 12. | Bhatt KV, Spofford LS, Aram G, McMullen M, Pumiglia K, Aplin AE. Adhesion control of cyclin D1 and p27Kip1 levels is deregulated in melanoma cells through BRAF-MEK-ERK signaling. Oncogene. 2005;24:3459-3471. [PubMed] |
| 13. | Lahav-Baratz S, Ben-Izhak O, Sabo E, Ben-Eliezer S, Lavie O, Ishai D, Ciechanover A, Dirnfeld M. Decreased level of the cell cycle regulator p27 and increased level of its ubiquitin ligase Skp2 in endometrial carcinoma but not in normal secretory or in hyperstimulated endometrium. Mol Hum Reprod. 2004;10:567-572. [PubMed] |
| 14. | Son HJ, Sohn TS, Song SY, Lee JH, Rhee JC. Maspin expression in human gastric adenocarcinoma. Pathol Int. 2002;52:508-513. [PubMed] |
| 15. | Shi HY, Zhang W, Liang R, Kittrell F, Templeton NS, Medina D, Zhang M. Modeling human breast cancer metastasis in mice: maspin as a paradigm. Histol Histopathol. 2003;18:201-206. [PubMed] |
| 16. | Manzotti M, Dell'Orto P, Maisonneuve P, Zurrida S, Mazzarol G, Viale G. Reverse transcription-polymerase chain reaction assay for multiple mRNA markers in the detection of breast cancer metastases in sentinel lymph nodes. Int J Cancer. 2001;95:307-312. [PubMed] |
| 17. | Yasumatsu R, Nakashima T, Hirakawa N, Kumamoto Y, Kuratomi Y, Tomita K, Komiyama S. Maspin expression in stage I and II oral tongue squamous cell carcinoma. Head Neck. 2001;23:962-966. [PubMed] |
| 18. | Sopel M, Kasprzyk I, Berdowska I. Maspin and c-erbB-2 expression in correlation with microvessel density in invasive ductal breast cancer. Folia Histochem Cytobiol. 2005;43:109-116. [PubMed] |
| 19. | Xu C, Quddus MR, Sung CJ, Steinhoff MM, Zhang C, Lawrence WD. Maspin expression in CIN 3, microinvasive squamous cell carcinoma, and invasive squamous cell carcinoma of the uterine cervix. Mol Pathol. 2005;18:1102-1106. [PubMed] |
| 20. | Marioni G, Blandamura S, Giacomelli L, Calgaro N, Segato P, Leo G, Fischetto D, Staffieri A, de Filippis C. Nuclear expression of maspin is associated with a lower recurrence rate and a longer disease-free interval after surgery for squamous cell carcinoma of the larynx. Histopathology. 2005;46:576-82. [PubMed] |
| 21. | Maass N, Hojo T, Rosel F, Ikeda T, Jonat W, Nagasaki K. Down regulation of the tumor suppressor gene maspin in breast carcinoma is associated with a higher risk of distant metastasis. Clin Biochem. 2001;34:303-307. [PubMed] |
| 22. | Chen Z, Fan Z, McNeal JE, Nolley R, Caldwell MC, Mahadevappa M, Zhang Z, Warrington JA, Stamey TA. Hepsin and maspin are inversely expressed in laser capture microdissectioned prostate cancer. J Urol. 2003;169:1316-1319. [PubMed] |
| 23. | Zheng HC, Wang MC, Li JY, Yang XF, Sun JM, Xin Y. Expression of maspin and kai1 and their clinicopathological significance in carcinogenesis and progression of gastric cancer. Chin Med Sci J. 2004;19:193-198. [PubMed] |
| 24. | Wang MC, Yang YM, Li XH, Dong F, Li Y. Maspin expression and its clinicopathological significance in tumorigenesis and progression of gastric cancer. World J Gastroenterol. 2004;10:634-637. [PubMed] |
| 25. | Schmider-Ross A, Pirsig O, Gottschalk E, Denkert C, Lichtenegger W, Reles A. Cyclin-dependant kinase inhibitors CIP1 (p21) and KIP1 (p27) in ovarian cancer. J Cancer Res Clin Oncol. 2006;132:163-170. [PubMed] |
| 26. | Ma XM, Liu JH, Guo JW, Liu Y, Zuo LF. Correlation of Skp2 Expression in Gastric Carcinoma to Expression of P27 and PTEN. Ai Zheng. 2006;25:56-61. [PubMed] |
| 27. | Li JQ, Wu F, Masaki T, Kubo A, Fujita J, Dixon DA, Beauchamp RD, Ishida T, Kuriyama S, Imaida K. Correlation of Skp2 with carcinogenesis, invasion, metastasis, and prognosis in colorectal tumors. Int J Oncol. 2004;25:87-95. [PubMed] |
| 28. | Shibahara T, Onishi T, Franco OE, Arima K, Sugimura Y. Down-regulation of Skp2 is correlated with p27-associated cell cycle arrest induced by phenylacetate in human prostate cancer cells. Anticancer Res. 2005;25:1881-1888. [PubMed] |
| 29. | Li H, Jiang X, Zhou X. Expression of Skp2 and p27 proteins in laryngeal squamous cell carcinoma and their significances. Lin Chuang Er Bi Yan Hou Ke Za Zhi. 2005;19:409-411. [PubMed] |