修回日期: 2006-08-11
接受日期: 2006-09-01
在线出版日期: 2006-10-18
目的: 分析十二指肠间质瘤的临床特征并探讨其外科治疗及预后因素.
方法: 回顾性分析我科1993-2006年30例十二指肠间质瘤的临床资料. 运用SPSS统计软件进行生存分析, 采用Kaplan Meier法和log-rank检验进行单因素生存预后分析, 多因素分析采用Cox模型.
结果: 十二指肠间质瘤最常见症状为右上腹隐痛不适、消化道出血, 发病部位以十二指肠降段多见. 全组1, 3, 5年生存率分别为92.95%, 84.87%, 69.15%. 单因素分析Fletcher风险分级(χ2 = 10.570, P = 0.0143), 肿瘤大小(χ2 = 7.883, P = 0.0485), 核分裂象(>5, ≤5: χ2 = 14.155, P = 0.0002), 是否伴发远处转移(χ2 = 22.519, P = 0.0000)具有显著性, 是否行根治术(χ2 = 17.8180, P = 0.0000)比较差异具有显著性, 多因素分析表明核分裂象是独立的预后影响因素.
结论: 十二指肠间质瘤宜采用局部切除为主的根治性手术, 本组病例核分裂象是判断预后的独立因素.
引文著录: 张勇, 陈凛. 十二指肠间质瘤临床分析30例. 世界华人消化杂志 2006; 14(29): 2893-2896
Revised: August 11, 2006
Accepted: September 1, 2006
Published online: October 18, 2006
AIM: To investigate clinical characteristics, surgical treatment and prognosis factors for the patients with duodenal gastrointestinal stromal tumors (GISTs).
METHODS: The clinical data of 30 patients with duodenal GISTs from 1993 to 2006 were retrospectively analyzed. The survival rates were calculated by Kaplan-Meier method, and the prognosis factors were analyzed by univariate analysis, and Cox model multivariate analysis.
RESULTS: Common symptoms of duodenal GISTs were abdominal pain and alimentary tract hemorrhage. Common lesions of duodenal GISTs were located in the descending portion. The overall 1-, 3-, and 5-year survival rate were 92.95%, 84.87%, and 69.15%, respectively. Univariate analysis showed that Fletcher's classification (χ2 = 10.570, P = 0.0143), tumor size (χ2 = 7.883, P = 0.0485), mitosis (>5, ≤5: χ2 = 14.155, P = 0.0002), distant metastases (χ2 = 22.519, P = 0.0000) were significant prognostic factors. The number of patients with radical partial resection was markedly larger than that without radical partial resection (χ2 = 17.8180, P = 0.0000). COX multivariate analysis indicated that only mitosis was an independent prognostic factor.
CONCLUSION: Surgical treatment of duodenal GISTs should be based on radical partial resection, and mitosis may be an independent prognostic factor for patients with duodenal GISTs.
- Citation: Zhang Y, Chen L. Clinical analysis of 30 patients with duodenal gastrointestinal stromal tumors. Shijie Huaren Xiaohua Zazhi 2006; 14(29): 2893-2896
- URL: https://www.wjgnet.com/1009-3079/full/v14/i29/2893.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i29.2893
胃肠道间质瘤(gastrointestinal stromal tumor, GIST)以往被诊断为平滑肌瘤或平滑肌肉瘤, 近年基于免疫组化及电镜的发展被区分出来, 是最常见的间叶组织来源肿瘤, 约占胃肠道肿瘤的2%[1]. 可发生在消化道的各个部位, 但发生于十二指肠的间质瘤较少, 约占所有间质瘤的4.5%[2], 国内外十二指肠间质瘤仅见少数报道[3-7]. 由于其解剖和生理的特殊性, 在诊断和治疗上也有其特点. 现总结1993-2006年我院共收治经病理证实的30例十二指肠间质瘤的临床病理资料, 分析如下.
本组30例, 男23例, 女7例. 年龄28-74(平均53.0)岁, 中位年龄53岁. 肿瘤直径2-21.5 cm, 中位直径7 cm. 肿瘤位于十二指肠球部1例, 降段18例, 水平段9例, 升段2例. 临床症状表现为上腹不适疼痛26例(86.7%), 黑便、便血18例(60.0%), 腹部包块8例(26.7%), 无症状者1例. Fletcher分级极低风险1例(3.3%), 低风险10例(33.3%), 中风险6例(20.0%), 高风险13例(43.3%). 19例行超声检查, 6例提示腹腔占位, 来自胰腺可能; 4例提示腹膜后肿瘤和腹膜后囊性肿瘤; 5例诊断肿瘤来自肠道; 4例未能明确诊断. 13例行十二指肠低张造影, 均诊断病变来自十二指肠. 26例行CT扫描, 15例提示占位来自十二指肠占位, 3例提示囊性占位来自腹膜后, 5例提示胰头后方软组织影, 均与十二指肠关系密切, 3例未能明确诊断. 5例行核磁共振检查均提示来自十二指肠肿瘤. 3例内镜超声检查(EUS)均明确病变部位. 参考Fletcher et al[8]提出的风险分级标准将十二指肠间质瘤分为极低风险: 肿瘤直径≤2 cm, 核分裂象<5/50 HPF; 低风险: 肿瘤直径>2-5 cm, 核分裂象<5/50 HPF; 中风险: 肿瘤直径<5 cm, 核分裂象>5-10/50 HPF或肿瘤直径>5-10 cm, 核分裂象<5/50 HPF; 高风险: 肿瘤直径>10 cm, 任何核分裂象或核分裂象>10/50 HPF、任何大小的肿瘤. 免疫组化检测主要内容: SMA蛋白、可溶性酸性蛋白S-100、造血干细胞抗原CD34和酪氨酸受体CD117. 30例均行手术治疗, 11例行局部切除加肠修补术; 5例行十二指肠节段切除(1例行肝肿瘤微波治疗); 3例行远端胃加十二指肠节段切除(其中1例同时行脾切除); 1例行十二指肠节段切除, 右半结肠切除术, 肝肿块部分切除活检术; 9例行胰十二指肠切除术(2例同时行胆囊切除, 1例行右半肝切除, 1例行小肠结肠部分切除); 1例行剖腹探查、胃空肠吻合、胆囊空肠吻合术. 4例再手术治疗. 根治性切除24例, 非根治性手术6例. 根治性手术的标准是肿瘤完整切除无残留, 肿瘤无破裂, 切缘阴性.
由本科随访组采取信访、电话随访或门诊随访形式进行随访, 失访病例按死亡计算. 应用SPSS软件行统计学分析, 总样本生存率计算应用Kaplan Meier法, 单因素分析应用log-rank检验, 多因素分析应用Cox回归模型, P<0.05作为差异有显著性意义. 单因素分析有统计学差异的因素进入Cox回归分析, 分析多因素对预后的影响.
30例均随访到, 无失访, 随访3 mo-14年(平均4.95年). 30例十二指肠间质瘤患者1, 3, 5年生存率为92.95%, 84.87%, 69.15%. 免疫组化染色CD117阳性30例(100%), CD34阳性19例(63.33%), SMA阳性23例(36.67%), S-100阳性2 例(6.67%).
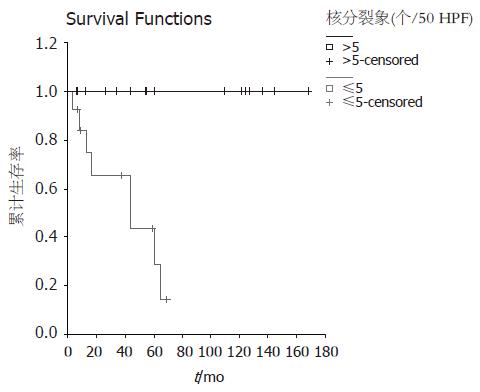
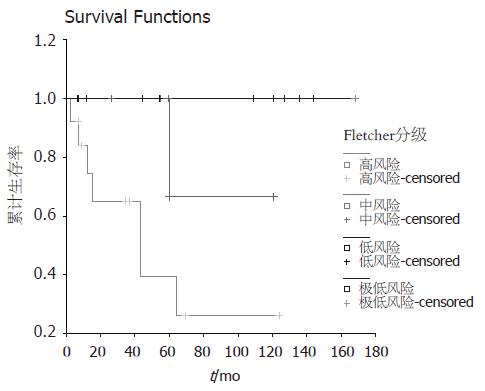
对不同性别、年龄(>50岁者17例, ≤50岁者13例)、肿瘤部位, 是否行胰十二指肠切除术分别进行生存率单因素分析差异无显著性意义(P>0.05). 对不同肿瘤直径大小(<2 cm 1例, 2-5 cm 10例, 5-10 cm 12例, >10 cm 7例)存活率分析, 肿瘤直径≥10 cm组存活率明显降低, P = 0.0485. 不同核分裂象(>5/50 HPF 16例, ≤5/50 HPF 14例)组, 核分裂象≤5/50 HPF的肿瘤存活率明显优于核分裂象>5/50 HPF组(P = 0.0002). 不同Fletcher分级存活率随分级依次递减, 高风险组存活率生存预后差. 极低风险1例(3.3%), 低风险10例(33.3%), 中风险6例(20.0%), 高风险13例(43.3%), 各组比较差异有显著性(P = 0.0143). 伴远处转移与否(5例伴转移, 25例无远处转移), 根治性手术组与非根治性手术组(24例根治性手术, 6例非根治性手术), 差异均具有显著性(P均 = 0.0000). 不同Fletcher分级, 核分裂象生存曲线(图1-2, 表1).
| n | χ2 | P | |
| 性别 | |||
| 男 | 23 | 2.613 | 0.1060 |
| 女 | 7 | ||
| 年龄 | 0.056 | 0.8132 | |
| ≤50 | 17 | ||
| >50 | 13 | ||
| 解剖部位 | |||
| 球部 | 1 | 1.850 | 0.6042 |
| 降段 | 18 | ||
| 水平段 | 9 | ||
| 升段 | 2 | ||
| 肿瘤大小(cm) | |||
| ≤2 | 1 | 7.883 | 0.0485 |
| 2-5 | 10 | ||
| 5-10 | 12 | ||
| ≥10 | 7 | ||
| 核分裂象(50 HPF) | |||
| ≤5 | 16 | 14.155 | 0.0002 |
| >5 | 14 | ||
| 手术方式 | |||
| 胰十二指肠切除术 | 9 | 1.100 | 0.2943 |
| 其他手术 | 21 | ||
| 根治性手术 | |||
| 是 | 24 | 17.8180 | 0.0000 |
| 否 | 6 | ||
| 转移 | |||
| 是 | 25 | 22.519 | 0.0000 |
| 否 | 5 | ||
| Fletcher分级 | |||
| 极低风险 | 1 | 10.570 | 0.0143 |
| 低风险 | 10 | ||
| 中风险 | 6 | ||
| 高风险 | 13 |
Cox回归分析: Cox回归方程χ2 = 19.2168, P = 0.0002, 回归方程拟和较好, P = 0.0362显示核分裂象是影响预后的独立预后因素.
GIST过去曾被诊断为平滑肌源性或神经源性肿瘤, Mazur et al[9]1983年首次提出GIST的概念, 近年来随着电镜和免疫组化等技术的发展, 已证实GIST是一种非定向分化的间质瘤, 是消化道独立的一类间叶组织肿瘤, 可发生在从食管至肛门的胃肠道全长范围, 但发生于十二指肠的间质瘤较少. 十二指肠间质瘤多发于十二指降段, 临床表现差异较大, 通常无特殊症状, 当肿瘤较大时可出现症状, 如腹部肿块、呕血、黑便、上腹不适等. 免疫组化检查是诊断间质瘤的主要依据. CD117是最具特征的免疫组化标记物[2], CD34阳性说明肿瘤来源于间叶细胞, 病理诊断上CD117和CD34阳性最有诊断意义.
GIST对放疗和化疗均不敏感[10], 仍以手术切除为主[2,11-12]. 但十二指肠解剖及生理的特殊性给十二指肠间质瘤的处理带来困难, 如何选择最佳的手术方式也无定论[13]. 虽然有报道40%的十二指肠间质瘤行胰十二指肠切除术[13], 但其可能并无必要. 我们认为将肿瘤完整切除, 无瘤体破裂, 切缘阴性即达到根治性标准. 手术还是以局部切除为主, 一般认为切缘距肿瘤1.5 cm即可, 手术中还应注意防止肿瘤破裂[14]. 由于十二指肠固定血循差, 难保吻合口安全愈合, 所以在十二指肠端端吻合或十二指肠缺损部修补困难时, 空肠和十二指肠缺损部吻合是必要的. 本组6例行十二指肠缺损部与空肠侧侧吻合, 愈合良好. 我们认为只要不影响乳头的正常功能, 切除范围足够, 尽可能保持十二指肠原有的解剖和生理功能, 没有必要扩大手术范围. 只有肿瘤直径≥5 cm且肿瘤位于十二指肠降部, 距离十二指肠大乳头2 cm以内, 行胰十二指肠切除术. 本组9例位于十二指肠降部, 且直径均>5 cm, 行胰十二指肠切除术. 近来也有一些新的治疗方法, 如经导管动脉栓塞(TAE)后使肿瘤缩小后行手术切除, 以减小手术难度[15]. 对于不能切除或转移性的GIST, 可使用甲磺酸伊马替尼. 一种通过选择性抑制酪氨酸激酶的第571号信号传导, 从而抑制间质瘤细胞的代谢和增殖, 并促进细胞的凋亡和死亡分子靶向药物. 80%-90%的患者在使用后能疾病进展能得到控制, 仅有10%-15%在使用药物后1年内死亡[16]. 格列卫与手术联合治疗间质瘤效果良好[17], 但有待于进一步深入研究和病例积累.
对于间质瘤的预后, Emory et al[18]提出的标准将间质瘤分为良性、恶性、交界性, 而事实上即使分类为良性的间质瘤也有一部分恶变. 因此Fletcher et al[8]认为所有间质瘤均有潜在恶性, 间质瘤应该以风险程度分级, 依据间质瘤的危险程度, 以肿瘤大小, 核分裂象多少为基础分级. Fletcher分级对间质瘤的分级评定更为全面合理. 本组资料不同Fletcher分级的肿瘤预后差异有显著性, 高风险组生存预后差. 另外单因素分析, 肿瘤直径, 核分裂象, 是否行根治术, 是否有远处转移影响预后. 虽然Emory et al[18]认为核分裂象并不是影响间质瘤预后的因素, 但本文多因素分析表明核分裂象是影响存活预后的独立预后因素, 可作为判断预后的依据, 从而指导术后的治疗. 对于核分裂象大于5个/50 HPF的患者, 应考虑术后及时联合格列卫治疗.
目前公认胃肠道间质瘤是胃肠道最常见的间叶源性肿瘤, 可发生在消化道的各个部位, 但发生于十二指肠的间质瘤很少, 国内外十二指肠间质瘤仅见少数报道, 临床上对其治疗和处理尚未形成标准, 特别是良恶性判断, 手术治疗方式及预后评估仍然是难点.
本文的实际应用价值是总结十二指肠的间质瘤治疗方式及预后评估, 有助于临床诊治的规范.
本文探讨了发生在十二指肠的间质瘤的临床特征和手术治疗方法, 具有较好的临床意义, 并对临床治疗提供了指导, 条理较清晰, 统计方法较严谨.
电编: 张敏 编辑:张焕兰
| 1. | Miettinen M, Lasota J. Gastrointestinal stromal tumors (GISTs): definition, occurrence, pathology, differential diagnosis and molecular genetics. Pol J Pathol. 2003;54:3-24. [PubMed] |
| 2. | Pidhorecky I, Cheney RT, Kraybill WG, Gibbs JF. Gastrointestinal stromal tumors: current diagnosis, biologic behavior, and management. Ann Surg Oncol. 2000;7:705-712. [PubMed] [DOI] |
| 4. | Cavallini M, Cecera A, Ciardi A, Caterino S, Ziparo V. Small periampullary duodenal gastrointestinal stromal tumor treated by local excision: report of a case. Tumori. 2005;91:264-266. [PubMed] |
| 5. | Goh BK, Chow PK, Ong HS, Wong WK. Gastroin-testinal stromal tumor involving the second and third portion of the duodenum: treatment by partial duodenectomy and Roux-en-Y duodenojejuno-stomy. J Surg Oncol. 2005;91:273-275. [PubMed] [DOI] |
| 6. | Sakakura C, Hagiwara A, Soga K, Miyagawa K, Nakashima S, Yoshikawa T, Kin S, Nakase Y, Yamaoka N, Sagara Y. Long-term survival of a case with multiple liver metastases from duodenal gastrointestinal stromal tumor drastically reduced by the treatment with imatinib and hepatectomy. World J Gastroenterol. 2006;12:2793-2797. [PubMed] [DOI] |
| 7. | 张 宗明, 李 刚, 高 原, 邢 海林, 朱 建平, 宿 砚明, 钟 华, 郭 金星, 杨 俊雄. 原发性十二指肠肿瘤诊治8例. 世界华人消化杂志. 2006;14:1330-1332. [DOI] |
| 8. | Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, Miettinen M, O'Leary TJ, Remotti H, Rubin BP. Diagnosis of gastrointestinal stromal tumors: A consensus approach. Hum Pathol. 2002;33:459-465. [PubMed] [DOI] |
| 9. | Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol. 1983;7:507-519. [PubMed] [DOI] |
| 10. | Chhieng DC, Jhala D, Jhala N, Eltoum I, Chen VK, Vickers S, Heslin MJ, Wilcox CM, Eloubeidi MA. Endoscopic ultrasound-guided fine-needle aspiration biopsy: a study of 103 cases. Cancer. 2002;96:232-239. [PubMed] [DOI] |
| 11. | DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brennan MF. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg. 2000;231:51-58. [PubMed] [DOI] |
| 12. | Pierie JP, Choudry U, Muzikansky A, Yeap BY, Souba WW, Ott MJ. The effect of surgery and grade on outcome of gastrointestinal stromal tumors. Arch Surg. 2001;136:383-389. [PubMed] [DOI] |
| 13. | Uehara K, Hasegawa H, Ogiso S, Sakamoto E, Shibahara H, Igami T, Ohira S, Mori T. Gastrointestinal stromal tumor of the duodenum: diagnosis and treatment. Geka. 2001;63:1058-1061. |
| 14. | Ludwig DJ, Traverso LW. Gut stromal tumors and their clinical behavior. Am J Surg. 1997;173:390-394. [PubMed] [DOI] |
| 15. | Sakamoto Y, Yamamoto J, Takahashi H, Kokudo N, Yamaguchi T, Muto T, Makuuchi M. Segmental resection of the third portion of the duodenum for a gastrointestinal stromal tumor: a case report. Jpn J Clin Oncol. 2003;33:364-366. [PubMed] [DOI] |
| 16. | Duffaud F, Blay JY. Gastrointestinal stromal tumors: biology and treatment. Oncology. 2003;65:187-197. [PubMed] [DOI] |
| 17. | Chen TW, Liu HD, Shyu RY, Yu JC, Shih ML, Chang TM, Hsieh CB. Giant malignant gastrointestinal stromal tumors: recurrence and effects of treatment with STI-571. World J Gastroenterol. 2005;11:260-263. [PubMed] [DOI] |
| 18. | Emory TS, Sobin LH, Lukes L, Lee DH, O'Leary TJ. Prognosis of gastrointestinal smooth-muscle (stromal) tumors: dependence on anatomic site. Am J Surg Pathol. 1999;23:82-87. [PubMed] [DOI] |