修回日期: 2006-08-01
接受日期: 2006-08-18
在线出版日期: 2006-10-18
目的: 探讨内毒素损伤时幼年大鼠体内超氧化物歧化酶(SOD)的变化及双歧杆菌的保护作用.
方法: ip内毒素制造内毒素损伤动物模型(模型组, E组), 治疗组(T组)提前7 d给予双歧杆菌灌胃, 同时设对照组(C组, ip生理盐水)和治疗对照组(Tc组, ip内毒素同时提前7 d给予生理盐水灌胃), 于不同时间点处死后观察大体及光镜下肠组织损伤变化, 同时检测血清和肠组织中SOD的活性.
结果: 双歧杆菌治疗组大鼠萎靡、食欲差、腹胀、腹泻、肠组织的充血水肿及肠管扩张情况均比模型组轻, HE染色光镜下可见肠绒毛损伤修复时间提前. 治疗组血清SOD活性6 h(2158.10±219.04), 12 h(2295.96±247.38)和24 h(2416.48±197.21)比模型组高(1644.66±240.38, 2016.40±147.03, 2108.42±225.55, P<0.05); 治疗组回肠组织SOD活性6 h (7604.69±662.80), 12 h(7573.85±780.66)比模型组高(6805.36±741.98, 6723.51±614.62, P<0.05).
结论: 双歧杆菌能减轻由内毒素损伤引起的幼年大鼠的肠组织改变, SOD活性增高进而抑制脂质过氧化损伤可能是其作用机制之一.
引文著录: 王玮, 李金梅, 马文旭, 孙梅. 双歧杆菌对内毒素损伤幼年大鼠抗氧化作用的影响. 世界华人消化杂志 2006; 14(29): 2844-2848
Revised: August 1, 2006
Accepted: August 18, 2006
Published online: October 18, 2006
AIM: To investigate the changes of superoxide dismutase (SOD) during the endotoxin-induced injuries in infant rats and the protective effect of bifidobacteria.
METHODS: A total of 160 rats were randomly and averagely divided into group C, E, Tc and and T. The rats in group E were intraperitoneally injected with lipopolysaccharide (LPS), and those in group T were intragastrically administrated with bifidobacteria suspension 7 d in advance. Meanwhile, the rats in group C were intraperitoneally injected with normal saline and those in group Tc were intragastrically administrated with normal saline 7 d before intraperitoneal injection of LPS. The tissue injuries of the ileum were observed under naked eyes and light microscope, and the serum and tissue SOD activity were detected at different time points.
RESULTS: The rats in group T had milder symptoms such as cachexia, anorexia, abdominal distention, diarrhea, intestinal congestion and edem, and distension of the intestine than those in group E. Light microscopy showed that the damaged intestinal villi were repaired in advance after hematoxylin and eosin staining. The serum SOD activity in group T was significantly higher than that in group E at 6, 12 and 24 h (2158.10 ± 219.04, 2295.96 ± 247.38, 2416.48 ± 197.21 vs 1644.66 ± 240.38, 2016.40 ± 147.03, 2108.42 ± 225.55; all P < 0.05). The tissue SOD activity in the ileum of group T was marked higher than that of group E at 6 and 12 h (7604.69 ± 662.80, 7573.85 ± 780.66 vs 6805.36 ± 741.98, 6723.51 ± 614.62; both P< 0.05).
CONCLUSION: Bifidobacteria can lessen the endotoxin-induced injuries of the ileum in infant rats, and the mechanism may be associated with the increase of SOD activity at well as the inhibition of lipid peroxidation.
- Citation: Wang W, Li JM, Ma WX, Sun M. Effect of bifidobacteria on the antioxidation in infant rats with endotoxin-induced injury. Shijie Huaren Xiaohua Zazhi 2006; 14(29): 2844-2848
- URL: https://www.wjgnet.com/1009-3079/full/v14/i29/2844.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i29.2844
双歧杆菌是人体主要的益生菌之一, 参与了宿主的消化、营养、代谢、吸收、免疫及抗感染过程, 尤其在维持机体肠黏膜屏障的完整性方面起重要作用[1-2]. 我们通过研究双歧杆菌对内毒素损伤幼鼠的抗氧化作用探讨其对肠道的保护机制.
双歧杆菌为婴儿双歧杆菌(Bifidobacterium infantis), 菌种编号KLDS 2.0002, 购自乳品科学教育部重点实验室(KLDS)-东北农业大学; 大肠杆菌精制内毒素(lipopolysaccharide, LPS, Escherichia coli O55: B5脂多糖, Sigma公司); 考马斯亮蓝蛋白测定试剂盒和超氧化物歧化酶(SOD)试剂盒购自南京建成生物工程研究所; Wistar大鼠由哈尔滨医科大学附属二院实验动物中心提供.
1.2.1 内毒素损伤动物模型制作: 健康18日龄Wistar大鼠160只, 平均体质量31.16±6.38 g, 雌雄不限, 进食鼠乳. 除对照组40只外均ip LPS 5 mg/kg[3-5], 配比浓度为5 mg/L, 用生理盐水溶解. 注射后仍送回母鼠笼内哺喂鼠乳.
1.2.2 实验分组: 实验动物随机分为4组, 每组40只. 对照组(C组)ip生理盐水1 mL/kg, 模型组(E组)ip LPS(5 mg/kg, 5 mg/L); 治疗组(T组)提前1 wk给予双歧杆菌混悬液(2.0×1012 cfu/L, 由乳品科学教育部重点实验室提供)灌胃, 每次0.5 mL, 每日2次, 直至实验结束[6-8]; 治疗对照组(Tc组)提前1 wk给予生理盐水灌胃, 每次0.5 mL, 每日2次, 直至实验结束. 分别于注射LPS或生理盐水后2, 6, 12, 24, 72 h断头处死动物, 留取血清和回肠组织(表1).
| 分组 | ip | 灌胃 |
| C组 | 生理盐水 | |
| E组 | 内毒素(LPS) | |
| T组 | 内毒素(LPS) | 双歧杆菌 |
| Tc组 | 内毒素(LPS) | 生理盐水 |
1.2.3 观察指标及测定方法: 各组动物于各时间点断头处死后, 取血, 3500 r/min离心15 min, 取上清-20 ℃保存. 距回盲部2-3 cm处留取0.5-1 cm回肠, 置于0.1 mol/L PBS配置的40 g/L多聚甲醛溶液中固定, 常规石蜡包埋, 切片, 常规苏木精-伊红(HE)染色, 观察形态学变化; 距回盲部3-4 cm处留取2-3 cm回肠, 冰生理盐水冲洗肠腔内容物后, 滤纸吸干水分, 称质量, 用生理盐水制成10 g/L匀浆, 3000 r/min离心10 min, 留上清-20 ℃保存. 血清和回肠组织SOD活性采用黄嘌呤氧化酶法, 回肠组织匀浆蛋白质含量测定采用考马斯亮蓝染色法, 具体操作严格按照试剂盒说明进行.
统计学处理 采用SPSS 10.0统计软件, 计量资料结果以mean±SD表示, 组间比较采用t检验法, P<0.05提示差异有显著性意义.
C组幼鼠反应及活动如常; E组及Tc组注射LPS后出现懒动、萎靡、食欲差, 1-2 h出现腹胀、腹泻, 6-12 h时上述症状加重, 同时出现呼吸促, 口唇青紫, 少动, 体毛凌乱、少光泽, 24 h时上述症状部分缓解, 72 h基本恢复正常; T组症状较模型组轻, 且恢复快.
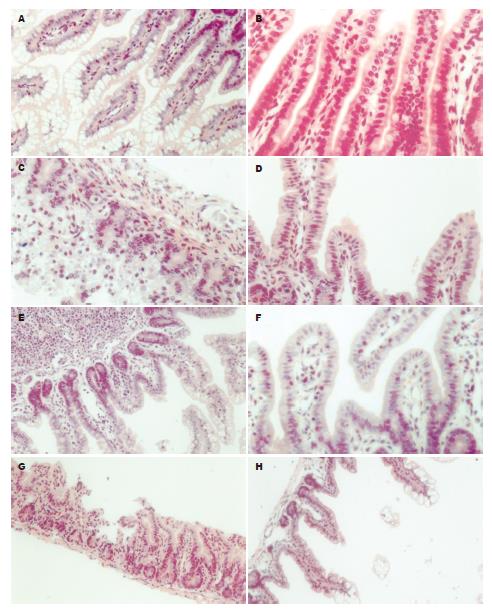
C组肠管有光泽, 颜色正常; E组及Tc组大体见胃滁留, 肠壁及肠系膜血管充血, 肠管扩张, 肠腔渗出物增多, 严重者见肠壁点、片状出血, 以6 h组表现明显; T组大体所见较以上表现减轻. HE染色光镜下C组肠绒毛完整, E组及Tc组2 h无明显异常, 6 h肠绒毛腺体脱落、缺失, 纹状缘变薄或缺失, 肠绒毛高矮不一, 密度减低, 固有层毛细血管充血, 炎细胞浸润, 12 h部分肠绒毛上皮细胞开始修复, 24 h修复明显, 72 h基本正常; T组6 h可见肠绒毛上皮细胞有修复, 部分肠管杯状细胞分泌亢进, 12 h修复明显, 24 h基本正常, 72 h修复完全或正常(图1).
E组SOD活性在6, 12, 24 h与C组比较有显著降低(P<0.05), T组SOD活性在2, 6, 12, 24 h与E组比较有显著升高(P<0.05), Tc组SOD活性在2, 6, 12, 24 h与T组比较有显著降低(P<0.05), Tc组与E组在各个时间点均无显著性差异(表2).
胃肠功能障碍在多器官功能衰竭的发展进程中起重要作用, 而肠黏膜屏障功能损伤是胃肠功能障碍发生的主要机制之一, 双歧杆菌是肠黏膜屏障中生物屏障的主要成分, 是人体主要的益生菌之一, 参与了宿主的消化、营养、代谢、吸收、免疫及抗感染过程, 尤其在维持机体肠黏膜屏障的完整性方面起重要作用. 消化道为人体最大的细菌库, 危重患者因禁食、使用制酸剂及抗生素等因素, 可破坏肠道内微生态稳定性, 由此引起的肠道菌群失调已成为细菌移位及肠源性感染的最主要原因[9]. 体外研究中, RT-PCR和Northern杂交证明双歧杆菌可刺激人肠腺上皮细胞β-防御素-2基因的表达, 并初步确定双歧杆菌胞壁及胞壁蛋白是其主要的活性成分[10]. 双歧杆菌分泌型黏附素能抑制LPS和H2O2对肠上皮的损害作用, 有效维持肠黏膜上皮细胞增殖与凋亡的平衡, 从而保持肠黏膜屏障功能的完整性[11]. 外源性双歧杆菌在肠道定植, 能拮抗潜在致病菌的过度增殖, 减少细菌和内毒素移位, 并能利用肠道谷氨酸合成谷氨酰胺, 有利于肠损伤的恢复[8]. 双歧杆菌作为肠黏膜的主要生物屏障, 目前对其抗菌机制的研究主要为以下3个方面: (1)产生有机酸, 能显著降低环境中的pH值, 使不耐酸的腐败菌和致病菌的生长繁殖受到抑制; (2)产生类似细菌素的蛋白质, 有一定的杀菌作用; (3)产生H2O2, 从而激活机体产生过氧化氢酶, 抑制和杀灭革兰阴性菌[12]. 生理情况下, 机体内自由基的生成与清除处于一种动态平衡中, 但在感染、创伤等病理状态下, 体内自由基生成增多[13], 从而引发强烈的脂质过氧化反应, 形成的脂质过氧化物损伤细胞膜, 造成细胞的损伤. SOD是体内重要的抗氧化酶, 与超氧阴离子(O2-)反应生成过氧化氢, 在酶促作用下转变成水, 因而可以清除体内的自由基, 保护细胞免受损伤. 有研究报道, 双歧杆菌表面分子脂磷壁酸(LTA)能明显增强衰老小鼠的脑组织SOD活性, 提高脑组织对自由基的清除能力, 阻断自由基的组织细胞损伤[14].
本研究表明, ip LPS可以使幼年大鼠血清SOD下降, 以6, 12, 24 h明显(P<0.05), 回肠组织匀浆SOD下降, 以6, 12, 24 h明显(P<0.05), 提前1 wk给予双歧杆菌混悬液灌胃, 可以减轻血清2, 6, 12, 24 h和回肠组织6, 12 h的SOD下降, 增加SOD活性, 抑制自由基的脂质过氧化反应, 保护肠道或促进肠损伤恢复. 双歧杆菌含有SOD, 而且经过长期驯化的兼性厌氧双歧杆菌SOD活性比初代分离的活性高[15], 本研究应用的双歧杆菌属于驯化后的兼性厌氧菌, 其自身含有SOD, 故灌服双歧杆菌引起的内毒素损伤幼鼠血清和回肠SOD增加是外源性还是内源性的机制还有待于进一步研究.
肠源性感染是儿科多脏器功能衰竭的重要致病因素. 双歧杆菌是肠黏膜屏障中生物屏障的主要成分, 目前对其抗菌机制的研究集中在产生有机酸, 产生过氧化氢, 产生类似细菌素的蛋白质, 对其确切的作用机制目前还不清楚.
体外实验证明, 双歧杆菌可刺激肠上皮细胞产生β-防御素-2; 亦有研究表明双歧杆菌能维持肠黏膜上皮细胞增殖与凋亡的平衡; 还有研究证实双歧杆菌可增加脑组织的SOD活性.
双歧杆菌目前多用于腹泻和肠菌群失衡的治疗. 本研究结果表明双歧杆菌可做为肠源性感染及多器官功能衰竭的辅助治疗.
本文针对研究热点, 设计合理, 研究方法得当, 结果真实可靠, 统计详实, 讨论分析逻辑性强, 文献引用详尽, 紧跟研究前沿, 实事求是. 但讨论的深度有待进一步提高.
电编: 张敏 编辑:王晓瑜
| 1. | Alvarez-Olmos MI, Oberhelman RA. Probiotic agents and infectious diseases: a modern perspective on a traditional therapy. Clin Infect Dis. 2001;32:1567-1576. [PubMed] [DOI] |
| 3. | Lee IK, Lee YM, Song IS, Chung SJ, Kim SG, Lee MG, Shim CK. Hepatobiliary excretion of tributylmethylamonium in rats with lipopolysa-ccharide-induced acute inflammation. Arch Pharm Res. 2002;25:969-972. [PubMed] [DOI] |
| 4. | Gitomer WL, Miller BC, Cottam GL. In vivo effects of lipopolysaccharide on hepatic free-NAD(P)(+)-linked redox states and cytosolic phosphorylation potential in 48-hour-fasted rats. Metabolism. 1995;44:1170-1174. [PubMed] [DOI] |
| 6. | Choi SS, Kang BY, Chung MJ, Kim SD, Park SH, Kim JS, Kang CY, Ha NJ. Safety assessment of potential lactic acid bacteria Bifidobacterium longum SPM1205 isolated from healthy Koreans. J Microbiol. 2005;43:493-498. [PubMed] |
| 7. | Eizaguirre I, Urkia NG, Asensio AB, Zubillaga I, Zubillaga P, Vidales C, Garcia-Arenzana JM, Aldazabal P. Probiotic supplementation reduces the risk of bacterial translocation in experimental short bowel syndrome. J Pediatr Surg. 2002;37:699-702. [PubMed] [DOI] |
| 8. | Caplan MS, Miller-Catchpole R, Kaup S, Russell T, Lickerman M, Amer M, Xiao Y, Thomson R Jr. Bifidobacterial supplementation reduces the incidence of necrotizing enterocolitis in a neonatal rat model. Gastroenterology. 1999;117:577-583. [PubMed] [DOI] |
| 9. | adfield RJ, Sinclair DG, Houldsworth PE, Evans TW. Effects of enteral and parenteral nutrition on gut mucosal permeability in the critically ill. Am J Respir Crit Care Med. 1995;152:1545-1548. [PubMed] [DOI] |
| 10. | 王 国兴, 冯 云, 汪 宇辉, 黄 宁, 吴 琦, 王 伯瑶. 双歧杆菌胞壁蛋白诱导人肠腺上皮细胞b-防御素-2 mRNA的表达. 四川大学学报( 医学版). 2003;34:622-624. |
| 12. | 梁 冰, 吴 力克, 姜 峰, 付 海波, 熊 德鑫, 修 淑丽. 双歧杆菌Q J405、乳杆菌Q J405在试管内对肠道致病菌抑杀效果的初步报告. 中国微生态学杂志. 2000;12:269-271. |
| 13. | Guegan C, Onteniente B, Makiura Y, Merad-Boudia M, Ceballos-Picot I, Sola B. Reduction of cortical infarction and impairment of apoptosis in NGF-transgenic mice subjected to permanent focal ischemia. Brain Res Mol Brain Res. 1998;55:133-140. [PubMed] [DOI] |