修回日期: 2006-04-11
接受日期: 2006-04-29
在线出版日期: 2006-10-18
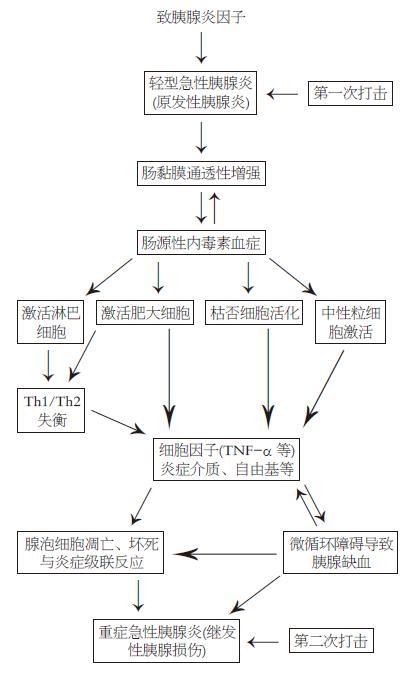
急性胰腺炎时由于禁食等因素使肠黏膜通透性升高, 形成肠源性内毒素血症(intestinal endotoxemia, IETM). 肠源性内毒素激活枯否细胞、中性粒细胞、肥大细胞与淋巴细胞释放多种细胞因子(如TNF-α)、炎性因子、氧自由基等, 引起炎症级联反应以及微循环障碍, 造成胰腺腺泡的凋亡与坏死. 总之, IETM对胰腺实施了"第二次打击", 故而发展成为重型急性胰腺炎.
引文著录: 韩德五. 肠源性内毒素血症在胰腺炎发病中的作用. 世界华人消化杂志 2006; 14(29): 2825-2829
Revised: April 11, 2006
Accepted: April 29, 2006
Published online: October 18, 2006
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2006; 14(29): 2825-2829
- URL: https://www.wjgnet.com/1009-3079/full/v14/i29/2825.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i29.2825
近年来, 对于急性胰腺炎(acute pancreatitis, AP), 特别是重型急性胰腺炎(serious acute pancreatitis, SAP)的研究, 已取得重要进展, 先后有"微循环障碍"[1]、"中性粒细胞过度激活"[2]、"肠道细菌移位"[3]、"自由基损伤"及"腺泡Ca2+超载"[4]等观点, 都从不同侧面和角度对SAP的发病进行了阐述. SAP多伴有肠源性内毒素血症(intestinal endotoxemia, IETM), 现已成为共识. 然而, IETM在SAP发病中有何等作用? 与已发表的诸多观点有何内在联系? 轻型胰腺炎是如何转化为重型胰腺炎的, 尚无更多报道.
根据我们以往大量实验证实, IETM的形成主要与肠黏膜通透性增高和肝脏枯否细胞(Kupffer cell, KC)吞噬功能减弱有关.
我们的实验用胰胆管逆行注射50 g/L牛磺胆酸钠建立SAP大鼠模型, 观察SAP时肠黏膜通透性的变化及其机制. 实验分为3组: 假手术组(SO)、禁食组(FD): 皮下注射100 g/L葡萄糖与9 g/L的生理盐水混合液20 mL, 禁食72 h, 与SAP组. 结果发现, FD组大鼠肠壁变薄, 肠绒毛变短变细, 肠上皮细胞严重缺损, 肠组织有淤血与出血现象, SAP组则更为严重. 通过血浆与小肠组织二胺氧化酶(DAO)测定也证实上述所观察的结果. FD组与SAP组血浆内毒素水平均明显高于SO组, 而SAP组又明显高于FD组. 统计学处理发现肠黏膜损伤与IETM密切相关. 在探讨肠黏膜通透性变化机制时, 发现SAP组的通透指数明显高于FD组, 肠上皮细胞凋亡数也较FD为多, 并与IETM呈正相关. 此外, 甲苯胺蓝染色结果显示, 呈激活状态的肥大细胞数量与脱颗粒现象在SAP组明显多于FD组, 此结果说明内毒素也可通过激活补体使肥大细胞活化, 脱颗粒释放组胺, 引起肠黏膜和血管通透性的增高与炎性反应增强, 从而使肠黏膜通透指数增高. 此项研究提示, 禁食组大鼠由于肠黏膜通透性增强使肠内的内毒素通过门静脉经肝脏进入体循环而形成IETM, IETM又反作用于肠黏膜使其上皮细胞凋亡, 此种恶性循环促使SAP大鼠形成更为严重的IETM. 因此, 对当前临床治疗SAP患者时采用禁食, 即所谓胃肠道外营养的得失提出质疑[5].
我们对SAP时KC是否被活化进行了研究. 实验分为3组: 假手术组、SAP组与GdCl3预处理组. 结果发现, SAP组大鼠血浆内毒素水平、TNF-α、NO、MDA均较GdCl3预处理组为高. SAP组大鼠KC吞噬指数和KC数量与假手术组无差异, 而GdCl3预处理组较SAP组明显减弱与减少. 病理组织学观察表明, SAP组大鼠肝组织出现点状坏死与凋亡, 后者从流式细胞仪检测也得到了证实. 然而, 经GdCl3预处理的SAP组大鼠未见明显肝损伤. 胰腺病理学检查证实SAP组大鼠胰腺发生了胰腺腺泡坏死并伴严重的炎症反应, 而经GdCl3预处理的胰腺未见有所减轻, 这与血清中AMS水平未见降低相一致. 此实验结果再次提示SAP时KC已被活化, 促使其分泌功能增强, 但吞噬功能未见增强. 在KC活化时伴有肝脏实质细胞的损伤, 这与临床所作的报道相一致[6].
在观察GdCl3预处理对微循环障碍的影响时发现SAP组大鼠血中ET-1, NO及ET-1/NO比值与TXA2与6-keto-PGF1α及其比值均较假手术组明显增高, 提示SAP组大鼠血中ET-1与TXA2水平占有优势, 提示微血管处于收缩状态. 而GdCl3预处理组大鼠上述两个比值均明显低于SAP组, 提示GdCl3预处理可使SAP动物微循环得到明显改善.
我们研究结果提示为此作了系统研究, 其实验共分假手术组、SAP组与双利肝, 甘氨酸治疗组. 双利肝由活血化淤药物丹参与清热解毒药物大黄所组成. 此实验是用他们的有效单体进行的. 这些药物均有降低血浆内毒素水平及抑制内毒素的生物学效应发挥的药效[7].
实验结果表明, 随着模型时间的延长, 血浆内毒素水平逐渐升高, 于3 h已形成IETM, 之后呈直线上升, 36 h后则呈缓慢上升趋势. 各时间点测定的内毒素水平与同时测定的TNF-α, IL-1β, NO及OFR水平相比较, 二者呈正相关, 并证实了主要是由于IETM激活KC所致. 实验结果表明, SAP组大鼠胰腺组织TNF-α mRNA的表达较假手术组明显上调, 而双利肝与甘氨酸治疗后则明显下调. 应用Western blot方法检测结果显示IETM可使胰腺组织iNOS和ICAM-1表达上调, 并与血浆内毒素呈正相关, 经双利肝与甘氨酸治疗后iNOS和ICAM-1表达均下调.
通过对SAP大鼠血清中ET-1, NO及ET-1/NO比值与TXA2与6-keto-PGF1α以及TXA2/6-keto-PGF1α比值的测定, 发现二者的比值均升高, 并与血浆内毒素呈正相关, 提示收缩微循环的因子占有主导地位. 在造模36 h后胰腺微血管内可看到大量蓝色丝状团块样的微血栓. 透射电镜下可见毛细血管基底膜与内皮细胞的肿胀与断裂. 全血黏度与最大血小板凝聚力增大, 并与血浆内毒素水平密切相关.
实验根据Th细胞产生的细胞因子如Th1细胞检测IL-12, IFN-γ, Th2细胞检测IL-4与IL-10, 并观察Th1/Th2 比值. 结果发现, SAP组Th1/Th2比值升高, 提示细胞免疫功能增强与促炎细胞因子占优势, 使胰腺腺泡细胞坏死与炎症反应加重. 而经双利肝与甘氨酸治疗后由于IL-10升高特别显著导致Th1/Th2比值趋于平衡, 炎症反应明显减轻.
SAP组大鼠胰腺出现片状坏死, 腺泡结构破坏, 伴有出血与炎症细胞浸润. 毛细血管内可见微血栓. 免疫组织化学观察还发现胰腺组织有大量的腺泡细胞凋亡[5], 透射电镜下可见腺泡细胞内线粒体肿胀, 嵴模糊不清或者断裂, 呈空泡样变. 内质网扩张与溶解. 细胞核变性, 染色体边集, 核周隙增宽等. 用双利肝与甘氨酸治疗后胰腺组织的损害明显减轻.
综合上面的实验结果发现: (1)在SAP早期(3 h)即伴有IETM, 并持续存在于发病的全过程; (2)IETM与SAP发病的诸多观点与学说存在着紧密的内在联系, 激活单核巨噬细胞、中性粒细胞等所释放的细胞因子(TNF-α, IL-1β等)、炎性递质与氧自由基等除加重腺泡细胞的坏死与炎症反应外, 还加重微循环障碍与Th1/Th2比值的失衡来影响SAP的发病过程. 因此可以认为IETM在SAP发病中起着关键作用. 双利肝与甘氨酸的治疗作用也从另一侧面证实了此点.
现有资料表明, 炎症启动的特征是参与炎症反应的细胞被激活. 这些细胞包括单核巨噬细胞(KC占据其80%)、中性粒细胞、肥大细胞、血小板和内皮细胞等. 内毒素的主要毒性成分脂多糖(LPS)与KC、中性粒细胞等细胞表面的受体结合, 启动多条信号转导通路: (1)激活转录因子NF-κB: NF-κB是一种能与多种基因启动子部位的κB位点发生特异性结合并能促进其转录的DNA结合蛋白的总称, 是调控多种炎性因子基因表达的枢纽[8]. 大量实验证实, NF-κB活化是AP时炎症递质过度表达和炎症反应的关键因素[9-10]. LPS等刺激因子可以引起IκB发生磷酸化进而降解使NF-κB二聚体与IκB解离, 并迅速从细胞质移位到细胞核, 启动相关基因转录. Ethridge et al[11]发现在AP动物模型中除了30 min NF-κB即有强烈的表达外, 在3-6 h NF-κB表达又出现第二个高峰. Han et al[12]实验证明, 所出现的两个高峰与LPS有关. LPS通过早期激活NF-κB和继发性激活AP-1加重炎症反应, 进一步说明NF-κB在炎症递质调解网络中发挥主要作用[13]. Fujioka et al[14]在体外实验也得出了同样结果. 由此可见, LPS激活中性粒细胞、KC和内皮细胞[15]的NF-κB导致大量炎症递质产生, 如IL-1, IL-6, IL-8, TNF-α, 细胞间黏附因子(ICAM-1), 血管黏附因子(VCAM-1), 氧自由基(OFR), iNOS, PAF, 粒-巨噬细胞集落刺激因子(GM-CSF), COX2及P, E选择素等而使AP进一步严重化, 并伴发全身炎症反应综合症(SIRS)和多器官功能衰竭(MOF), 进而成为AP患者致死的主要原因. 因此选用特异性的NF-κB抑制剂阻断NF-κB激活的信号转导通路, 可能为防止AP的发展提供了可能[16]. (2)激活MAPK家族, 尤其是p38: p38MAPK信号转导通路可与NF-κB通路在下游聚合, 调控细胞因子的产生, 故在AP发展中起着极其重要的作用. Dabrowski et al[17]发现活性氧(ROS)可显著激活MAPK胰腺腺泡p38MAPK. Liu et al[18]在牛磺胆酸钠诱导AP模型中发现巨噬细胞MAPK活性增强, 同时伴有NF-κB的激活. Murr et al[19]用弹性蛋白酶刺激KC在7 min即可检测出磷酸化的p38MAPK, SAPK/JNK和ERK1/2, 以及活化的NF-κB和TNF-α的表达. 然而在60 min时NF-κB和TNF-α回落, 而p38MAPK仍处于活化状态. O'Neill et al[20]发现p38MAPK持续的激活可引起炎性因子的不断产生, 而导致级联"瀑布"效应, 并由此导致SIRS, MOF的发生. 抑制p38MAPK信号转导能发挥有效的抗炎作用, 减少细胞因子, 炎症递质的释放, 减轻胰腺腺泡细胞损伤, 明显提高动物的生存率[21-22]. 此外, TNF-α, IL-1β等促炎细胞因子可进一步激活白细胞和内皮细胞, 使其表达黏附分子, 并可使中性粒细胞出现吞噬活性, 释放蛋白水解酶和氧自由基, 从而导致炎性反应的扩大.
研究发现, IETM伴有高组胺血症. 其机制是内毒素通过旁路途径激活补体, 形成过敏毒素C3a, C5a为主的补体片段, 促使肥大细胞脱颗粒而释放组胺. 组胺可抑制IL-12的表达, 也可抑制LPS诱导单核细胞产生IFN-γ, 但可增加IL-4与IL-10的生成. 组胺与多种细胞因子之间的互相调节, 具有抑制Th1型细胞因子的分泌及向Th2型转换的特点[23]. LPS激活肥大细胞的主要途径是通过其膜上的Toll样受体. 肥大细胞在LPS作用下, 可快速释放出已储存在颗粒中的和新合成的TNF-α, 组胺, 白三烯B4, 白三烯C4, IL-1α, IL-1β, IL-8等, 使中性粒细胞与嗜酸性粒细胞聚集在炎症部位. 肥大细胞过量释放炎症介质和细胞因子有助于引发"瀑布式级联反应", 造成组织细胞的炎症损伤. 肥大细胞释放的组胺和蛋白水解酶能使血管通透性增高, 血管内皮细胞黏附分子的表达明显升高, 从而加重局部的炎症反应. 总之, 肥大细胞同巨噬细胞、中性粒细胞一样具有多种免疫功能[24].
近年来的研究显示, SAP并不是简单的"胰酶自身消化"的结果, 而更多的与免疫异常有关. Th细胞是免疫应答的中心细胞, 他不但是机体免疫应答的启动细胞, 而且其活性对整个免疫应答具有重要的调节作用. Th1与Th2细胞主要是通过分泌的细胞因子发挥其生物学效应. 成熟的Th1细胞分泌IL-1, IL-2, IL-12, TNF-α, IFN-γ等细胞因子, 以促炎症介质为主, 故又称之为炎症性T细胞, 主要介导细胞免疫. 一般认为Th1应答能增强宿主抗微生物感染. 成熟的Th2细胞分泌IL-4, IL-5, IL-6, IL-10等细胞因子, 以抗炎症介质为主, 主要介导体液免疫应答, 与炎症的持续、进展和慢性化有关. Th1和Th2细胞通过各自分泌的细胞因子, 进行交叉调节, 相互抑制. 在SAP的早期, 机体以Th1优势应答为主要病理改变, 表现为多种促炎介质升高, 可导致全身炎症反应综合征(SIRS); 在SAP的中晚期, Th1细胞功能普遍降低, 而Th2细胞功能明显升高, Th1向Th2型细胞漂移. 由于Th1/Th2细胞因子形成动态的复杂的网络, Th1/Th2失衡会造成"瀑布样级联反应", 导致免疫异常贯穿病程始终[25].
SAP时微循环障碍(MCD)已不仅局限于胰腺组织本身, 而且已经累及全身各个器官, 并可以诱发多器官功能不全(MOD)或衰竭(MOF)[26]. 至今对微循环障碍在AP发病过程中是启动还是促进因素这个问题仍在争议. AP时胰腺微血管运动失调, 血管收缩(失血)与血管扩张(再灌注再氧化)参与胰腺炎的发病. 因此, 缺血再灌注损伤在胰腺微循环障碍中的作用已倍受关注. 有人提出胰腺炎时血浆中NO/ET的失调是引起微血管运动失调的重要因素[27]. 在AP早期毛细血管的通透性就明显增加, 炎症递质如PAF, ICAM, ET, OFR等均参与了此过程. Eibl et al[28]在SAP动物上应用以上炎症递质的相应抗体或受体拮抗时发现微循环障碍明显改善, 也提示炎症递质在MCD中的重要地位. 我们通过降低IETM水平可使炎症递质释放减少, 毛细血管淤滞减轻, 微血栓减少, 血液黏度减轻, 使MCD明显改善, 与此同时NO/ET比值亦近于正常.
目前有诸多学说, 如胰酶自身消化学说, 细菌移位和继发感染学说, 微循环障碍学说, 白细胞过度激活学说, 氧自由基学说, 细胞因子和炎症递质学说等都是从不同角度或侧面来阐明AP的发病机制, 故用单一学说难以解释AP发病机制的全部. IETM在AP发病机制中与上述各学说有着直接或间接的联系. 换言之, IETM在AP发病机制网络中处于中心地位.
总之, SAP所伴的IETM激活KC、中性粒细胞、肥大细胞与淋巴细胞释放大量细胞因子、炎症介质与自由基等引起炎症级联反应, 从而通过炎症反应扩大, Th1/Th2失衡与微循环障碍等又对原来的胰腺炎实施"第二次打击"使之转化为重症急性胰腺炎(图1). 这与我们多年研究的IETM对肝脏的作用相一致: 各种肝损伤因子通过不同机制引起原发性肝损伤, 后者所出现的IETM又使肝脏经受第二次打击而发生继发性肝损伤, 后者或使肝炎重型化, 或使其慢性化, 最终以肝衰竭而告终[29].
近年来对于急性胰腺炎(AP), 特别是重型急性胰腺炎(SAP)的研究, 已取得重要进展, 先后有"微循环障碍"、"中性粒细胞过度激活"、"肠道细菌移位"、"自由基损伤"及"腺泡Ca2+超载"等观点, 都从不同侧面和角度对SAP的发病进行了阐述. SAP多伴有肠源性内毒素血症(IETM), 现已成为共识.
本文从肠源性内毒素血症(IETM)角度探讨重症急性胰腺炎(SAP)的发病机制过程中, 发现IETM与现已发表的诸多学说, 如胰腺微循环障碍学说、白细胞过度激活学说、细胞因子级联反应学说、肠道细菌移位-胰腺组织继发感染学说等均有着因果联系, 并在其中发挥着中心作用, IETM对胰腺发挥"二次打击"的作用, 为防治SAP提供新的思路.
本文对IETM在SAP发病中的作用进行了全面系统的综述, 文章层次分明, 文笔流畅, 内容新颖, 有可读性. 对SAP的实验研究和临床诊治均有一定的指导价值.
电编: 张焕兰 编辑:潘伯荣
| 1. | Klar E, Messmer K, Warshaw AL, Herfarth C. Pancreatic ischaemia in experimental acute pancreatitis: mechanism, significance and therapy. Br J Surg. 1990;77:1205-1210. [PubMed] [DOI] |
| 2. | Rinderknecht H. Fatal pancreatitis, a consequence of excessive leukocyte stimulation? Int J Pancreatol. 1988;3:105-112. [PubMed] |
| 3. | Wang X, Andersson R. Intestinal brush border membrane function. Scand J Gastroenterol. 1994;29:289-299. [PubMed] [DOI] |
| 7. | 韩 德五. 肠源性内毒素血症与肝病: 肝衰竭的IETM学说. 北京: 中国科学技术出版社 2004; 34-41. |
| 8. | Storz P, Toker A. NF-kappaB signaling--an alternate pathway for oxidative stress responses. Cell Cycle. 2003;2:9-10. [PubMed] [DOI] |
| 9. | Virlos I, Mazzon E, Serraino I, Di Paola R, Genovese T, Britti D, Thiemerman C, Siriwardena A, Cuzzocrea S. Pyrrolidine dithiocarbamate reduces the severity of cerulein-induced murine acute pancreatitis. Shock. 2003;20:544-550. [PubMed] [DOI] |
| 10. | Hietaranta A, Mustonen H, Puolakkainen P, Haapiainen R, Kemppainen E. Proinflammatory effects of pancreatic elastase are mediated through TLR4 and NF-kappaB. Biochem Biophys Res Commun. 2004;323:192-196. [PubMed] [DOI] |
| 11. | Ethridge RT, Hashimoto K, Chung DH, Ehlers RA, Rajaraman S, Evers BM. Selective inhibition of NF-kappaB attenuates the severity of cerulein-induced acute pancreatitis. J Am Coll Surg. 2002;195:497-505. [PubMed] [DOI] |
| 12. | Han SJ, Ko HM, Choi JH, Seo KH, Lee HS, Choi EK, Choi IW, Lee HK, Im SY. Molecular mechanisms for lipopolysaccharide-induced biphasic activation of nuclear factor-kappa B (NF-kappa B). J Biol Chem. 2002;277:44715-44721. [PubMed] [DOI] |
| 13. | Krappmann D, Wegener E, Sunami Y, Esen M, Thiel A, Mordmuller B, Scheidereit C. The IkappaB kinase complex and NF-kappaB act as master regulators of lipopolysaccharide-induced gene expression and control subordinate activation of AP-1. Mol Cell Biol. 2004;24:6488-6500. [PubMed] [DOI] |
| 14. | Fujioka S, Niu J, Schmidt C, Sclabas GM, Peng B, Uwagawa T, Li Z, Evans DB, Abbruzzese JL, Chiao PJ. NF-kappaB and AP-1 connection: mechanism of NF-kappaB-dependent regulation of AP-1 activity. Mol Cell Biol. 2004;24:7806-7819. [PubMed] [DOI] |
| 15. | Mole DJ, Taylor MA, McFerran NV, Diamond T. The isolated perfused liver response to a 'second hit' of portal endotoxin during severe acute pancreatitis. Pancreatology. 2005;5:475-485. [PubMed] [DOI] |
| 16. | Pezzilli R, Ceciliato R, Barakat B, Corinaldesi R. Immune-manipulation of the inflammatory response in acute pancreatitis. What can be expected? JOP. 2004;5:115-121. [PubMed] |
| 17. | Dabrowski A, Boguslowicz C, Dabrowska M, Tribillo I, Gabryelewicz A. Reactive oxygen species activate mitogen-activated protein kinases in pancreatic acinar cells. Pancreas. 2000;21:376-384. [PubMed] [DOI] |
| 18. | Liu HS, Pan CE, Liu QG, Yang W, Liu XM. Effect of NF-kappaB and p38 MAPK in activated monocytes/macrophages on pro-inflammatory cytokines of rats with acute pancreatitis. World J Gastroenterol. 2003;9:2513-2518. [PubMed] |
| 19. | Murr MM, Yang J, Fier A, Gallagher SF, Carter G, Gower WR Jr, Norman JG. Regulation of Kupffer cell TNF gene expression during experimental acute pancreatitis: the role of p38-MAPK, ERK1/2, SAPK/JNK, and NF-kappaB. J Gastrointest Surg. 2003;7:20-25. [PubMed] [DOI] |
| 20. | O'Neill S, O'Neill AJ, Conroy E, Brady HR, Fitzpatrick JM, Watson RW. Altered caspase expression results in delayed neutrophil apoptosis in acute pancreatitis. J Leukoc Biol. 2000;68:15-20. [PubMed] |
| 21. | Yan SR, Al-Hertani W, Byers D, Bortolussi R. Lipopolysaccharide-binding protein- and CD14-dependent activation of mitogen-activated protein kinase p38 by lipopolysaccharide in human neutrophils is associated with priming of respiratory burst. Infect Immun. 2002;70:4068-4074. [PubMed] [DOI] |
| 22. | English JM, Cobb MH. Pharmacological inhibitors of MAPK pathways. Trends Pharmacol Sci. 2002;23:40-45. [PubMed] [DOI] |
| 26. | Foitzik T, Eibl G, Hotz B, Hotz H, Kahrau S, Kasten C, Schneider P, Buhr HJ. Persistent multiple organ microcirculatory disorders in severe acute pancreatitis: experimental findings and clinical implications. Dig Dis Sci. 2002;47:130-138. [PubMed] [DOI] |
| 27. | Vollmar B, Menger MD. Microcirculatory dysfunction in acute pancreatitis. A new concept of pathogenesis involving vasomotion-associated arteriolar constriction and dilation. Pancreatology. 2003;3:181-190. [PubMed] [DOI] |
| 28. | Eibl G, Buhr HJ, Foitzik T. Therapy of microcirculatory disorders in severe acute pancreatitis: what mediators should we block? Intensive Care Med. 2002;28:139-146. [PubMed] [DOI] |
| 29. | Han DW. Intestinal endotoxemia as a pathogenetic mechanism in liver failure. World J Gastroenterol. 2002;8:961-965. [PubMed] [DOI] |