修回日期: 2006-08-10
接受日期: 2006-08-23
在线出版日期: 2006-10-08
目的: 研究瘦素受体(Ob-R)在结直肠腺癌组织中的表达, 探讨Ob-R在肿瘤血管生成中的作用及其可能机制.
方法: 免疫组织化学方法检测35例结直肠腺癌组织、24例结直肠腺瘤组织和35例正常对照组织中Ob-R、CD105、核转录因子-κBp65(NF-κBp65)的表达, 以图像分析软件进行半定量测定.
结果: 以CD105标记的微血管密度(MVD)在癌症组、腺瘤组、正常对照组间呈递减改变(23.63±2.08 vs 10.83±1.25 vs 1.97±0.37, P<0.05). Ob-R和NF-κB(p65)的表达部位相似. 癌症组中Ob-R和NF-κB(p65)的积分光密度均比对照组高(27.41±2.21 vs 20.45±1.63, 45.88±5.46 vs 29.11±3.89, P<0.05). 癌症组中Ob-R, NF-κBp65的积分光密度, MVD三者间呈两两正相关. 癌症组63.6%的标本中可见Ob-R血管内皮细胞染色阳性, 其MVD较阴性者高(38.21±2.78 vs 27.50±2.95, t = 2.602, P<0.05); 68.6%的癌症标本中可见NF-κBp65血管内皮细胞核表达阳性, 其MVD较阴性者高(37.53±3.07 vs 28.42±2.63, t = 2.146, P<0.05). Ob-R和NF-κBp65的表达与结直肠腺癌临床病理因素间未见相关性.
结论: 结直肠腺癌组织中Ob-R表达增多对肿瘤血管生成起促进作用, 并且该作用可能是通过NF-κB途径来实现的.
引文著录: 熊枝繁, 晏泽辉. 瘦素受体与核转录因子-κB在结直肠腺癌组织中的表达及意义. 世界华人消化杂志 2006; 14(28): 2759-2764
Revised: August 10, 2006
Accepted: August 23, 2006
Published online: October 8, 2006
AIM: To investigate the expression of leptin receptor (Ob-R) in colorectal adenocarcinoma, and explore its role in the tumor angiogenesis and the possible mechanism.
METHODS: Immumohistochemical staining was performed to detect the expression of Ob-R, CD105, and nuclear factor-kappa B p65 (NF-kBp65) in colorectal adenocarcinoma (n = 35), colorectal adenoma (n = 24) and normal controls (n = 35). Image analysis software was used for semi-quantitative assessment.
RESULTS: The microvessel density (MVD) marked by CD105 was decreased progressively from cancer patients, adenoma patients and normal controls (23.63 ± 2.08 vs 10.83 ± 1.25 vs 1.97 ± 0.37, P < 0.05). Ob-R and NF-kBp65 were expressed at the similar location. The integrated optical densities of Ob-R and NF-kBp65 in cancer patients were both higher than those in the normal controls (27.41 ± 2.21 vs 20.45 ± 1.63, P < 0.05; 45.88 ± 5.46 vs 29.11 ± 3.89, P < 0.05). A significant association was found between either two of MVD, the integrated optical densities of Ob-R and NF-kBp65 in cancer patients. The positive expression of Ob-R was found in 63.6% cases of cancer patients, and their mean MVD was higher than that in the negative ones (38.21 ± 2.78 vs 27.50 ± 2.95, t = 2.602, P < 0.05). The positive expression of NF-kBp65 was observed on the nucleus of vascular endothelial cells in 68.6% cases of cancer patients, and their mean MVD was higher than that in the negative ones (37.53 ± 3.07 vs 28.42 ± 2.63, t = 2.146, P < 0.05). The expression of Ob-R and NF-kB had no marked correlations with the clinicopathological agents of colorectal adenocarcinoma.
CONCLUSION: The increased expression of Ob-R contributes to the angiogenesis in colorectal adenocarcinoma, probably through activation of NF-kB pathways.
- Citation: Xiong ZF, Yan ZH. Expression of leptin receptor and nuclear factor kappa B and their significances in colorectal adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(28): 2759-2764
- URL: https://www.wjgnet.com/1009-3079/full/v14/i28/2759.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i28.2759
多种恶性肿瘤包括结直肠癌在内的患病风险与肥胖相关, 研究显示脂源性因子的异常表达可能在其中起作用[1-2]. 瘦素(leptin)是一种新发现的脂源性激素, 与其受体结合后产生多种效应, 其促癌作用在体外和动物实验中得到证实, 但在人癌症组织中的研究报道较少. CD105是一种与增生有关的内皮细胞胞膜抗原, 在与肿瘤有关的新生血管内皮强烈表达. 研究证实对于肿瘤新生微血管密度(MVD)的标记, CD105优于常用的泛血管标记物[3]. 核转录因子-κB(NF-κB)可通过多个环节促进肿瘤血管生成. 本研究旨在通过应用免疫组织化学方法检测结直肠腺癌、腺瘤及正常大肠组织中瘦素受体(Ob-R), CD105, NF-κBp65的表达, 探讨瘦素受体在结直肠癌组织中表达及其在血管生成中的作用和可能机制.
收集同济医院2005-09/2006-01手术切除的结直肠腺瘤组织标本24例, 结直肠腺癌组织标本35例, 同时取其手术断端作为正常对照组织. 35例结直肠癌患者年龄为29-78(平均59.2)岁, 男21例, 女14例. 24例结直肠腺瘤患者年龄为30-77(平均57.8)岁, 男11例, 女13例. 两组间年龄差异无统计学意义. 所有病例患者均无糖尿病、糖耐量异常病史, 术前均未作放疗和化疗. 所有癌组织均经病理检验确诊, 并按国际癌症Ð会所定的标准行分化程度分级和Dukes分期, 所有断端组织均未发现癌细胞. 标本均经40 g/L中性甲醛溶液固定后常规石蜡包埋, 4 μm连续切片备用. 羊抗人Ob-R多克隆抗体为美国Santa Cruz公司产品; 鼠抗人CD105单克隆抗体及兔抗人NF-κBp65多克隆抗体为北京中山生物技术公司产品. HMIAS-2000型全自动彩色图像分析系统为华中科技大学同济医学院千屏影像公司产品.
1.2.1 免疫组织化学方法检测Ob-R, NF-κBp65的表达: 采用链霉亲合素-生物素-过氧化物酶复合物法(SABC法)对Ob-R, NF-κBp65蛋白表达进行检测. 对NF-κBp65检测时不进行苏木精复染. 以PBS代替一抗作为阴性对照.
1.2.2 新生微血管染色及定量: 以抗CD105单克隆抗体行免疫组化(SABC法)染色对新生微血管进行标记. 参照Weidner et al[4]报道的方法, 以与背景明显有别的任何一个棕黄色染色的内皮细胞或细胞丛作为一个血管, 只要结构不相连续, 分支结构也作为一个血管计数. 先在低倍镜下观察切片全部视野, 找到肿瘤间质血管密度最高区域, 再转到高倍镜(20×10, 0.739 mm2/每视野)下精确计数微血管数量. 记录3个视野内的微血管数, 取其平均值作为该标本的MVD值.
统计学处理 使用HMIAS-2000型全自动彩色图像分析系统对标本免疫组化染色结果进行图像分析. 实验数据分别采用方差分析、成组t检验、Pearson相关分析, 应用SPSS 12.0统计软件进行统计学处理.
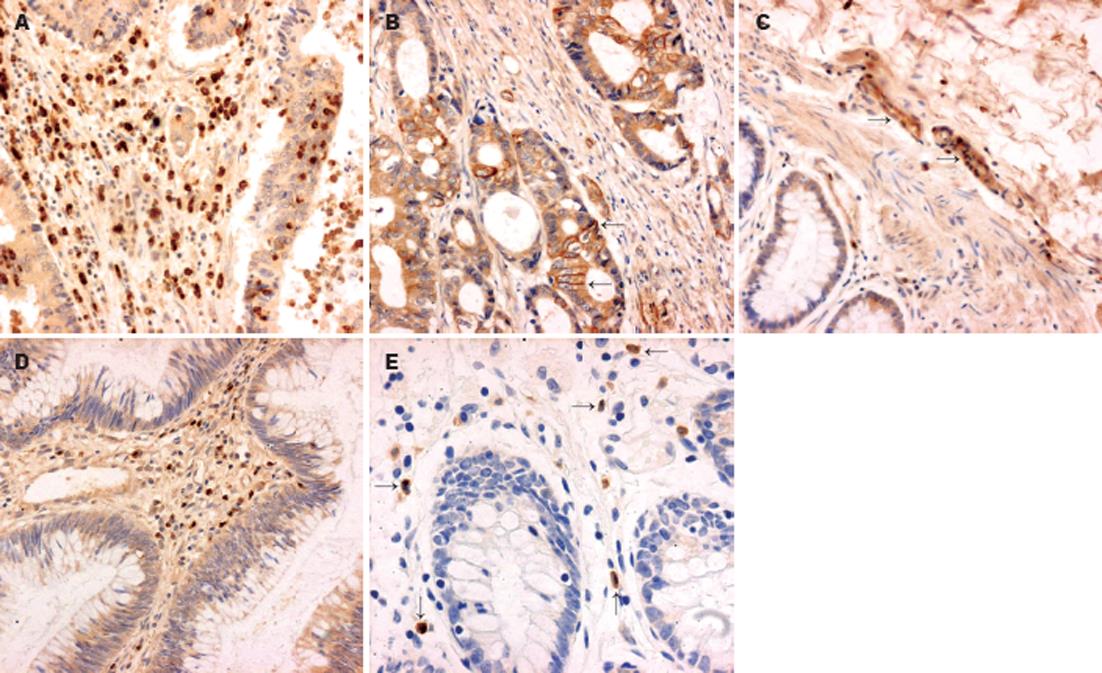
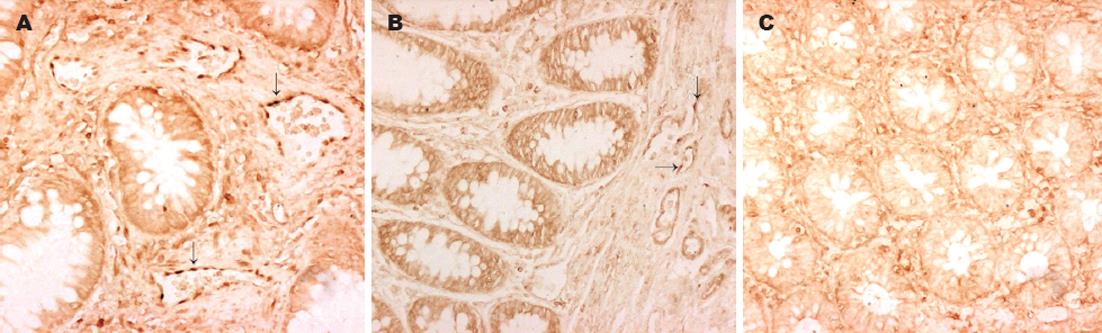
Ob-R在绝大部分癌症组标本(33/35, 94.3%)中可见着色, 呈棕黄色定位于细胞膜和细胞质中. 阳性细胞呈弥漫分布, 大部分位于腺癌组织间质(图1A), 少部分位于腺癌腺体(图1B), 间质阳性细胞染色深度明显大于腺体阳性细胞. 部分间质血管内皮细胞也可见着色(21/33, 63.6%, 图1C). 部分腺瘤组标本(17/24, 70.8%, 图1D)和部分正常对照组标本(19/35, 54.3%, 图1E)中也可见着色, 阳性细胞较少, 散在分布于间质. 染色积分光密度在癌症组与正常对照组间的差异有统计学意义(表1). NF-κBp65在癌症组中(35/35, 100%)广泛表达于腺癌腺体和间质, 呈棕黄色定位于细胞质和细胞核中. 腺体细胞染色多位于细胞质中, 较浅且均匀; 而间质细胞特别是血管内皮细胞(24/35, 68.6%)则可见明显细胞核染色(图2A), 棕黄色浓集于细胞核. 部分腺瘤组标本(19/24, 79.2%)有阳性表达, 少数可见血管内皮细胞核阳性染色(图2B). 正常对照组中也有部分呈阳性表达(26/35, 74.3%, 图2C), 但染色浅, 均匀分布于细胞质中. 癌症组与正常对照组相比, 染色积分光密度的差异有显著性(表1).
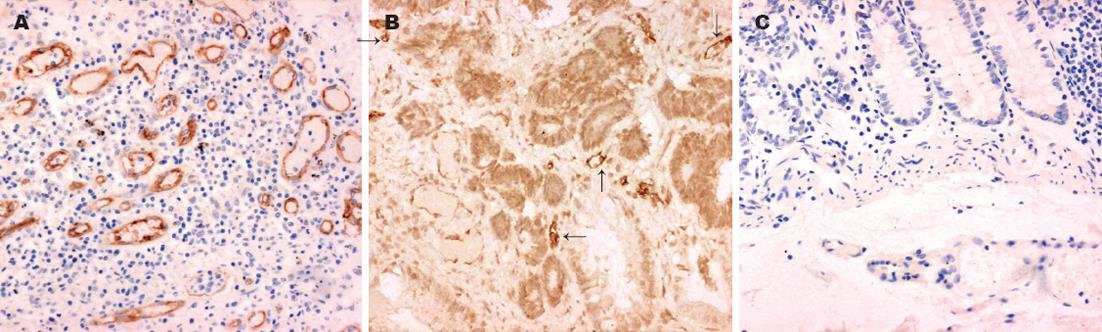
癌症组和腺瘤组标本的CD105染色石蜡切片中, 可见众多微血管内皮细胞的胞膜和胞质呈阳性着色. 阳性反应的微血管分布不均匀, 多局限于肿瘤实质边缘的间质, 即新生血管生成区域. 其管腔多不规则, 壁薄且无平滑肌组织出现(图3A-B). 切片中可见到陷于癌组织中的正常血管, 管腔较大, 管壁可见数层平滑肌细胞, 这些血管的内皮细胞不与CD105抗体发生反应或仅有微弱的反应, 着色强度明显低于新生血管内皮细胞. 正常对照组织的血管内皮呈阴性或微弱阳性表达(图3C), 三组所测的微血管密度(MVD)两两间均有显著性差异(表1).
35例癌症组织中Ob-R和NF-κBp65的染色积分光密度, 二者呈正相关(r = 0.577, P<0.05); Ob-R的染色积分光密度与MVD值呈正相关(r = 0.673, P<0.05); NF-κBp65的染色积分光密度与MVD值也呈正相关(r = 0.396, P<0.05). 在Ob-R阳性的癌症组标本中, 血管内皮细胞染色阳性者(21/33, 63.6%)其MVD较阴性者高(38.21±2.78 vs 27.50±2.95, P<0.05); NF-κBp65血管内皮细胞核染者(24/35, 68.6%)其MVD较未核染者高(37.53±3.07 vs 28.42±2.63, P<0.05)(表2).
Ob-R, NF-κBp65的表达在结直肠腺癌高、中、低分化组间, 及Dukes分期间的差异无显著性. MVD在高、中、低分化组间呈递增改变; 淋巴结转移及远处转移组(C+D期)的MVD大于非淋巴结转移组(A+B期), 差异有统计学意义(P<0.05, 表3).
瘦素是新发现的一种脂源性激素, 研究发现瘦素具有广泛的生物学功能, 在与其受体(Ob-R)结合后产生多种效应. 瘦素与肿瘤的研究显示, 瘦素可促进多种肿瘤细胞增殖、抗凋亡、增强侵袭力. 但肿瘤的生长和转移不仅需要肿瘤细胞增殖, 而且与肿瘤内新生血管形成关系密切. 新生血管不仅为肿瘤生长提供必需的养料并转运其代谢产物, 而且为肿瘤细胞进入循环系统提供了通道, 还能通过内皮细胞分泌的生长因子来促使肿瘤细胞增殖. 体外实验发现, 瘦素可剂量依赖性地促进血管内皮细胞增生、聚集并逐渐形成管状[5]. 动物实验也显示, 瘦素具有促进血管增生的作用[6]. 但瘦素在肿瘤血管生成中的作用机制的研究报道尚少. 本实验结果显示, 癌症组MVD高于腺瘤组, 腺瘤组MVD高于正常对照组, 说明结直肠组织癌变过程中确实存在血管生成的增加. Ob-R主要在组织间质表达, 癌症组明显强于正常对照组, 此结果与国外报道一致[7], 并且在Ob-R与肝细胞癌的研究中也有相似的结果[8]. 本实验中还发现癌症组Ob-R的染色积分光密度与MVD值呈正相关, 并且Ob-R血管内皮染色阳性者其MVD较阴性者高. 说明结直肠腺癌组织血管内皮细胞和其他间质细胞上表达的Ob-R, 在促进肿瘤组织血管生成方面可能有其作用. 此结论与体外实验结果一致.
NF-κB通常由p50和p65亚基组成, 静息时, 通过与抑制蛋白IκB结合形成无活性的三聚体存留于胞质. 在受到刺激而激活后, IκB解离, NF-κB进入细胞核, 作用于靶基因, 迅速诱导靶基因表达. 其作为一个多向性转录调节因子, 可调控多种生长因子、黏附分子、细胞因子的表达. 本实验结果中可见, NF-κBp65在结直肠腺癌和腺瘤组织的间质细胞特别是血管内皮细胞的细胞核表达, 代表了NF-κB处于激活状态. 且NF-κB在血管内皮细胞核染者的MVD较未核染者高, 说明激活的NF-κB在肿瘤组织血管生成中起了一定的作用. 同时我们可以观察到Ob-R与NF-κB的表达部位相一致, 半定量分析也显示二者呈正相关, 提示瘦素与Ob-R结合后促使NF-κB表达和激活. 这与体外细胞实验中瘦素处理后NF-κB活化增加的结果一致[9]. 我们观察到Ob-R和NF-κBp65的表达在正常对照组、腺瘤组、癌症组中呈递增趋势, 但腺瘤组与其他两组间的差异无显著性. 除MVD外, 亦未发现Ob-R, NF-κBp65与结直肠腺癌分化程度、Dukes分期等临床病理因素之间有相关性. 这可能与本实验样本例数较少, 以及肿瘤血管生成的机制复杂, 而Ob-R, NF-κBp65的促血管生成作用仅为其中的一部分作用等原因有关, 尚待扩大样本, 增加观察指标进行进一步研究. 肿瘤血管生成包括血管内皮细胞的迁移、黏附、增殖以及管状结构形成等一系列复杂过程. 研究表明, NF-κB促进基质金属蛋白酶MMP2, MMP9表达[10], 从而加速血管下基底膜的降解, 有利于内皮细胞的迁移. NF-κB还可增强细胞周期蛋白D的表达, 促进血管内皮细胞增殖[11]. 此外, 已证明在VEGF, IL-1α, IL-8, TNF-α, VCAM-1等多种促血管生成因子的基因中含有NF-κB的特异性结合位点, 其表达受NF-κB的调控. 并且还有研究报道用同源基因GAX抑制血管内皮细胞的NF-κB激活后, 血管生成也被抑制了[12]. 可见, NF-κB可通过多个环节促进肿瘤血管生成. 本实验结果也显示, 癌症组NF-κB的染色积分光密度与MVD值呈正相关. 我们推测, 瘦素与表达在结直肠腺癌组织间质血管内皮细胞和其他间质细胞上的Ob-R结合后, 可能通过激活NF-κB, 直接或间接地促进肿瘤血管生成.
总之, 结直肠腺癌组织中Ob-R表达增多对肿瘤血管生成起促进作用, 并且该作用可能是通过NF-κB途径来实现的. Ob-R和NF-κB可能为抗肿瘤血管生成治疗提供了新的靶点.
多种恶性肿瘤的患病风险与肥胖相关, 据研究, 肥胖者(BMI≥30)患结直肠癌的风险是非肥胖者的1.5-2.0倍. 研究显示, 脂源性因子的异常表达可能在其中起作用. 瘦素是1994年才发现的一种新的脂源性激素, 其与肿瘤的关系近年来越来越受到人们的重视, 并且其促瘤作用得到了初步的验证.
关于瘦素的研究主要集中在其在各种肿瘤中对细胞生长、凋亡、肿瘤侵袭性、血管生成等方面的作用及其机制.
Hardwick et al研究显示, 瘦素受体在结肠癌细胞系及结肠组织中均有表达, 瘦素刺激可致p42/44MAPK磷酸化, 在体内体外均表现为促进增生作用, 表明瘦素是人结肠上皮细胞的生长因子. 在动物实验中, Suganami et al研究证明瘦素可上调VEGF的表达, 并刺激视网膜血管生成. 王友彬 et al实验显示, 瘦素可促进移植鼠颗粒脂肪组织血管增生从而对移植脂肪组织起促成活作用. Rouet-Benzineb et al在瘦素抗凋亡的体外细胞实验中观察到瘦素处理后NF-κB的活化明显增加. Patel et al研究报道用同源基因GAX抑制血管内皮细胞的NF-κB激活后, 血管生成也被抑制了.
以前对结直肠腺癌的研究往往着眼于肿瘤实质、腺上皮细胞的状态, 而忽视了实质周围的间质细胞和内环境变化. 对瘦素的研究也着重于全身血清瘦素水平的变化与摄食营养、肿瘤的关系, 忽视了受全身因素影响较小的局部组织中的瘦素受体的变化, 而瘦素必须与其受体结合后才能发挥效应. 本实验中发现瘦素受体在结直肠腺癌间质血管内皮细胞和其他间质细胞上表达, 具有促血管生成作用, 并对其机制进行了初步探讨.
本实验结果表明结直肠腺癌组织中Ob-R表达增多对肿瘤血管生成起促进作用, 并且该作用可能是通过NF-κB途径来实现的. Ob-R和NF-κB可能为抗肿瘤血管生成治疗提供了新的靶点.
瘦素(leptin): 肥胖基因(Ob基因)的编码产物, 是主要由白色脂肪组织分泌的蛋白质类激素. 胃主细胞、壁细胞及胃底的内分泌细胞中也存在瘦素, 其受体遍及脑和全身各处组织, 也是一种脑肠肽类激素. 瘦素及其受体的结构与细胞因子具有同源性, 其细胞信号转导通路与细胞因子也有惊人的相似性. 瘦素与其受体结合后具有广泛的生物学效应;
NF-κB: 即核转录因子-κB, 静息时存留于胞质, 受到刺激而激活后, 进入细胞核, 作用于靶基因, 迅速诱导靶基因表达. 其作为一个多向性转录调节因子, 可调控多种生长因子、黏附分子、细胞因子的表达. 是一条重要的细胞内信号转导途径.
本实验就一直在能量平衡和摄食行为系统中研究的脑肠肽瘦素受体与大肠癌的关系进行了研究, 立题新颖, 并且得出初步结果: 该受体可能与大肠癌的血管生成有一定关系. 课题设计合理, 数据详实, 对大肠癌生物学特征的阐明有一定理论意义.
电编: 张敏 编辑:张焕兰
| 1. | Calle EE, Rodriguez C, Walker-Thurmond K, Thun MJ. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med. 2003;348:1625-1638. [PubMed] [DOI] |
| 2. | Frezza EE, Wachtel MS, Chiriva-Internati M. Influence of obesity on the risk of developing colon cancer. Gut. 2006;55:285-291. [PubMed] [DOI] |
| 4. | Weidner N, Semple JP, Welch WR, Folkman J. Tumor angiogenesis and metastasis-correlation in invasive breast carcinoma. N Engl J Med. 1991;324:1-8. [PubMed] [DOI] |
| 5. | Sierra-Honigmann MR, Nath AK, Murakami C, Garcia-Cardena G, Papapetropoulos A, Sessa WC, Madge LA, Schechner JS, Schwabb MB, Polverini PJ. Biological action of leptin as an angiogenic factor. Science. 1998;281:1683-1686. [PubMed] [DOI] |
| 6. | Suganami E, Takagi H, Ohashi H, Suzuma K, Suzuma I, Oh H, Watanabe D, Ojima T, Suganami T, Fujio Y. Leptin stimulates ischemia-induced retinal neovasculari-zation: possible role of vascular endothelial growth factor expressed in retinal endothelial cells. Diabetes. 2004;53:2443-2448. [PubMed] [DOI] |
| 7. | Hardwick JC, Van Den Brink GR, Offerhaus GJ, Van Deventer SJ, Peppelenbosch MP. Leptin is a growth factor for colonic epithelial cells. Gastroenterology. 2001;121:79-90. [PubMed] [DOI] |
| 8. | Wang SN, Chuang SC, Yeh YT, Yang SF, Chai CY, Chen WT, Kuo KK, Chen JS, Lee KT. Potential prognostic value of leptin receptor (Ob-R) in hepatocellular carcinoma. J Clin Pathol. 2006;. [PubMed] |
| 9. | Rouet-Benzineb P, Aparicio T, Guilmeau S, Pouzet C, Descatoire V, Buyse M, Bado A. Leptin counteracts sodium butyrate-induced apoptosis in human colon cancer HT-29 cells via NF-kappaB signaling. J Biol Chem. 2004;279:16495-16502. [PubMed] [DOI] |
| 10. | Kim H, Koh G. Lipopolysaccharide activates matrix metalloproteinase-2 in endothelial cells through an NF-kappaB-dependent pathway. Biochem Biophys Res Commun. 2000;269:401-405. [PubMed] [DOI] |
| 11. | Joyce D, Albanese C, Steer J, Fu M, Bouzahzah B, Pestell RG. NF-kappaB and cell-cycle regulation: the cyclin connection. Cytokine Growth Factor Rev. 2001;12:73-90. [PubMed] [DOI] |
| 12. | Patel S, Leal AD, Gorski DH. The homeobox gene Gax inhibits angiogenesis through inhibition of nuclear factor-kappaB-dependent endothelial cell gene expression. Cancer Res. 2005;65:1414-1424. [PubMed] [DOI] |