修回日期: 2006-07-26
接受日期: 2006-08-14
在线出版日期: 2006-09-18
X染色体连锁的凋亡抑制基因(X-linked inhibitor of apoptosis protein gene, XIAP)是凋亡抑制基因家族中重要的成员之一, 其编码的蛋白XIAP通过选择性的抑制caspase-3, -7和-9, 并参与其他途径来抑制细胞的凋亡, 与肿瘤的发生、发展和预后有着密切关系, 针对XIAP的反义核酸和XIAP小分子抑制剂已经进入临床和临床前实验阶段, 同时人们正尝试通过XIAP特异的siRNA (small interfering RNA)等其他手段来治疗肿瘤. 我们就XIAP的生物学特性及其在肿瘤治疗中的研究进展作一综述.
引文著录: 张曙光, 刘芝华, 张林. 凋亡抑制基因XIAP在肿瘤治疗中的研究进展. 世界华人消化杂志 2006; 14(26): 2626-2631
Revised: July 26, 2006
Accepted: August 14, 2006
Published online: September 18, 2006
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2006; 14(26): 2626-2631
- URL: https://www.wjgnet.com/1009-3079/full/v14/i26/2626.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i26.2626
细胞凋亡的紊乱与肿瘤的发生、发展有着密切的关系. 凋亡抑制基因家族是近年来发现的高度保守的内源性抑制细胞凋亡的基因家族、目前的研究发现, 在人类凋亡抑制基因家族中共有8个成员: BIRC1-BIRC8, 他们编码的蛋白构成凋亡抑制蛋白IAPs (inhibitor of apoptosis proteins)家族[1]. 在人类凋亡抑制基因家族的8个成员中, BIRC4(X染色体连锁的凋亡抑制基因, XIAP)和BIRC5(存活素, survivin)备受关注, 被认为是最有潜力的治疗靶点. 由于survivin与肿瘤的耐药有关, 并且其在肿瘤组织中远远超过在正常组织中表达, 已经被作为一个治疗靶点处于研究之中; 但是因为目前survivin抗凋亡和抗细胞增殖的机制并不明确, 以suvivin作为治疗靶点是否合适仍在讨论之中[2]. 而这一基因家族中的BIRC3 (cIAP2)也被认为是有潜力的治疗靶点, 但是对于他的研究仍处于起始阶段[3]. XIAP的结构和生物学机制最为明确, 他能够选择性抑制caspase-3, caspase-7和caspase-9, 通过抑制效应性的caspase-3和caspase-7, IAPs能够抑制caspase凋亡通路的下游途径, 从而使细胞免于各种刺激所导致的凋亡[4]. 因此, 在caspase凋亡通路中, XIAP是唯一能够同时抑制起始阶段和效应阶段的IAP. 由于其凋亡抑制作用, 过度表达的XIAP使多种肿瘤细胞产生对化疗的耐药; XIAP不仅在许多恶性肿瘤细胞系中过表达, 同时在许多类肿瘤患者的肿瘤组织中存在过表达并伴随着较差的预后. 目前研究认为, XIAP是IAPs家族中最有研究价值的肿瘤治疗靶点.
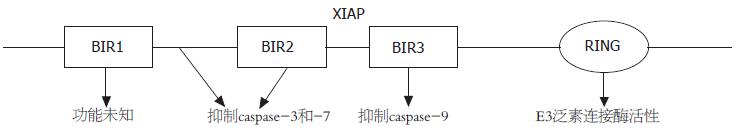
XIAP, 又称BIRC4 (baculoviral IAP repeat-containing 4), 定位于Xq25, mRNA全长8413 bp, 编码区位于129 bp-1622 bp之间, 其编码的蛋白XIAP相对分子量约为57 kDa, 主要由3个杆状病毒IAP重复序列BIR1-BIR3 (baculoviral inhibitor of apoptosis repeat)和一个RING锌指样结构域 (really new gene Zinc finger domain)组成(图1). 下面通过对其结构和相应功能进行分析, 找出其能作为肿瘤治疗靶点的结构基础. BIR3结构域: BIR3结构域能够结合并抑制caspas-9的活性, 而caspase-9是线粒体介导的caspase激活凋亡途径中的始动caspase. 研究发现, 过表达的BIR3结构域cDNA能够抑制Bax等所引起的线粒体凋亡途径中caspase的激活, 但是并不能对肿瘤坏死因子(TNF)凋亡途径起作用. 同样研究发现, 影响BIR3结构域的点突变降低了XIAP凋亡抑制作用, 但是这种XIAP凋亡抑制作用的减弱仅仅可被Bax所诱导[5]. 通过对BIR3结构域与caspase-9结合的结构进行分析, 发现BIR3与caspase-9单体形成异源二聚体, 使caspase-9保持单体结构, 丧失催化活性[6], BIR3结构域上的caspase-9结合区域正是蛋白抑制剂的设计靶点. BIR2结构域: 与BIR3结构域不同的是, BIR2结构域能结合并抑制活化的caspase-3和caspase-7, caspase-3和caspase -7是效应酶, 尤其是caspase-3是细胞膜、线粒体和内质网3条凋亡途径的共同的最终效应酶, 抑制了他的活性, 也就抑制了细胞的凋亡. 研究发现, 过表达的BIR2结构域cDNA能够同时抑制死亡因子受体途径和线粒体途径刺激因素所致的凋亡; 同样, 影响BIR2结构域N端的点突变使XIAP无法在Fasl或Bax所诱导的凋亡中发挥抗凋亡作用[5]. 研究发现, BIR2结构域能够直接结合并抑制caspase-7, 而对caspase-3的抑制则需要BIR2结构域的N端linker和BIR2结构域共同参与, 通过"hook-line-sinker"模式对caspase-3进行抑制[7-11]. 这表明, 在设计以BIR2结构域为靶点的蛋白抑制剂时应同时考虑其N端的linker. BIR1结构域: 关于BIR1结构域的具体功能目前还不明确, 现在的研究发现, 在caspase抑制中, 他协助BIR2结构域完成对caspase-3和caspase-7的抑制, 为BIR2的N端linker提供一个"bulk". 研究发现, 当BIR1结构域的linker区出现点突变后, BIR2不能对caspase进行抑制, 说明BIR1对BIR2起到协同作用[12]. 还有人发现, BIR1结构域可能与细胞周期和有丝分裂有关, 但是具体机制仍不明确. RING锌指样结构域: XIAP的RING结构域具有E3泛素连接酶活性, 能够使蛋白泛素化进而加速蛋白质的降解. 早期的研究认为, XIAP的E3连接酶能够使XIAP自身泛素化并最终使自身降解[13]. 但是最近的研究发现, XIAP的这种自身泛素化并没有太大意义, 因为他并不会促进自身的降解. 相反, XIAP的E3连接酶不仅不促进自身的降解, 反而通过促进降解caspase-9和caspase-3以及内源性的XIAP抑制剂SMAC, 进而增强XIAP的抗凋亡作用[14]. 但是, RING结构域的突变并不会降低XIAP的抗凋亡活性[15]. 所以, 针对XIAP的E3连接酶的抑制, 虽然不能抑制XIAP活性, 但是可以配合其他XIAP抑制剂, 可能会发挥更好的XIAP抑制作用. XIAP可以通过其他方式抑制凋亡: XIAP可以参与细胞信号的调节, 核转录因子(NF-kB)除了能保护细胞免受TNF家族介导的凋亡外, 同时与肿瘤的侵袭和转移密切相关, XIAP能够通过多种方式激活NF-kB, 而NF-kB反过来又能上调XIAP; XIAP首先能与转化生长因子b激活性激酶(TAK1)和TAK1结合蛋白因子(TAB1)形成复合体, 该复合体可以激活c-Jun氨基末端激酶(JNK1), JNK1最终可以激活NF-kB[16-17]; NF-kB亚单位p65转移至细胞核是NF-kB激活的前提, XIAP恰可以促进这一过程[16]; XIAP还可以促进NF-kB抑制剂IkB的降解, 使NF-kB的活性不被抑制[18]. 研究发现, XIAP对JNK和NF-kB的激活是通过E3泛素连接酶实现的, 所以针对RING结构域的抑制可以通过阻止NF-kB所致的凋亡抑制, 达到诱导细胞凋亡[18]. 还有的报道提出, XIAP能够提高细胞内铜的水平, 进而使铜依赖的抗凋亡酶类活性增强, 达到凋亡抑制的作用[19]. XIAP还可以参与细胞周期的调节: 在血管内皮细胞的研究中发现, 过度表达的XIAP能使细胞停留在G0-G1期, 同时伴随着细胞周期素D1的下调, 而当XIAP降解后, 细胞进入凋亡; 故XIAP通过细胞周期的调节, 使细胞处于休眠状态, 逃避凋亡[18]. 但是, 其在凋亡抑制中的意义和具体机制仍然不清楚, 并且在肿瘤研究中还没发现有相似的作用.
体外实验发现, 许多恶性肿瘤细胞系中存在着XIAP的过表达, 并且XIAP的过表达与肿瘤的耐药密切相关, 通过反义寡核苷酸和siRNA (small interfering RNA)方法降解XIAP的mRNA, 进而消除XIAP的表达, 使得许多肿瘤细胞恢复了化疗的敏感性[20-21]; 而这种对XIAP的缺失对正常细胞系没有任何影响. 体内实验发现, XIAP缺失的肿瘤细胞成瘤性明显降低, 并且通过体内应用XIAP抑制剂能够延缓荷瘤小鼠的肿瘤生长[22]. 临床研究发现, 肿瘤患者肿瘤组织中的XIAP表达水平与肿瘤的预后密切相关, 但是研究发现, 在不同的肿瘤中其预后意义并不相同. 在成人和儿童的新生急性髓细胞样白血病(AML)患者中, XIAP低表达的患者的生存率明显高于XIAP高表达的患者[23-24]; 同样, 在肾透明细胞癌患者中, XIAP高表达的患者其肿瘤的分化程度低而且预后差[25]. 而有的研究表明, XIAP的表达与预后没有关系[26-27]. 还有的研究发现, XIAP的高表达提示好的预后, 在行肺癌根治手术后的非小细胞肺癌患者中, 患者肺癌组织中XIAP高表达者较低表达着的生存期明显延长[28]; 但是从其XIAP本身的生物学特性而言, 人们至今仍无法理解XIAP的高表达预示着好的预后, 而且并没有相似的研究报道. 目前人们对此的解释是: XIAP仅仅是IAPs家族中的一员, 单单考虑XIAP这一个因素还不能说明IAPs对肿瘤预后的影响; 另外, XIAP的翻译后调节可能会影响其功能, 但是并不影响其表达水平; 还有可能就是XIAP的高表达可能是肿瘤凋亡诱导因素之一; 再者就是XIAP可能有些功能还不为我们所知. 总之, XIAP与肿瘤的发生、发展、对放化疗的抵抗以及与肿瘤的预后密切相关, XIAP可以作为肿瘤治疗的一个靶点.
以XIAP为肿瘤治疗靶点的研究主要从3个方面进行: (1)针对XIAP mRNA的反义寡核苷酸类抑制剂, 现已经进入临床实验阶段; (2)针对XIAP蛋白的小分子抑制剂, 包括内源性的XIAP抑制剂, 有的已处于临床前研究阶段; (3)随着RNA干扰(RNA interfering, RNAi)这种新的技术的出现, 针对XIAP mRNA的siRNA也正逐渐进入到XIAP的肿瘤研究中来, 目前这种方法正处于实验室研究阶段.
用于治疗实体肿瘤和血液系统恶性肿瘤的XIAP mRNA反义寡核苷酸已有制药公司进行生产, 并已进入到了临床实验阶段. 目前用于临床实验的XIAP反义寡核苷酸是19 nt的第二代产品, 能与靶向mRNA互补形成双链结构, 这段双链结构能够诱使mRNA被酶切, 而相应的反义寡核苷酸仍能维持原来的结构, 并继续同mRNA结合并诱导mRNA的酶切[29]. 体外实验研究发现, 对XIAP mRNA的降解出现在转染6-9 h后, 相应蛋白降低出现在转染12-18 h后, 并且对XIAP mRNA的降解可达到70%. 应用反义寡核苷酸使XIAP mRNA的降解并最终使XIAP表达降低, 发现其能直接诱导凋亡并增加细胞对化疗的敏感性. 例如, 在人类肺癌细胞系H460中, 应用反义寡核苷酸处理肿瘤后, 能直接诱导H460的凋亡, 并且使其对泰素、长春新碱和依托泊苷的化疗的敏感性增强; 荷瘤小鼠研究表明, 将反义寡核苷酸注入肿瘤后, 能够降低肿瘤内XIAP的表达, 并且肿瘤的生长缓慢, 当同时应用依托泊苷后, 肿瘤的生长抑制作用更加明显[30]. 目前在英国, Aegera公司(http://www.aegera.com)已经将反义寡核苷酸投入到一期临床实验阶段, 在现阶段的研究中, 除了检测其安全性和效率外, 着重检测其药代动力学, 并通过检测受试患者的肿瘤活检标本, 看是否能达到mRNA的降解作用和降低XIAP的表达[29].
人类的内源性的XIAP抑制剂SMAC和HTRA2是线粒体蛋白, 当线粒体破裂, 他们能随着细胞色素C进入胞质内, 在胞质内, 活化的或片段形式的SMAC和HTRA2能够结合并抑制包括XIAP在内的IAPs[31-32]. 目前, 对于HTRA2的研究还不是很明确, 大部分的研究集中在SMAC上. 研究发现, 应用和SMAC的N端序列相同的人工合成多肽能够达到抑制XIAP的作用; 将该种多肽导入肿瘤细胞中, 发现其有化疗增敏作用, 当把他和顺铂合用时能够抑制肺癌细胞的生长, 当与TNF相关凋亡诱导配体(TRAIL)合用时能够抑制荷瘤小鼠的神经胶质瘤生长[33-34]. 通过结构上的研究发现, SMAC能够同时和XIAP的BIR2和BIR3结构域结合, 并且活化的SMAC其N端的4-7个氨基酸是功能必需的且足以结合并抑制BIR3结构域与caspase-9结合, 相应位置的突变则失去了这种作用; SMAC同样可以和BIR2结构域结合, 并抑制其功能, 但是具体的机制不详[35-36]. 因此, 模仿内源性XIAP抑制剂的作用, 我们可以设计出相应的XIAP抑制剂, 进而发挥抗肿瘤作用, 现在的许多研究正是在试图设计出相应的类似物, 但是效果还有待于深入研究.
随着对XIAP结构和功能的逐步明确, 人们正在针对相应的功能性结构域设计抑制剂. BIR3结构域抑制剂: 通过对BIR3与caspase-9的结构和相互作用的分析, 提示人们可以模仿SMAC的作用方式设计出小分子抑制剂, 抑制BIR3与caspase-9的结合. 随着生物学的发展, 人们正尝试包括荧光偏振、核磁共振和计算机模型设计等不同的方法来设计和寻找BIR3抑制剂. 目前, 科研人员已经设计并构建出了有效的三肽类BIR3抑制剂, 这些抑制剂含有人造的氨基酸残基, 体外研究发现, 这些抑制剂能够直接诱导一系列恶性肿瘤的凋亡[37]. 同样科研人员从中药矮地茶中提取信筒子素, 已有的实验证实, 其具有SMAC同样的黏性, 并能与BIR3结构域结合, 继而阻止其与caspase-9结合; 在前列腺癌细胞系中研究发现, 在微克级信筒子素的作用下, 可以直接诱导前列腺癌细胞凋亡[38-39]; 在动物研究中发现, 信筒子素是安全的, 仅会引起可逆性的雄激素降低和暂时性的生育障碍, 目前, 信筒子素是最有望进入临床实验的BIR3抑制剂[40]. 科研人员同时还发现了其他的抑制剂, 但是同种抑制剂在不同的细胞系, 有的能够直接引起细胞凋亡, 有的仅会增强放疗的敏感性, 虽然目前的研究结果令人鼓舞, 但是在近期内尚无法进入临床实验阶段. BIR2结构域抑制剂: Wu et al[41]首先通过高通量酶阻遏试剂盒筛选的方法, 发现了包括TWX006和TWX024在内的XIAP抑制剂, 他们能够结合XIAP的BIR2的linker区域, 并且其能够比SMAC更有效的阻止XIAP与caspase-3结合, 并且能够促使caspase-3恢复活性. 应用相似的筛选方法, 人们又发现了多聚苯脲类的BIR2结构域抑制剂, 体外研究发现, 其对肿瘤细胞的毒性远远超过对正常细胞的毒性作用; 紧接着的动物实验证明, 其有延缓前列腺癌、乳腺癌和结肠癌生长的作用, 并且对裸鼠无毒性[42-43]. 目前, 第2代多聚苯脲类的BIR2结构域抑制剂亦已被合成并处于临床前研究阶段[29]. E3泛素连接酶抑制剂: E3泛素连接酶在肿瘤治疗中是一个很吸引人的治疗靶点, 目前针对MDM2的E3泛素连接酶小分子抑制剂nutlins已经用于治疗中[44]. 而能够选择性的抑制XIAP中的E3泛素连接酶可以阻止XIAP对caspase-3和caspase-9的泛素化作用, 并能够阻止XIAP激活NF-kB, 但是如前所述, 单纯抑制XIAP中的E3泛素连接酶只能部分缓解而不能完全阻滞其凋亡抑制作用, 必须同其他结构域的抑制剂联合应用才能发挥更大的作用, 所以选择性的XIAP E3泛素连接酶抑制剂可能成肿瘤治疗的辅助剂.
RNAi是新近发现的技术, 是近年来最重要的科技发现之一, 其较比单纯的反义技术有更高的效率; 其机制简单概括为siRNA结合一个核酶复合物形成所谓的RNA诱导的沉默复合物(RNA-induced silencing complex, RISC), 活化以后的RISC定位到与siRNA反义链互补的靶mRNA上, 并在距离siRNA 3'端12个碱基的位置切割mRNA, 从而使mRNA降解. Chawla-Sarkar et al[45]猜测黑色素瘤的耐药可能与XIAP有关, 他们将化学合成的靶向特异性的XIAP-siRNA转染到黑色素瘤细胞, 紧接着应用Apo2l/Trail处理细胞, 发现细胞的凋亡明显增加, 然后他们又进行了肾癌的细胞实验得到了同样的结果. 同样的报道, 通过XIAP-siRNA可以使神经胶质瘤、乳腺癌、胰腺癌等对化疗的敏感性增强[21,46-47]. 体内研究发现, 将XIAP-siRNA的质粒表达载体转染到乳腺癌细胞后, 其在裸鼠的成瘤能力明显降低, 并且肿瘤的生长明显变缓[22]. siRNA较反义寡核苷酸的有特异性和高效性的特点, 虽然siRNA技术还不成熟, 现在进行的研究较少, 但是从长远来看, 其比反义寡核苷酸更有发展潜力.
仍然有许多问题困扰着以XIAP作为肿瘤治疗靶点的研究者. 如前所述, 凋亡抑制基因家族有8个成员, 如果其他的成员有着比XIAP更强的凋亡抑制作用, 那样仅以XIAP作为靶点就没有将整个凋亡抑制基因家族作为靶点所起的作用大. 反义RNA和siRNA属于基因治疗的范畴, 其转染效率以及安全性问题仍未能很好解决. 而对于XIAP的小分子抑制剂, 研究者还没有获得其完整的活性谱, 而且在不同的研究中XIAP小分子抑制剂起作用的方式不同, 一些研究中XIAP小分子抑制剂对肿瘤细胞有直接毒性作用, 而在其他的研究中发现, XIAP小分子抑制剂仅有化疗增敏作用, 为什么会出现这种不同仍然需要进一步的研究; 另外, 肿瘤对XIAP小分子抑制剂的耐药也是必须要考虑的问题, 因为我们不知道在我们应用XIAP小分子抑制剂后, 肿瘤细胞的XIAP会不会发生相应的突变, 从而产生耐药.
总之, XIAP基因发现到现在仅仅10余年的时间, 以其作为肿瘤治疗靶点的研究已经从实验室进入了临床研究阶段, 随着对这一基因家族研究的不断深入, 我们相信会给肿瘤的治疗带来新的希望.
肿瘤是威胁人类生命的重大疾病之一, 但目前对肿瘤机制和治疗的研究仍处于探索之中、肿瘤的一个重要特征就是凋亡的减少, 新近发现的细胞凋亡抑制蛋白家族(IAPs)在肿瘤的生长中起着很大作用, 其成员X染色体连锁的凋亡抑制蛋白(XIAP)能同时抑制凋亡通路中的caspases-3, -7和-9, 并能通过其他的途径抑制细胞的凋亡, 现有的研究发现, 其可能为肿瘤治疗的一个重要靶点.
目前, 针对XIAP的反义寡核苷酸类抑制剂已经进入临床实验阶段, 针对其蛋白的小分子抑制剂也已经进入临床前研究阶段, RNA干扰技术也进入到这一领域研究中来, 并有望成为一种有效的治疗方法.
虽然国外对以XIAP为靶点的肿瘤治疗研究已经进入临床实验阶段, 但是国内对此的研究较少, 本文希望通过对该领域的研究进展情况作一介绍, 能够为国内的肿瘤研究提供新的思路.
XIAP: X染色体连锁的凋亡抑制基因(X-linked inhibitor of apop-tosis protein gene), 是人类凋亡抑制基因家族中的8个成员之一, 在人类凋亡抑制基因家族中共有8个成员: BIRC1-BIRC8, 其中BIRC4即XIAP, BIRC5是存活素survivin, 他们编码的蛋白能通过多种途径抑制细胞的凋亡.
本文对凋亡抑制基因XIAP在肿瘤治疗中的研究进展进行了较系统的综述, 有参考价值.
电编: 张敏 编辑:王晓瑜
| 1. | Nachmias B, Ashhab Y, Ben-Yehuda D. The inhibitor of apoptosis protein family (IAPs): an emerging therapeutic target in cancer. Semin Cancer Biol. 2004;14:231-243. [PubMed] [DOI] |
| 2. | Zaffaroni N, Pennati M, Daidone MG. Survivin as a target for new anticancer interventions. J Cell Mol Med. 2005;9:360-372. [PubMed] [DOI] |
| 3. | McEleny K, Coffey R, Morrissey C, Williamson K, Zangemeister-Wittke U, Fitzpatrick JM, Watson RW. An antisense oligonucleotide to cIAP-1 sensitizes prostate cancer cells to fas and TNFalpha mediated apoptosis. Prostate. 2004;59:419-425. [PubMed] [DOI] |
| 4. | Deveraux QL, Takahashi R, Salvesen GS, Reed JC. X-linked IAP is a direct inhibitor of cell-death proteases. Nature. 1997;388:300-304. [PubMed] [DOI] |
| 5. | Bratton SB, Lewis J, Butterworth M, Duckett CS, Cohen GM. XIAP inhibition of caspase-3 preserves its association with the Apaf-1 apoptosome and prevents CD95- and Bax-induced apoptosis. Cell Death Differ. 2002;9:881-892. [PubMed] [DOI] |
| 6. | Shiozaki EN, Chai J, Rigotti DJ, Riedl SJ, Li P, Srinivasula SM, Alnemri ES, Fairman R, Shi Y. Mechanism of XIAP-mediated inhibition of caspase-9. Mol Cell. 2003;11:519-527. [PubMed] [DOI] |
| 7. | Sun C, Cai M, Meadows RP, Xu N, Gunasekera AH, Herrmann J, Wu JC, Fesik SW. NMR structure and mutagenesis of the third Bir domain of the inhibitor of apoptosis protein XIAP. J Biol Chem. 2000;275:33777-33781. [PubMed] [DOI] |
| 8. | Riedl SJ, Renatus M, Schwarzenbacher R, Zhou Q, Sun C, Fesik SW, Liddington RC, Salvesen GS. Structural basis for the inhibition of caspase-3 by XIAP. Cell. 2001;104:791-800. [PubMed] [DOI] |
| 9. | Huang Y, Park YC, Rich RL, Segal D, Myszka DG, Wu H. Structural basis of caspase inhibition by XIAP: differential roles of the linker versus the BIR domain. Cell. 2001;104:781-790. [PubMed] [DOI] |
| 10. | Chai J, Shiozaki E, Srinivasula SM, Wu Q, Datta P, Alnemri ES, Shi Y. Structural basis of caspase-7 inhibition by XIAP. Cell. 2001;104:769-780. [PubMed] [DOI] |
| 11. | Scott FL, Denault JB, Riedl SJ, Shin H, Renatus M, Salvesen GS. XIAP inhibits caspase-3 and -7 using two binding sites: evolutionarily conserved mechanism of IAPs. EMBO J. 2005;24:645-655. [PubMed] [DOI] |
| 12. | Suzuki Y, Nakabayashi Y, Nakata K, Reed JC, Takahashi R. X-linked inhibitor of apoptosis protein (XIAP) inhibits caspase-3 and -7 in distinct modes. J Biol Chem. 2001;276:27058-27063. [PubMed] [DOI] |
| 13. | Yang Y, Fang S, Jensen JP, Weissman AM, Ashwell JD. Ubiquitin protein ligase activity of IAPs and their degradation in proteasomes in response to apoptotic stimuli. Science. 2000;288:874-877. [PubMed] [DOI] |
| 14. | Morizane Y, Honda R, Fukami K, Yasuda H. X-linked inhibitor of apoptosis functions as ubiquitin ligase toward mature caspase-9 and cytosolic Smac/DIABLO. J Biochem (Tokyo). 2005;137:125-132. [PubMed] [DOI] |
| 15. | Suzuki Y, Nakabayashi Y, Takahashi R. Ubiquitin-protein ligase activity of X-linked inhibitor of apoptosis protein promotes proteasomal degradation of caspase-3 and enhances its anti-apoptotic effect in Fas-induced cell death. Proc Natl Acad Sci USA. 2001;98:8662-8667. [PubMed] [DOI] |
| 16. | Hofer-Warbinek R, Schmid JA, Stehlik C, Binder BR, Lipp J, de Martin R. Activation of NF-kappa B by XIAP, the X chromosome-linked inhibitor of apoptosis, in endothelial cells involves TAK1. J Biol Chem. 2000;275:22064-22068. [PubMed] [DOI] |
| 17. | Sanna MG, da Silva Correia J, Ducrey O, Lee J, Nomoto K, Schrantz N, Deveraux QL, Ulevitch RJ. IAP suppression of apoptosis involves distinct mechanisms: the TAK1/JNK1 signaling cascade and caspase inhibition. Mol Cell Biol. 2002;22:1754-1766. [PubMed] [DOI] |
| 18. | Levkau B, Garton KJ, Ferri N, Kloke K, Nofer JR, Baba HA, Raines EW, Breithardt G. xIAP induces cell-cycle arrest and activates nuclear factor-kappaB : new survival pathways disabled by caspase-mediated cleavage during apoptosis of human endothelial cells. Circ Res. 2001;88:282-290. [PubMed] [DOI] |
| 19. | Burstein E, Ganesh L, Dick RD, van De Sluis B, Wilkinson JC, Klomp LW, Wijmenga C, Brewer GJ, Nabel GJ, Duckett CS. A novel role for XIAP in copper homeostasis through regulation of MURR1. EMBO J. 2004;23:244-254. [PubMed] [DOI] |
| 20. | Sasaki H, Sheng Y, Kotsuji F, Tsang BK. Down-regulation of X-linked inhibitor of apoptosis protein induces apoptosis in chemoresistant human ovarian cancer cells. Cancer Res. 2000;60:5659-5666. [PubMed] |
| 21. | Lima RT, Martins LM, Guimaraes JE, Sambade C, Vasconcelos MH. Specific downregulation of bcl-2 and xIAP by RNAi enhances the effects of chemotherapeutic agents in MCF-7 human breast cancer cells. Cancer Gene Ther. 2004;11:309-316. [PubMed] [DOI] |
| 22. | Zhang Y, Wang Y, Gao W, Zhang R, Han X, Jia M, Guan W. Transfer of siRNA against XIAP induces apoptosis and reduces tumor cells growth potential in human breast cancer in vitro and in vivo. Breast Cancer Res Treat. 2006;96:267-277. [PubMed] [DOI] |
| 23. | Tamm I, Richter S, Oltersdorf D, Creutzig U, Harbott J, Scholz F, Karawajew L, Ludwig WD, Wuchter C. High expression levels of x-linked inhibitor of apoptosis protein and survivin correlate with poor overall survival in childhood de novo acute myeloid leukemia. Clin Cancer Res. 2004;10:3737-3744. [PubMed] [DOI] |
| 24. | Tamm I, Richter S, Scholz F, Schmelz K, Oltersdorf D, Karawajew L, Schoch C, Haferlach T, Ludwig WD, Wuchter C. XIAP expression correlates with monocytic differentiation in adult de novo AML: impact on prognosis. Hematol J. 2004;5:489-495. [PubMed] [DOI] |
| 25. | Yan Y, Mahotka C, Heikaus S, Shibata T, Wethkamp N, Liebmann J, Suschek CV, Guo Y, Gabbert HE, Gerharz CD. Disturbed balance of expression between XIAP and Smac/DIABLO during tumour progression in renal cell carcinomas. Br J Cancer. 2004;91:1349-1357. [PubMed] [DOI] |
| 26. | Carter BZ, Kornblau SM, Tsao T, Wang RY, Schober WD, Milella M, Sung HG, Reed JC, Andreeff M. Caspase-independent cell death in AML: caspase inhibition in vitro with pan-caspase inhibitors or in vivo by XIAP or Survivin does not affect cell survival or prognosis. Blood. 2003;102:4179-4186. [PubMed] [DOI] |
| 27. | Liu SS, Tsang BK, Cheung AN, Xue WC, Cheng DK, Ng TY, Wong LC, Ngan HY. Anti-apoptotic proteins, apoptotic and proliferative parameters and their prognostic significance in cervical carcinoma. Eur J Cancer. 2001;37:1104-1110. [PubMed] [DOI] |
| 28. | Ferreira CG, van der Valk P, Span SW, Ludwig I, Smit EF, Kruyt FA, Pinedo HM, van Tinteren H, Giaccone G. Expression of X-linked inhibitor of apoptosis as a novel prognostic marker in radically resected non-small cell lung cancer patients. Clin Cancer Res. 2001;7:2468-2474. [PubMed] |
| 29. | Schimmer AD, Dalili S, Batey RA, Riedl SJ. Target-ing XIAP for the treatment of malignancy. Cell Death Differ. 2006;13:179-188. [PubMed] [DOI] |
| 30. | Hu Y, Cherton-Horvat G, Dragowska V, Baird S, Korneluk RG, Durkin JP, Mayer LD, LaCasse EC. Antisense oligonucleotides targeting XIAP induce apoptosis and enhance chemotherapeutic activity against human lung cancer cells in vitro and in vivo. Clin Cancer Res. 2003;9:2826-2836. [PubMed] |
| 31. | Du C, Fang M, Li Y, Li L, Wang X. Smac, a mitochondrial protein that promotes cytochrome c-dependent caspase activation by eliminating IAP inhibition. Cell. 2000;102:33-42. [PubMed] [DOI] |
| 32. | Verhagen AM, Silke J, Ekert PG, Pakusch M, Kaufmann H, Connolly LM, Day CL, Tikoo A, Burke R, Wrobel C. HtrA2 promotes cell death through its serine protease activity and its ability to antagonize inhibitor of apoptosis proteins. J Biol Chem. 2002;277:445-454. [PubMed] [DOI] |
| 33. | Yang L, Mashima T, Sato S, Mochizuki M, Sakamoto H, Yamori T, Oh-Hara T, Tsuruo T. Predominant suppression of apoptosome by inhibitor of apoptosis protein in non-small cell lung cancer H460 cells: therapeutic effect of a novel polyarginine-conjugated Smac peptide. Cancer Res. 2003;63:831-837. [PubMed] |
| 34. | Fulda S, Wick W, Weller M, Debatin KM. Smac agonists sensitize for Apo2L/TRAIL- or anticancer drug-induced apoptosis and induce regression of malignant glioma in vivo. Nat Med. 2002;8:808-815. [PubMed] [DOI] |
| 35. | Srinivasula SM, Hegde R, Saleh A, Datta P, Shiozaki E, Chai J, Lee RA, Robbins PD, Fernandes-Alnemri T, Shi Y. A conserved XIAP-interaction motif in caspase-9 and Smac/DIABLO regulates caspase activity and apoptosis. Nature. 2001;410:112-116. [PubMed] [DOI] |
| 36. | Wu G, Chai J, Suber TL, Wu JW, Du C, Wang X, Shi Y. Structural basis of IAP recognition by Smac/DIABLO. Nature. 2000;408:1008-1012. [PubMed] [DOI] |
| 37. | Oost TK, Sun C, Armstrong RC, Al-Assaad AS, Betz SF, Deckwerth TL, Ding H, Elmore SW, Meadows RP, Olejniczak ET. Discovery of potent antagonists of the antiapoptotic protein XIAP for the treatment of cancer. J Med Chem. 2004;47:4417-4426. [PubMed] [DOI] |
| 38. | Nikolovska-Coleska Z, Xu L, Hu Z, Tomita Y, Li P, Roller PP, Wang R, Fang X, Guo R, Zhang M. Discovery of embelin as a cell-permeable, small-molecular weight inhibitor of XIAP through structure-based computational screening of a traditional herbal medicine three-dimensional structure database. J Med Chem. 2004;47:2430-2440. [PubMed] [DOI] |
| 39. | Chitra M, Sukumar E, Suja V, Devi CS. Antitumor, anti-inflammatory and analgesic property of embelin, a plant product. Chemotherapy. 1994;40:109-113. [PubMed] [DOI] |
| 40. | Johri RK, Dhar SK, Pahwa GS, Sharma SC, Kaul JL, Zutshi U. Toxicity studies with potassium embelate, a new analgesic compound. Indian J Exp Biol. 1990;28:213-217. [PubMed] |
| 41. | Wu TY, Wagner KW, Bursulaya B, Schultz PG, Deveraux QL. Development and characterization of nonpeptidic small molecule inhibitors of the XIAP/caspase-3 interaction. Chem Biol. 2003;10:759-767. [PubMed] [DOI] |
| 42. | Berezovskaya O, Schimmer AD, Glinskii AB, Pinilla C, Hoffman RM, Reed JC, Glinsky GV. Increased expression of apoptosis inhibitor protein XIAP contributes to anoikis resistance of circulating human prostate cancer metastasis precursor cells. Cancer Res. 2005;65:2378-2386. [PubMed] [DOI] |
| 43. | Schimmer AD, Welsh K, Pinilla C, Wang Z, Krajewska M, Bonneau MJ, Pedersen IM, Kitada S, Scott FL, Bailly-Maitre B. Small-molecule antagonists of apoptosis suppressor XIAP exhibit broad antitumor activity. Cancer Cell. 2004;5:25-35. [PubMed] [DOI] |
| 44. | Vassilev LT, Vu BT, Graves B, Carvajal D, Podlaski F, Filipovic Z, Kong N, Kammlott U, Lukacs C, Klein C. In vivo activation of the p53 pathway by small-molecule antagonists of MDM2. Science. 2004;303:844-848. [PubMed] [DOI] |
| 45. | Chawla-Sarkar M, Bae SI, Reu FJ, Jacobs BS, Lindner DJ, Borden EC. Downregulation of Bcl-2, FLIP or IAPs (XIAP and survivin) by siRNAs sensitizes resistant melanoma cells to Apo2L/TRAIL-induced apoptosis. Cell Death Differ. 2004;11:915-923. [PubMed] [DOI] |
| 46. | Li Y, Jian Z, Xia K, Li X, Lv X, Pei H, Chen Z, Li J. XIAP is related to the chemoresistance and inhibited its expression by RNA interference sensitize pancreatic carcinoma cells to chemotherapeutics. Pancreas. 2006;32:288-296. [PubMed] [DOI] |
| 47. | Hatano M, Mizuno M, Yoshida J. Enhancement of C2-ceramide antitumor activity by small interfering RNA on X chromosome-linked inhibitor of apoptosis protein in resistant human glioma cells. J Neurosurg. 2004;101:119-127. [PubMed] [DOI] |