修回日期: 2006-06-26
接受日期: 2006-07-19
在线出版日期: 2006-09-18
目的: 探讨大鼠重型急性胰腺炎(SAP)并发腹内压(IAP)增高(IAH)对肺脏的病理损害.
方法: 健康Wistar大鼠91只, 分为假手术组、SAP模型组及SAP+IAH组. 在不同时间(1, 2, 4 h) SAP模型的基础上, 给大鼠不同IAP (2, 4, 10 cmH2O), 观察肺脏的功能及组织结构变化.
结果: 随着腹内压的升高及作用时间的延长, 氧分压(PaO2)明显下降、二氧化碳分压(PaCO2)升高, 肺组织含水量增加. 光镜下可以观察到肺脏间质及肺泡炎性细胞浸润、水肿、出血, 肺泡细胞出现空泡化、脱落及衰变等病理改变. 电镜下观察到Ⅱ型肺泡上皮细胞核固缩, 板层体呈空泡样, 线粒体嵴肿胀, 形成凋亡细胞等病理改变.
结论: SAP并发IAP增高可导致大鼠肺损伤.
引文著录: 崔云甫, 黄睿, 郑宏群. 大鼠重症急性胰腺炎并发腹内压升高导致肺损伤. 世界华人消化杂志 2006; 14(26): 2601-2604
Revised: June 26, 2006
Accepted: July 19, 2006
Published online: September 18, 2006
AIM: To study the pathological changes in acute lung injury induced by severe acute pancreatitis (SAP) complicated with intra-abdominal hypertension (IAH).
METHODS: Ninety-one healthy Wistar rats were divided into sham operation group (n = 7), SAP model group (n = 21), and SAP+IAH group (n = 63). Based on SAP modeling at different time (1, 2, 4 h), the rats were given IAH of 2, 4, 10 cmH2O. Then lung function was evaluated and the pathological changes of rat lungs were observed under light and electron microscope.
RESULTS: With the increase of IAP and prolonging of action time, the partial pressure of oxygen was obviously decreased, while the partial pressure of carbon dioxide was markedly elevated; the lung water content was dramatically increased. Light microscopy showed that inflammatory cell, edema, intra-alveolar hemorrhage, desquamate and disintegration appeared in the lung tissues. Electron microscopy demonstrated type Ⅱ alveolar epithelial cell karyopyknosis, laminated body becoming vacuole-like, swelling of crista mitochondria, and emergence of cell apoptosis.
CONCLUSION: SAP complicated with IAH can lead to lung injury in rats.
- Citation: Cui YF, Huang R, Zheng HQ. Experimental study on severe acute pancreatitis-induced intra-abdominal hypertension complicated with acute lung injury. Shijie Huaren Xiaohua Zazhi 2006; 14(26): 2601-2604
- URL: https://www.wjgnet.com/1009-3079/full/v14/i26/2601.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i26.2601
重症急性胰腺炎(SAP)是外科常见的急腹症, 来势较凶险, 早期可表现为休克、多器官功能不全(MODS), 严重者引起多器官衰竭(MOF). SAP时胰外器官损伤中呼吸功能障碍最早发生, 其发生率高达20%-70%. SAP可引起腹内压力升高(IAH), IAH在SAP引起MOF中所起的作用已被多数学者肯定并接受, 但IAH对呼吸功能的影响及其是否是呼衰发病机制之一尚无相关报道. 我们建立了SAP并发IAH导致大鼠肺损害的模型, 与临床SAP并发腹腔室隔综合征(ACS)致肺损害的病理过程相似, 为进一步研究腹内高压对机体的病理生理影响奠定基础.
从一次性输液器剪下40 cm左右长度输液管, 保留有过滤器一端并与三通管相连; 将输液管另一端连接至压力计. 成年健康清洁级Wistar大鼠91只(哈医大实验动物中心提供), 雌雄不限, 体质量200±20 g(周龄8-10 wk).
Wistar大鼠91只随机分成3组: 第1组7只为假手术组; 第2组21只为SAP组, 分1, 2, 4 h组, 分别于3个时间点取病理; 第3组63只为SAP并发IAP增高组, 按腹内压大小随机分为2, 4, 10 cmH2O组, 再按作用时间分为1, 2, 4 h组, 分别于3个时间点取病理, 检测有关指标. 参照Milani et al报道的模型稍加改进制作SAP大鼠模型. 即大鼠术前12 h禁食, 不禁水. 10 g/L戊巴比妥钠5 mL/kg ip麻醉动物后, 正中切口入腹, 于十二指肠韧带肝门侧用小动脉夹暂时阻闭胆管, 由十二指肠前壁进针, 经乳头部插进入胆胰管内, 夹闭胆胰管出口, 以0.1 mL/min匀速注入50 g/L牛磺胆酸钠(0.1 mL/kg, Sigma), 10 min后去除动脉夹, 关腹. SAP模型制成后仰卧位固定后常规消毒, 于剑突下两横指处以16号留置套管针穿刺至腹腔并固定, 通过三通管分别连接压力计及氮气储气袋, 缓慢增加入腹气体量, 至相应压力后将三通管转向压力计, 持续测压, 并维持压力恒定, 以建立SAP+IAP增高模型. 假手术组除胆管内不注入50 g/L牛磺胆酸钠外, 余同SAP组. 制模成功后观察动物死亡率. 于动物活杀时抽取腹主动脉血, 立即用AVL-900自动分析仪进行血气测定. 动物活杀后, 取左肺组织用分析天平称湿质量, 置90 ℃电热干燥箱内烘烤72 h, 称干质量, 结果以肺组织湿/干比质量表示肺含水量. 按时间点活杀动物, 取胰腺组织常规行病理切片光镜观察, 肺组织分别行光、电镜观察.
统计学处理 所有数据以mean±SD表示, 采用SPSS 11.0行统计学分析. 组内数据应用配对t检验, 组间比较采用方差分析.
假手术组大鼠一般状态良好, 无一例死亡. SAP组随时间的延长死亡率逐渐增加, 4 h组死亡率可达25%. SAP+IAH各组随压力梯度及时间的延长死亡率明显增加, 4 h组死亡率可达50%.
SAP组模型制成后PaO2呈进行性下降, 术后1, 2, 4 h与假手术组相比差异显著(P<0.05); PaCO2术后1, 2, 4 h SAP组呈升高趋势与假手术组相比差异显著(P<0.05). SAP+IAH 2 cmH2O作用1 h PaO2即明显降低, PaCO2显著升高; SAP+IAH 4 cmH2O 1, 2, 4 h, PaO2与正常对照组相比显著降低(P<0.01), PaCO2在1, 2, 4 h明显增高, 出现明显的低氧血症高碳酸血症. IAH 10 cmH2O作用1, 2, 4 h , PaO2与正常对照组相比显著降低(P<0.01), PaCO2显著增高(表1).
| 分组 | PaO2 | PaCO2 | |
| Control | 98.8±4.2 | 39.2±2.4 | |
| SAP | 1 h | 95.8±3.2 | 39.3±2.1 |
| 2 h | 90.1±2.3 | 42.2±1.3 | |
| 4 h | 80.7±1.7a | 45.5±2.0 | |
| SAP+IAH 2 cmH2O | 1 h | 89.0±4.2ac | 39.0±3.7 |
| 2 h | 84.8±2.9ac | 42.6±1.0 | |
| 4 h | 78.2±2.4ac | 47.1±2.2 | |
| SAP+IAH 4 cmH2O | 1 h | 74.5±5.3ac | 49.3±3.1ac |
| 2 h | 69.0±4.0ac | 52.9±5.5ac | |
| 4 h | 65.9±3.2bc | 55.0±4.4ac | |
| SAP+IAH 10 cmH2O | 1 h | 59.3±1.7bd | 65.4±8.3bd |
| 2 h | 53.5±5.0bd | 69.7±7.8bd | |
| 4 h | 50.3±4.0bd | 72.3±7.1bd | |
肺湿质量/干质量比值在SAP组与假手术组比差异显著(P<0.05); SAP+IAH 2 cmH2O, 4 cmH2O, 10 cmH2O 1, 2, 4 h与假手术组相比显著降低(P<0.01)(表2).
大体观察SAP组成模后20 min后即出现胰腺充血、水肿, 时间延长到4 h, 胰腺局部出现紫红色坏死灶, 中等量血性腹水. SAP并发IAP增高组, 胰腺坏死程度进一步加重, 并伴大量血性腹水. 假手术组无明显变化. 光镜观察SAP组随时间点的延长, 胰腺出血坏死、间质水肿、炎细胞浸润、红细胞渗出的SAP病理变化渐加重. SAP并发IAP增高组在成模后1 h及2 h时间点内, 胰腺的病理改变与SAP组无明显差别. 但随作用时间延长到4 h胰腺出血坏死、间质水肿、炎细胞浸润、红细胞渗出等典型的SAP病理变化进一步加重.
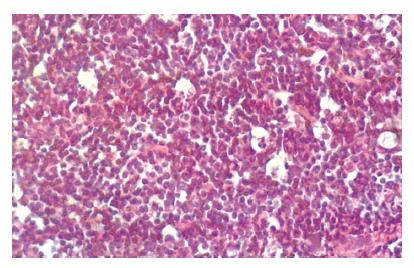
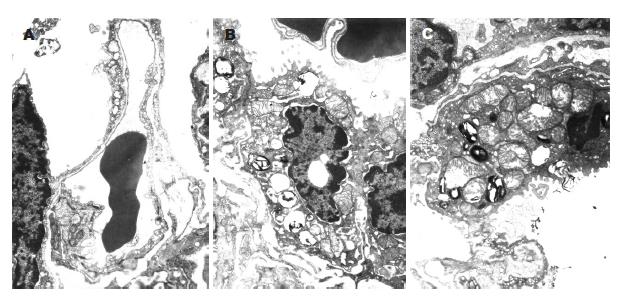
光镜观察假手术组大鼠肺组织, 间质及肺泡腔无出血、水肿及中性粒细胞浸润. SAP组光镜下肺病理改变逐渐加重, 间质及部分肺泡腔有较多中性粒细胞, 毛细血管瘀血, 肺泡腔出血水肿范围较假手术组增高组明显. SAP并发IAP增高组, 光镜下大部分肺泡和间质有中性粒细胞聚积成团, 间质明显增宽, 肺泡腔出血水肿范围50%-75%(图1). 电镜观察SAP组Ⅱ型肺泡上皮细胞数量增多, 毛细血管管腔狭窄, 血管内皮细胞的胞质内可见丰富的胞内饮泡, 基膜厚薄不均(图2A), Ⅱ型上皮细胞的核呈固缩状态, 核周隙明显增宽, 板层体呈空泡样, 线粒体嵴肿胀, 细胞表面微绒毛脱失(图2B). SAP并发IAP增高组, Ⅱ型肺泡上皮细胞核固缩, 细胞内膜结构消失, 形成凋亡细胞, 板层体减少, 脱落(图2C).
IAP的临床病情与腹内压的变化密切相关, 原因为IAP的许多病理生理变化能直接或间接导致IAH; 而IAH特别是腹腔间隙综合征对SAP的许多胰外临床表现都具有重要影响作用. IAP导致腹内压增高的因素有: 胰腺体积的增大、胰周积液、后腹膜及周围组织水肿、胃肠道的麻痹扩张、腹腔积液、全身炎症反应综合征(SIRS)引起的多个脏器水肿等. 已有研究表明[1], ACS是引发多器官功能衰竭的潜在继发因素, 但其发病机制尚不十分清楚. 而ACS造成肺损害的病理改变更是鲜有报道. 特重型AP(也称暴发性胰腺炎)常伴发ACS, 进而带来极高的病死率. 有报道SAP发病凶险, 病死率高达50%, 在发病1 wk内死亡者, 多由于急性肺损伤所致. 可见急性肺损伤与SAP密切相关. 但SAP导致肺损伤的机制尚不清楚. 因此我们通过建立SAP基础上IAH模型, 从病理形态学方面阐明肺损害的特点, 探讨SAP导致肺损伤的机制. 发现急性肺损害改变, 如镜下出现肺间质及肺泡炎性细胞浸润、水肿、出血, 肺泡细胞出现空泡化. 肺泡间隔大量中性粒细胞浸润, 超微结构显示大量中性粒细胞, 单核细胞贴壁并游出血管外, 提示活化的中性粒细胞或单核细胞可能参与了SAP肺损伤. 但是, SAP基础上IAH引起的肺损害程度要重于SAP组, 这说明IAP增高帮助加重了肺损害的程度, 是造成呼吸衰竭的机制之一.
过去关于SAP并发急性呼吸衰竭的研究中, 重点多放在由胰源性毒素、炎性介质[2]、微循环障碍等因素所导致的急性呼吸窘迫综合征方面, 而对SAP并发IAH形成ACS导致肺损伤的机制鲜有研究. 最近也有学者提出, SAP所并发的急性呼吸衰竭, 不单纯是急性呼吸窘迫综合征所造成的, ACS也起到重要作用. ACS发生肺损害的机制目前认为主要与血管渗漏[3]、缺血再灌注损伤、血管活性物质的释放以及氧自由基等综合作用相关. 我们建立SAP基础上并发IAH的肺损害模型, 由于动物死亡的原因只观察了4 h, 而SAP基础上并发IAH后远期肺损害的发生机制, 除了胰蛋白酶、中性粒细胞、磷脂酶A2、蛋白酶/抗蛋白酶系统失衡、游离脂肪酶等介导性损伤外, 可能与SAP后脏器缺血/再灌注损伤、弹性蛋白酶、血小板活化因子、内源性细菌/内毒素移位等介导性损伤的关系更为密切, 尚有待于进一步探讨和研究. 我们通过建立SAP并发ACS导致肺损害的动物模型, 为进一步探讨SAP并发ACS导致肺损害的机制以及防治对策提供了一种较为理想的实验手段.
重症急性胰腺炎(SAP)是外科常见的急腹症, 来势较凶险, 早期可表现为休克、多器官功能不全(MODS), 严重者引起多器官衰竭(MOF). SAP时胰外器官损伤中呼吸功能障碍最早发生, 其发生率高达20%-70%. SAP可引起腹内压力升高(IAH), IAH在SAP引起MOF中所起的作用已被多数学者肯定并接受.
程君涛et al报道的改良腹内高压动物模型的方法, 操作简单易行, 为进行腹内高压的研究提供了一种新方法.
重症急性胰腺炎并发肺损伤已有定论, 许多发病机制已阐明. 但目前重症急性胰腺炎并发腹内压升高导致肺损伤的研究尚少, 这是本研究立题独到之处.
本文紧密结合临床, 建立了重症急性胰腺炎并发腹内压升高导致肺损伤的动物模型, 为进一步探讨重症急性胰腺炎并发腹腔室隔综合征导致肺损害的机制以及防治对策提供了一种较为理想的实验模型.
1 腹内压(Intra-abdominal pres-sure, IAP)主要是由腹腔内脏器的静水压产生, 正常情况下IAP平均为0 kPa (1 kPa = 7.5 mmHg), 和大气压相近.
2 腹腔室隔综合征(abdominal compartment syndrome, ACS): 是由于IAP非生理性急剧升高到影响内脏血流及器官组织功能, 并进一步引起一系列不利的病理生理改变所形成的一种临床综合表现. 主要临床表现有呼吸道阻力增加、肺顺应性下降甚至进行性缺氧、心输出量减少、周围循环阻力增加、少尿甚至无尿.
SAP可引起IAH, 致膈肌抬高, 胸腔压力随之增高, 肺通气量下降, 肺毛细血管嵌压, 平均毛细血管压升高, 因此, 研究IAH对呼衰发病影响有一定价值. 本实验建立了SAP并发IAH导致大鼠肺损害的模型, 观察肺脏的功能及组织结构变化, 探讨了SAP并发IAP增高对肺脏的病理损害, 有一定价值. 建议进一步深入进行其缺血再灌注损伤、血管活性物质的释放以及氧自由基等机制研究.
电编: 张敏 编辑:潘伯荣
| 1. | Hobson KG, Young KM, Ciraulo A, Palmieri TL, Greenhalgh DG. Release of abdominal compartment syndrome improves survival in patients with burn injury. J Trauma. 2002;53:1129-1133; discussion 1133-1134. [PubMed] [DOI] |
| 2. | Gross V, Leser HG, Heinisch A, Scholmerich J. Inflammatory mediators and cytokines--new aspects of the pathophysiology and assessment of severity of acute pancreatitis? Hepatogastroenterology. 1993;40:522-530. [PubMed] |
| 3. | Marx G, Vangerow B, Burczyk C, Gratz KF, Maassen N, Cobas Meyer M, Leuwer M, Kuse E, Rueckholdt H. Evaluation of noninvasive determi-nants for capillary leakage syndrome in septic shock patients. Intensive Care Med. 2000;26:1252-1258. [PubMed] [DOI] |