修回日期: 2006-07-26
接受日期: 2006-07-31
在线出版日期: 2006-09-08
目的: 观察前列腺素E2 (PGE2)对胃癌MKN28细胞血管内皮生长因子(VEGF) mRNA转录、蛋白表达水平的影响.
方法: 对胃癌MKN28细胞分别给予0.1, 1, 5, 10 μmol/L浓度的PGE2处理3 h, 分别以实时PCR, Western blot检测VEGF mRNA转录水平及VEGF蛋白表达水平的变化.
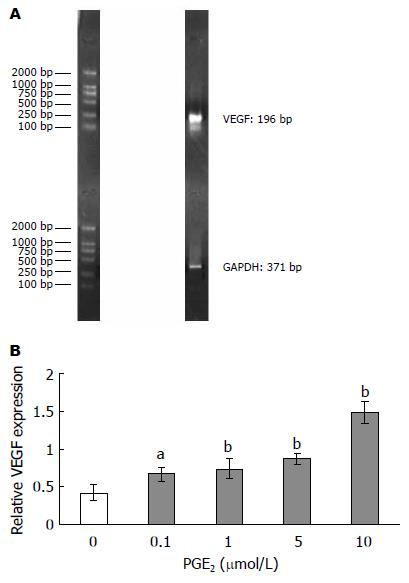
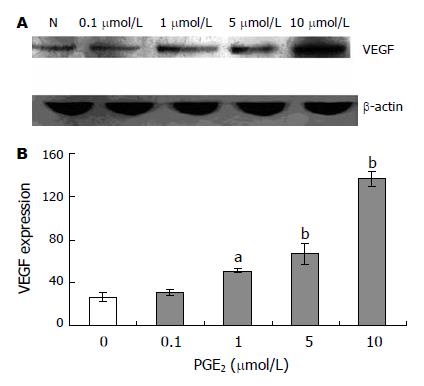
结果: 胃癌MKN28细胞经用不同浓度的PGE2作用3 h, VEGF mRNA表达呈剂量依赖性增加, 其表达在PGE2浓度为0.1, 1, 5, 10 μmol/L时与对照组之间的差异均有统计学意义(0.67±0.093, 0.74±0.13, 0.87±0.07, 1.49±0.15 vs 0.42±0.10, P<0.05或P<0.01). VEGF蛋白表达量与PGE2浓度存在正相关, 其表达在PGE2浓度为1, 5, 10 μmol/L组与对照组之间的差异均有统计学意义(51.02±2.16, 66.69±9.85, 136.49±6.89 vs 26.87±3.98, P<0.05或P<0.01).
结论: 外源性PGE2可显著增加胃癌MKN28细胞VEGF的表达.
引文著录: 肖炜明, 施瑞华, 丁岩冰, 吴健, 童建东, 严志刚. PGE2对胃癌MKN28细胞VEGF表达的影响. 世界华人消化杂志 2006; 14(25): 2546-2550
Revised: July 26, 2006
Accepted: July 31, 2006
Published online: September 8, 2006
AIM: To investigate the expression of vascular endothelial growth factor (VEGF) in human gastric cell line MKN28 in vitro, and identify whether exogenous prostaglandin E2 (PGE2) can increase the expression of VEGF.
METHODS: Human gastric cell line MKN28 was culture in vitro and then treated with 0.1, 1, 5, and 10 μmol/L PGE2 for 3 h. Real-time polymerase chain reaction (PCR) and Western blot were used to detect the expression of VEGF mRNA and protein, respectively.
RESULTS: The transcription of VEGF mRNA increased in a dose-dependent manner after PGE2 treatment, and the difference between the groups of 0.1, 1, 5, 10 μmol/L PGE2 treatment and the control group had statistical significances (0.67 ± 0.093, 0.74 ± 0.13, 0.87 ± 0.07, 1.49 ± 0.15 vs 0.42 ± 0.10, P < 0.05 or P < 0.01). PGE2 also up-regulated the expression of VEGF protein in a dose-dependent manner, and except 0.1 μmol/L PGE2 treatment group, the difference between the groups of 1, 5, 10 μmol/L PGE2 treatment and the control group had statistical significances (51.02 ± 2.16, 66.69 ± 9.85, 136.49 ± 6.89 vs 26.87 ± 3.98, P < 0.05 or P < 0.01).
CONCLUSION: PGE2 can promote VEGF mRNA transcription and protein expression in human gastric cancer cell line MKN28.
- Citation: Xiao WM, Shi RH, Ding YB, Wu J, Tong JD, Yan ZG. Effects of prostaglandin E2 on expression of vascular endothelial growth factor in human gastric cancer cell line MKN28. Shijie Huaren Xiaohua Zazhi 2006; 14(25): 2546-2550
- URL: https://www.wjgnet.com/1009-3079/full/v14/i25/2546.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i25.2546
环氧化酶-2(cyclooxygenase-2, COX-2)是一种诱导酶, 在细胞受到各种刺激时, 如组织损伤、炎症或细胞恶性转化时表达增强. 近年来大量的研究已表明, COX-2与胃癌的发生和进展高度相关. COX-2促进恶性肿瘤发生的主要作用机制之一是通过其重要产物前列腺素E2(prostaglandin E2, PGE2) 而实现的, PGE2能够增加癌细胞与基质的黏附, 促进黏附分子表达, 激活细胞骨架系统, 促进新生血管形成并进而促进肿瘤浸润和转移[1-2]. 研究还表明PGE2可上调血管内皮生长因子(vascular endothelial growth factor, VEGF)等血管生成因子的表达, 进而参与肿瘤的新生血管生成[3-4]. 我们探讨不同浓度的外源性的PGE2对胃癌MKN28细胞VEGF mRNA和VEGF蛋白的表达的影响, 以进一步阐明COX-2在胃癌发生、发展中的作用.
DMEM-F12培养基(GIBCO), 胎牛血清(Life Technologies), TRIzol Reagent RNA抽提试剂盒(Invitrogen公司), RNase抑制剂(Promega公司), RNA Master SYBR Green I kit (Roche公司), DEPC (Promega公司), 荧光定量PCR仪(Roche 公司), DNA Marker (DL2000) (TaKaRa公司), 丙烯酰胺、亚甲双丙烯酰胺、SDS、β-巯基乙醇(Sigma公司, 北京夏斯生物技术公司分装), 牛血清白蛋白(Sigma公司), PGE2 (Calbiochem公司), β-actin多抗(Santa Cruz公司), VEGF多抗、羊抗兔二抗(Santa Cruz公司), 其他试剂为进口分装或国产分析纯.
将MKN28胃癌细胞株(上海瑞金医院消化科惠赠)在DMEM-F12培养基(含100 mL/L胎牛血清, 青霉素100 kU/L, 链霉素100 kU/L, 无菌状态下抽滤)中37 ℃, 50 mL/L CO2及饱和湿度培养. MKN28胃癌细胞株依PGE2浓度分成不同的处理组, PGE2作用浓度分别为0.1 μmol/L, 1 μmol/L, 5 μmol/L, 10 μmol/L, 作用3 h后收集细胞分别进行Real-Time PCR, Western blot检测. 不加PGE2处理的设为对照组.
1.2.1 VEGF mRNA的测定: 收集细胞, 加入1 mL TRIzol试剂提取总RNA, 用紫外分光光度仪测定其浓度和纯度, 并用12 g/L甲醛变性琼脂糖凝胶电泳鉴定总RNA的完整性. 取总RNA (500 mg/L) 1 μL在Lightcycler仪器上进行Real-Time PCR, 反应程序: 61 ℃逆转录20 min, 95 ℃预变性2 min, 然后进入循环: 95 ℃变性5 s, 58 ℃退火5 min, 72 ℃延伸13 s, 30个循环. 逐渐降温至30 ℃. 在每个循环末80 ℃时进行实时荧光检测. 应用Primer Premier 5.0和Oligo 6设计PCR扩增引物. VEGF引物为: 5'-CCTGGTGGACATCTTCCAGGAGTACC-3'和5'-GAAGCTCATCTCTCCTATGTGCTGGC-3'; 设内参照GAPDH的引物为: 5'-CACCATCTTCCAGGAGCGAG-3'和5'-TCACGCCACAGTTTCCCGGA-3'. 取扩增产物在15 g/L琼脂糖凝胶上电泳, 然后在High Performance Ultraviolet Transilluminator (UVP)凝胶成像系统上扫描, 并分析结果. 采用瑞士Roche公司的定量分析系统进行相对定量, 用GAPDH的Ct值与VEGF基因Ct值的比值代表该基因在每份样本中的相对含量.
1.2.2 Western blot检测VEGF的蛋白的表达: 收集细胞, 细胞裂解液裂解细胞, 制备总蛋白, 使最终上样总蛋白为40 μg, 进行100 g/L SDS-PAGE蛋白电泳(100 V恒压电泳2-2.5 h), 电泳完毕后以湿转移的方法(288 mA, 88 min)将分离的蛋白条带转移至硝酸纤维素膜上. 将转膜后的胶用考马斯亮蓝染液37 ℃染色并观察转膜效率. 使用50 g/L脱脂牛奶37 ℃封闭孵育1 h, 加入1:200稀释的VEGF多抗, 4 ℃摇动下过夜, 洗膜, 加入含1:2000稀释的过氧化物酶联二抗, 37 ℃摇动孵育2 h, 洗膜, 用ECL化学发光法显影. 以小鼠抗人β-actin抗体作为一抗进行Western blot检测, 作为判断结果的内参照. 显影之后根据Western blot彩色标准电泳指示条带(marker)中的位置, 分析所测电泳条带的性质. 电泳条带经Image J软件处理, 进行各实验组条带与对照组条带面积灰度值分析, 目的条带与内参照条带的比值代表目的蛋白的表达水平.
统计学处理 应用SPSS 10.0软件包分析处理, 数据用以mean±SD表示, 两组数据比较采用t检验. P<0.05有统计学意义.
Real-Time PCR扩增产物的电泳结果显示: VEGF片段长度在100-250 bp之间, GAPDH片段长度在250-500 bp之间, 符合设计的长度(图1A). 经PGE2作用3 h, VEGF mRNA目的条带灰度随PGE2浓度的增高而逐渐增强. 用内参照条带与目的基因条带的比值进行分析, 结果显示VEGF mRNA的表达在PGE2浓度为0.1 µmol/L, 1 µmol/L, 5 µmol/L, 10 µmol/L处理组与对照组之间的差异均有统计学意义(0.67±0.093 vs 0.42±0.10, P<0.05; 0.74±0.13, 0.87±0.07, 1.49±0.15 vs 0.42±0.10, P<0.01), 说明经PGE2作用3 h, VEGF mRNA表达呈剂量依赖性增加, PGE2在转录水平影响VEGF的表达(图1B).
胃癌MKN28细胞中可检测到较弱的VEGF蛋白水平表达, 经PGE2作用3 h, VEGF蛋白条带灰度逐渐增强, 用目的条带与内参照条带的比值代表目的蛋白的表达水平进行分析, 结果显示VEGF蛋白表达量与PGE2浓度存在正相关(图2). VEGF蛋白表达在PGE2浓度为1 μmol/L, 5 μmol/L, 10 μmol/L组与对照组之间的差异均有统计学意义(51.02±2.16 vs 26.87±3.98 P<0.05; 66.69±9.85, 136.49±6.89 vs 26.87±3.98, P<0.01), PGE2浓度为0.1 μmol/L时, VEGF蛋白表达量也增加, 但无统计学意义.
胃癌在我国是高发的恶性肿瘤之一, 其死亡率在所有恶性肿瘤中居第一位, 严重危害人民身体健康. 近年来通过对COX-2在胃癌组织中表达的检测以及流行病学、细胞学实验、动物学实验等大量的研究已证实, COX-2与胃癌的发生和进展高度相关, COX-2在胃癌中呈高表达, 而且其表达水平和淋巴结转移、肿瘤分期存在高度的相关性[5]. 已有的研究结果提示COX-2催化合成的前列腺素(PG)如前列腺素E2 (PGE2)有促进癌症发生、发展的作用[4,6], 同时COX-2抑制剂通过减少PG的生成而具有防治胃癌、结肠癌等实体瘤的作用[7-8], 但确切机制不详. 近年来研究观察到PGE2具有促进肿瘤血管生成的作用, 而COX-2抑制剂可抑制肿瘤血管的生成[9], 因而对PGE2在肿瘤血管生成中作用机制的研究成了肿瘤研究领域一个热点[10]. 在癌症发生、发展的各个阶段均有血管新生过程. 癌细胞来源的生长因子通过旁分泌途径刺激局部内皮细胞增殖形成血管芽, 并向分泌这些生长因子的部位(肿瘤)生长[11]. 肿瘤组织内的新生血管越丰富, 肿瘤细胞生长越快、越容易发生血行转移. 因此, 新生血管的形成在肿瘤的发生、发展过程中起着极其重要的作用. 目前常采用微血管密度(microvessel density, MVD)来定量评估肿瘤的新生血管. 不少研究发现, 随着肿瘤MVD的增加, 肿瘤侵袭转移等恶性潜能也明显增加[12-13]. 启动肿瘤血管新生的因子众多, 目前已知的血管生成促进因子包括VEGF、血小板源生长因子、转化生长因子、表皮细胞生长因子等. 其中VEGF是第1个确定性状特点的血管特异生长因子, 是最重要的血管形成促进因子, 在创伤和大多数肿瘤(包括实体瘤和血液系统瘤)的生长过程中高度表达, 为肿瘤细胞的生长和新生血管网的建立提供营养, 并与肿瘤的转移、预后相关[14].
在胃癌的发生、发展过程中, 同样涉及到肿瘤新生血管的形成, 并与患者的预后密切相关. 研究[15-17]发现在胃癌组织中COX-2的表达、PGE2的含量和MVD存在高度的相关性, COX-2表达与VEGF表达也显著相关, COX-2与VEGF-C表达水平并与淋巴结转移相关. 我们认为COX-2促肿瘤血管形成可能是通过PGE2促进胃癌组织VEGF等相关基因表达来实现的. PGE2可刺激实体肿瘤中新生血管的产生, 从而促进肿瘤生长, 增加肿瘤转移的机率. 研究者在细胞水平上已证明PGE2可促进小鼠巨噬细胞和结肠癌细胞的VEGF表达增加[18-19]. Huang et al[20]也证实, COX-2质粒转染可增加HIF-1α (hypoxia-inducible factor-1a)及VEGF在胃癌AGS细胞株中表达, 从而增加胃癌细胞向远处转移的机率, 选择性COX-2抑制剂NS398可以通过抑制COX-2酶活性, 减少PGE2产生而抑制这一过程. 本项研究检测了人胃癌MKN28细胞VEGF mRNA转录、蛋白表达的水平以及PGE2对胃癌MKN28细胞VEGF表达的影响. 研究结果显示, PGE2可正向调节胃癌MKN28细胞VEGF mRNA转录水平及VEGF蛋白表达. Real-Time PCR结果显示, 随PGE2作用浓度的增加, VEGF mRNA转录水平也明显增加. Western blot实验结果进一步显示, PGE2作用后, VEGF蛋白表达水平明显增加, 且蛋白表达水平与PGE2浓度呈正相关. 提示PGE2可以通过增加VEGF表达, 促进肿瘤新生血管的生成, 进一步增加肿瘤转移的机率.
由此可见, 在肿瘤的转移和侵袭过程中, COX-2/PGE2增加肿瘤细胞中的VEGF表达是其中重要的一环. COX-2/PGE2可通过增加VEGF表达, 增加实体肿瘤中MVD, 扩大肿瘤组织的营养来源, 给肿瘤细胞提供充足的营养条件, 进而促进肿瘤细胞增殖; 高表达的VEGF还可刺激局部血管或淋巴管增殖, 增加肿瘤细胞转移的机率. 这可能是COX-2诱导肿瘤血管生成的机制之一, 提示COX-2抑制剂可抑制VEGF表达和肿瘤血管生成, 这为临床应用COX-2抑制剂抗胃癌血管生成提供了理论依据.
胃癌是消化道最常见的恶性肿瘤, 其发病率和死亡率居我国恶性肿瘤之首, 5年存活率很低. 因此寻找一种新的、有效的胃癌化学预防、治疗方案成为令人瞩目的课题. 近年来COX-2及其产物PGE2在促肿瘤血管生成方面的作用受到研究者的关注.
COX-2, PGE2在肿瘤血管生成作用机制的研究成了肿瘤研究领域一个热点. VEGF是肿瘤血管形成的关键驱动因子, 和肿瘤的发生、发展密切相关. COX-2诱导肿瘤血管生成的机制之一可能是通过其催化合成的PGE2上调VEGF等血管生成因子有关.
本研究以胃癌MKN28细胞株作为研究对象, 首次证实PGE2对胃癌细胞VEGFmRNA转录、蛋白表达水平的影响, 国内尚缺乏这方面的报道.
本文提示PGE2可以通过增加VEGF表达, 促进肿瘤新生血管的生成, 进一步增加肿瘤转移的机率. 这可能是COX-2诱导肿瘤血管生成的机制之一, 为临床应用COX-2抑制剂抗胃癌血管生成提供了理论依据.
本课题以胃癌细胞株为研究对象, 研究前列腺素E2对其VEGF转录及表达的影响, 实验设计合理, 方法学可靠, 结果显示前列腺素E2能增加VEGF转录及表达水平, 且与剂量正相关, 对于进一步阐明COX在胃癌发生、发展中的作用具有一定意义.
电编: 张敏 编辑:张焕兰
| 1. | Dohadwala M, Batra RK, Luo J, Lin Y, Krysan K, Pold M, Sharma S, Dubinett SM. Autocrine/paracrine prostaglandin E2 production by non-small cell lung cancer cells regulates matrix metalloproteinase-2 and CD44 in cyclooxygenase-2-dependent invasion. J Biol Chem. 2002;277:50828-50833. [PubMed] [DOI] |
| 2. | Han C, Wu T. Cyclooxygenase-2-derived prosta-glandin E2 promotes human cholangiocarcinoma cell growth and invasion through EP1 receptor-mediated activation of the epidermal growth factor receptor and Akt. J Biol Chem. 2005;280:24053-24063. [PubMed] [DOI] |
| 3. | Leung WK, To KF, Go MY, Chan KK, Chan FK, Ng EK, Chung SC, Sung JJ. Cyclooxygenase-2 upregulates vascular endothelial growth factor expression and angiogenesis in human gastric carcinoma. Int J Oncol. 2003;23:1317-1322. [PubMed] [DOI] |
| 4. | Uefuji K, Ichikura T, Mochizuki H. Cyclooxyge-nase-2 expression is related to prostaglandin biosynthesis and angiogenesis in human gastric cancer. Clin Cancer Res. 2000;6:135-138. [PubMed] |
| 5. | Murata H, Kawano S, Tsuji S, Tsuji M, Sawaoka H, Kimura Y, Shiozaki H, Hori M. Cyclooxygenase-2 overexpression enhances lymphatic invasion and metastasis in human gastric carcinoma. Am J Gastroenterol. 1999;94:451-455. [PubMed] [DOI] |
| 6. | Takafuji VA, Evans A, Lynch KR, Roche JK. PGE(2) receptors and synthesis in human gastric mucosa: perturbation in cancer. Prostaglandins Leukot Essent Fatty Acids. 2002;66:71-81. [PubMed] [DOI] |
| 7. | Thun MJ, Namboodiri MM, Calle EE, Flanders WD, Heath CW Jr. Aspirin use and risk of fatal cancer. Cancer Res. 1993;53:1322-1327. [PubMed] |
| 8. | Giovannucci E, Rimm EB, Stampfer MJ, Colditz GA, Ascherio A, Willett WC. Aspirin use and the risk for colorectal cancer and adenoma in male health professionals. Ann Intern Med. 1994;121:241-246. [PubMed] [DOI] |
| 9. | Yao M, Zhou W, Sangha S, Albert A, Chang AJ, Liu TC, Wolfe MM. Effects of nonselective cyclooxygenase inhibition with low-dose ibuprofen on tumor growth, angiogenesis, metastasis, and survival in a mouse model of colorectal cancer. Clin Cancer Res. 2005;11:1618-1628. [PubMed] [DOI] |
| 10. | Subbaramaiah K, Dannenberg AJ. Cyclooxygenase 2: a molecular target for cancer prevention and treatment. Trends Pharmacol Sci. 2003;24:96-102. [PubMed] [DOI] |
| 11. | Bergers G, Benjamin LE. Tumorigenesis and the angiogenic switch. Nat Rev Cancer. 2003;3:401-410. [PubMed] [DOI] |
| 12. | Rasila KK, Burger RA, Smith H, Lee FC, Verschrae-gen C. Angiogenesis in gynecological oncology-mechanism of tumor progression and therapeutic targets. Int J Gynecol Cancer. 2005;15:710-726. [PubMed] [DOI] |
| 13. | Sharma S, Sharma MC, Sarkar C. Morphology of angiogenesis in human cancer: a conceptual overview, histoprognostic perspective and signifi-cance of neoangiogenesis. Histopathology. 2005;46:481-489. [PubMed] [DOI] |
| 14. | Carmeliet P, Jain RK. Angiogenesis in cancer and other diseases. Nature. 2000;407:249-257. [PubMed] [DOI] |
| 15. | Yu HG, Li JY, Yang YN, Luo HS, Yu JP, Meier JJ, Schrader H, Bastian A, Schmidt WE, Schmitz F. Increased abundance of cyclooxygenase-2 correlates with vascular endothelial growth factor-A abun-dance and tumor angiogenesis in gastric cancer. Cancer Lett. 2003;195:43-51. [PubMed] [DOI] |
| 16. | Joo YE, Rew JS, Seo YH, Choi SK, Kim YJ, Park CS, Kim SJ. Cyclooxygenase-2 overexpression correlates with vascular endothelial growth factor expression and tumor angiogenesis in gastric cancer. J Clin Gastroenterol. 2003;37:28-33. [PubMed] [DOI] |
| 17. | Zhang J, Ji J, Yuan F, Zhu L, Yan C, Yu YY, Liu BY, Zhu ZG, Lin YZ. Cyclooxygenase-2 expression is associated with VEGF-C and lymph node metastases in gastric cancer patients. Biomed Pharmacother. 2005;59 Suppl 2:S285-288. [PubMed] [DOI] |
| 18. | Fukuda R, Kelly B, Semenza GL. Vascular endothe-lial growth factor gene expression in colon cancer cells exposed to prostaglandin E2 is mediated by hypoxia-inducible factor 1. Cancer Res. 2003;63:2330-2334. [PubMed] |
| 19. | Mukutmoni M, Hubbard NE, Erickson KL. Prosta-glandin E(2) modulation of vascular endothelial growth factor production in murine macrophages. Prostaglandins Leukot Essent Fatty Acids. 2001;65:123-131. [PubMed] [DOI] |
| 20. | Huang SP, Wu MS, Shun CT, Wang HP, Hsieh CY, Kuo ML, Lin JT. Cyclooxygenase-2 increases hypoxia-inducible factor-1 and vascular endothelial growth factor to promote angiogenesis in gastric carcinoma. J Biomed Sci. 2005;12:229-241. [PubMed] [DOI] |